过敏性紫癜患儿增殖诱导配体的表达及相关机制初探*
曾艳云,龚 霞,周 延
重庆医科大学附属第一医院大足医院/重庆市大足区人民医院儿童中心,重庆 402360
过敏性紫癜(HSP)是一种以免疫球蛋白A1(IgA1)型免疫复合物沉积为主的系统性小血管炎[1],其典型的临床三联征包括紫癜、关节痛/关节炎和胃肠道受累,此外肾脏表现在受累患者中也十分常见[2]。目前研究认为半乳糖缺陷型IgA1(Gd-IgA1)在HSP发病过程中发挥重要作用[3]。然而,HSP导致血管壁损伤的机制尚不清楚。一项大型IgA全基因组关联研究发现了一个包含TNFSF13基因的位点,该基因与B细胞激活因子(BAFF)具有高度同源性(48%),被认为是与IgA相关的易感基因,编码增殖诱导配体(APRIL)[4]。APRIL是肿瘤坏死因子超家族(TNF)成员[5],除了影响人类B细胞的存活和增殖外,也可以与B细胞成熟抗原(BCMA)结合,促使人类B细胞诱导Ig重链亚类转化为IgA[6-7]。在APRIL缺陷小鼠中,观察到IgA选择性缺陷[8],这表明APRIL在IgA产生过程中发挥重要作用。为了探索APRIL在HSP中的潜在机制,本研究检测了不同临床表现的HSP患者血浆APRIL、Gd-IgA1水平及外周血B细胞BCMA mRNA表达差异,并进一步评估了其对IgA1分子糖基化和BCMA mRNA表达的影响。
1 资料与方法
1.1一般资料 选取2021年1-10月在本院初次诊断为HSP的51例门诊和住院患儿作为HSP组,年龄2~14岁,男27例,女24例,病程2~60 d。纳入标准:(1)依据2012年中华中医药学会HSP诊断标准[9];(2)处于疾病活动期;(2)血小板计数和凝血功能正常,未合并其他过敏性疾病、感染、自身免疫性疾病或其他严重的全身性疾病;(3)未服用糖皮质激素、抗氧化剂、免疫抑制剂或其他药物。51例HSP患儿按HSP疾病严重程度评价标准[10-11]进行评分。根据临床表现和实验室检查将患儿分为4个亚组:(1)皮肤型亚组(20例):典型的皮肤紫癜,无腹痛、关节痛、肾脏受累,常规尿检及24 h尿蛋白定量未见异常;(2)关节型亚组(8例):典型的皮肤紫癜伴关节肿胀疼痛;(3)腹型亚组(12例):典型的皮肤紫癜伴腹痛,粪便隐血试验阳性;(4)肾型亚组(11例):典型的皮肤紫癜伴不同程度的肾损害,尿蛋白尿和(或)血尿阳性。同时,招募年龄和性别与HSP患儿匹配的健康体检儿童作为对照组,年龄2~14岁,男27例,女30例。本研究已获得本院伦理委员会批准,以及所有患儿及家属的知情同意。
1.2仪器与试剂 ABI 7500实时荧光定量PCR仪购自ABI公司(美国),Multiskan FC全自动酶标检测仪购自Thermo Fisher公司(美国)。人外周血淋巴细胞分离液Ficoll Paque plus购自GE公司(美国),CD19+磁珠购自Becton Dickinson(美国),Trizol试剂购自Invitrogen(美国),First Strand cDNA Synthesis Kit购自Thermo Scientific(美国),TransStart Green qPCR SuperMix购自北京全式金生物技术股份有限公司(中国),人血浆Gd-IgA1 ELISA检测试剂盒和人APRIL酶联免疫吸附试验(ELISA)检测试剂盒购自北京东革生物科技有限公司(中国),人重组APRIL蛋白购自Peprotech公司(美国)。
1.3方法
1.3.1标本采集 于HSP组就诊时及对照组体检时,采用乙二胺四乙酸(EDTA)抗凝真空采集管采集患儿血液标本约5 mL。离心取血浆,分成三等份,置于-80 ℃冰箱保存。
1.3.2外周血B细胞中BCMA mRNA表达检测 使用Ficoll Paque plus通过密度梯度离心制备外周血单个核细胞(PBMC),以磷酸盐缓冲液(PBS)洗涤后,再悬浮于含1%牛血清清蛋白(BSA)的PBS中。用CD19+磁珠分选B细胞。根据Trizol使用说明书提取总RNA。采用Nano Drop 2000c分光光度计的说明测量总RNA纯度和浓度。按照First Strand cDNA Synthesis Kit说明书,取1 μg总RNA逆转录为cDNA,总反应体积为12 μL。引物序列:GAPDH正向引物为5′-CAGTCAGCCGCATCTTCTTTT-3′,反向引物为5′-GTGACCAGGCGCCCAATAC-3′;BCMA正向引物为5′-TTTGAAGGGTGTGATGCTTG-3′,反向引物为5′-ATGCGCTCATCCTCTGAAAT-3′。PCR反应体积为20 μL,反应条件为95 ℃ 15 s、60 ℃ 30 s、72 ℃ 15 s,共45个循环。BCMA mRNA的相对表达量通过2-ΔΔCt计算。
1.3.3血浆APRIL和Gd-IgA1水平测定 根据ELISA测试试剂盒的说明步骤检测血浆APRIL水平和Gd-IgA1水平。血浆标本采用酶免疫试验缓冲液按1∶50的比例稀释,培养60 min;然后,用标记抗体的洗涤缓冲液洗涤4次,孵育30 min,清洗平板并添加50 μL 三甲基铝(TMA)溶液,避光培养30 min。最后,停止显色反应,并测量450 nm及625 nm处的吸光度。
1.3.4B淋巴细胞体外培养及处理 为检测外源性APRIL对体外试验中Gd-IgA1和BCMA mRNA表达的影响,采用贴壁法从HSP组和对照组的PBMC中去除单核细胞,剩余大部分细胞为淋巴细胞。在补充有10%胎牛血清、2 mmol/L L-谷氨酰胺、100 U/mL青霉素和100 mg/mL链霉素的RPMI 1640培养基中于37 ℃培养。将B淋巴细胞以3×105/孔密度接种到96孔板中,并与25 ng/mL外源性APRIL[12]孵育48 h。800 r/min离心10 min后,收集上清液用于检测Gd-IgA1水平。此外,用CD19+磁珠分选B细胞,用荧光定量PCR(RT-qPCR)法检测其BCMA mRNA相对表达量。
2 结 果
2.1HSP组及HSP各亚组与对照组血浆APRIL水平比较 HSP组、皮肤型亚组、关节型亚组、腹型亚组患儿血浆APRIL水平分别为0.676(0.608)ng/mL、0.379(0.290)ng/mL、0.686(0.677)ng/mL、0.657(0.342)ng/mL、1.218(1.395)ng/mL,与对照组的0.139(0.251)ng/mL相比,差异均有统计学意义(P<0.05)。两两比较显示,肾型亚组血浆APRIL水平高于皮肤型亚组、关节型亚组和腹型亚组(P<0.05),皮肤型亚组血浆APRIL水平低于其他3个亚组(P<0.05),而关节型亚组与腹型亚组APRIL水平差异无统计学意义(P>0.05)。
2.2相关性分析 Spearman相关分析显示,HSP患儿血浆APRIL水平与Gd-IgA1呈正相关(r=0.876,P<0.001),与BCMA mRNA表达呈正相关(r=0.678,P<0.001),与HSP严重程度评分呈正相关(r=0.796,P<0.001)。见图1。
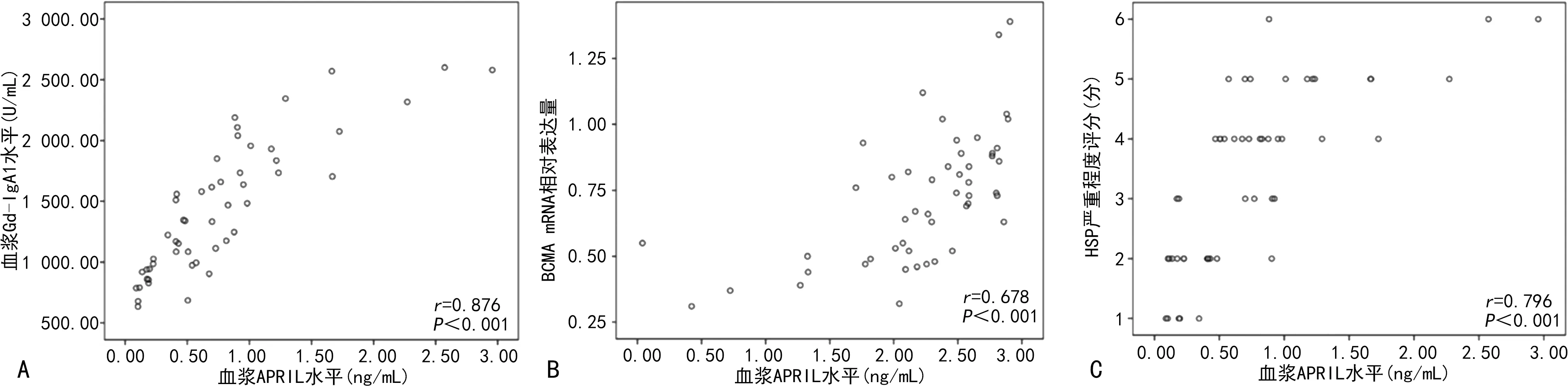
注:A为血浆APRIL水平与Gd-IgA1水平;B为血浆APRIL水平与BCMA mRNA;C为血浆APRIL水平与疾病严重程度评分。
2.3外源性APRIL对体外试验中Gd-IgA1和BCMA mRNA表达的影响 经外源性APRIL处理后,从HSP患儿分离的淋巴细胞上清液Gd-IgA1水平明显高于对照组[(0.127±0.018)U/mLvs.(0.045±0.003)U/mL,P=0.014)],BCMA mRNA水平也明显上调(1.765±0.223vs.1.206±0.081,P=0.014)。
3 讨 论
作为HSP血管壁中的主要沉积物[1],IgA分子在HSP的发病机制研究方面引起了极大关注。APRIL是一种刺激B细胞增殖和IgA产生的细胞因子[6]。研究显示,小鼠抗APRIL单克隆抗体可抑制ddY小鼠血清IgA水平,降低循环免疫复合物的肾脏沉积,并抑制蛋白尿发生[12]。本研究结果显示,HSP组患儿血浆APRIL水平增加,并且各亚组患儿,APRIL水平升高最明显,且与B细胞中其受体BCMA mRNA表达增加呈正相关,从而诱导异常糖基化IgA1分子产生增加,最终导致HSP发病和进展。
HSP是一种影响小血管的系统性血管炎[1]。在这种情况下,患者易出现血管周围炎性细胞浸润[2]。有报道称,HSP患者发生肾小球损伤的原因可能是含有Gd-IgA1的系膜免疫复合物的沉积[13],随后,补体介导的系膜细胞刺激发生,导致其增殖;同时也会刺激细胞因子的分泌[14]。因此,通常在IgA肾病患者中检测到抗原和抗体免疫复合物的肾外来源。B细胞是主要的阳性调节因子,能够产生抗原特异性免疫球蛋白和多种细胞因子[14-15]。MCCARTHY等[15]报道了一种过度表达BAFF的转基因小鼠,该小鼠在存在共生菌群的情况下与人类IgA肾病高度相似。BAFF过度表达后,小鼠出现高循环水平的异常糖基化IgA、IgA系膜沉积、血尿和蛋白尿。而APRIL与BAFF具有高度同源性,其编码基因TNFSF13被认为是IgA肾病的遗传易感位点[4]。APRIL与其特异性受体BCMA结合后,可激活下游核因子-κB(NF-κB),然后刺激外周血B细胞产生免疫球蛋白[7]。本研究发现,HSP组患儿血浆APRIL水平高于对照组,肾脏亚组血浆APRIL水平比其他3个亚组升高更显著,差异均有统计学意义(P<0.05),且血浆APRIL水平与血浆Gd-IgA1水平呈正相关,与外周血BCMA mRNA表达呈负相关。这些结果表明APRIL可能在HSP的发展中发挥重要作用,并且APRIL和Gd-IgA1有一定协同作用。
APRIL由多个细胞表达和分泌,包括单核细胞、巨噬细胞和淋巴细胞;而B细胞在其中发挥的作用更显著,并且经常参与自身免疫性疾病。ZHAI等[16]研究发现,IgA肾病患者的B细胞中APRIL mRNA和BAFF mRNA表达显著上调,但在T淋巴细胞中却没有。这可能意味着B细胞在决定血浆APRIL水平方面发挥更重要的作用。因此,本研究假设在HSP患儿的B细胞中,APRIL及其下游信号被激活。为了评估APRIL是否是HSP中Gd-IgA1增加的原因,本研究进一步分析了APRIL对体外试验中Gd-IgA1产生的影响,结果发现HSP组患儿和对照组的淋巴细胞对APRIL的反应不同,经APRIL预处理后,从HSP患儿体内分离的淋巴细胞上清液中,Gd-IgA1水平显著高于对照组(P<0.05)。本研究体外试验结果表明,APRIL在HSP组患儿Gd-IgA1产生中起一定作用。更重要的是,不仅APRIL,而且B细胞异常也可能导致HSP Gd-IgA1的升高,因为APRIL增加了HSP组患儿淋巴细胞中Gd-IgA1的生成。CD19+B细胞是产生IgA1的主要细胞[6-7],为了探讨HSP患儿淋巴细胞异常的原因,在APRIL诱导的Gd-IgA1产生方面,检测了CD19+B细胞中编码APRIL受体的BCMA mRNA表达。在HSP患儿中,BCMA mRNA表达呈上调趋势。本研究发现,HSP患儿BCMA mRNA表达异常,Gd-IgA1水平升高,推测APRIL可能通过诱导BCMA mRNA的表达、增加Gd-IgA1的水平,并与它们协同作用来诱导和加剧组织损伤。
本研究结果发现,血浆APRIL水平与Gd-IgA1水平呈正相关,体外实验也证实APRIL可以在体外细胞培养模型中诱导异常糖基化IgA1分子的产生。此外,APRIL水平较高的患儿有更严重的临床表现,尤其是肾脏受累。本研究结果显示,APRIL与HSP严重程度具有相关性,提示APRIL可能是促进Gd-IgA1产生的因素。
综上所述,HSP患儿血浆APRIL水平升高,其水平与HSP疾病严重程度有相关性,其机制可能是APRIL与其B细胞中的受体有协同作用,可诱导Gd-IgA1的产生。

