番茄酱加工中风味劣变因子的红外快速预测模型建立
方珂 ,张静瑶,张忠飞,李教勇,牛宇戈,陆维盈
1.上海交通大学农业与生物学院(上海 200240);2.上海市食品研究所有限公司(上海 200235);3.广东省粤北食药资源利用与保护重点实验室,韶关学院(韶关 512005)
番茄和番茄制品(如汁、酱、沙司、果泥等)是一类广受消费者欢迎的健康食品[1]。其营养丰富,富含维生素、矿物质、类胡萝卜素、酚类[2-3]和黄酮类等营养物质,受到消费者青睐。其中的类胡萝卜素类的番茄红素,不仅赋予番茄制品鲜艳的色泽,同时具有良好的生物活性功能,可预防癌症、动脉粥样硬化的发生,减轻体内氧化应激和炎症反应[4]。
番茄酱作为一种主要的番茄制品,其加工工艺主要包括打浆、破碎、过滤、浓缩、灭菌。在加工过程中,温度、压力、机械破坏等都会对番茄中的各种组分产生破坏和影响,从而影响番茄制品的营养品质和风味品质。加工过程中不同工艺对营养成分的影响规律,以及风味物质,尤其是风味劣变因子的确定与快速检测技术缺乏深入研究[5]。
因此,以番茄酱为研究对象,分析番茄酱加工过程中不同工艺条件下营养组分和风味物质的变化,明确品质关键控制点和标志性风味劣变因子,为提升番茄酱质量和改进加工工艺提供数据支持。针对风味劣变因子,基于红外快速检测结合偏最小二乘法建模可对风味劣变因子的含量进行快速检测。
1 材料与方法
1.1 仪器与试剂
1.1.1 试验仪器与设备
飞利浦HR2168型搅拌机(荷兰PHILIPS公司);R-215型旋转蒸发仪、V-700型真空泵和B-491型水浴锅(瑞士BUCHI公司);EUROSTAR搅拌器和A11型研磨粉碎机(德国IKA公司);ARIAS 500型折光仪(美国Reichert公司);ColorQuest XE分光光度计(美国HunterLab公司);infinite M200 PRO型酶标仪(瑞士TECAN公司);AllegraTM X-22R型冷冻离心机(美国BECKMAN COULTER公司);N-EVAPTM 112型氮吹仪(美国Organomation Associates Inc.公司);KH-500E型超声波清洗器(昆山禾创超声仪器有限公司);冷冻干燥机(美国LABCONCO公司);ACQUITY UPLC超高液相色谱系统、ACQUITY ELSD蒸发光检测器和Empower色谱工作平台(美国Waters公司);Agilent 1260型HPLC高效液相色谱系统和G1351D 1260型二极管阵列检测器(美国Agilent公司);7890A-5975C气相色谱-质谱联用仪(GCMS);色谱柱DB-wax(30 m×0.25 mm×0.25 μm,美国Agilent公司);色谱柱Carotenoid C30(150×4.6 mm,5 μm,日本YMC公司);AntarisⅡ近红外光谱仪(美国Thermo Fisher公司)。
1.1.2 原料与试剂
原料番茄采购自本地市场;无水甲醇、无水乙醇(常熟市鸿盛精细化工有限公司);PBS粉(无锡傲锐东源生物科技有限公司);浓盐酸、碳酸钠、没食子酸、氢氧化钠、芦丁(上海凌峰化学试剂有限公司);亚硝酸钠、硝酸铝(国药集团化学试剂有限公司);甲基叔丁基醚、番茄红素、维生素C、β-胡萝卜素(美国Sigma公司);乙腈(中国阿达玛斯公司)。
1.2 试验方法与仪器条件
1.2.1 番茄酱加工过程样品的制备
番茄酱加工过程实验室模拟包括清洗、制浆、热破碎、去皮去籽、浓缩及杀菌等。选取约1 kg新鲜番茄,要求充分成熟、色泽鲜艳。清洗:用纯水洗净番茄表面的污物、沙土,除去果蒂。制浆:番茄切碎后,倒入匀浆杯内,在常温下搅碎果肉,成为番茄浆液。热破碎:将第一步打碎的番茄浆液搅拌杯,放入85 ℃水浴中,用台式搅拌机机械搅拌15 min。去皮去籽:将第一步打碎的番茄浆液放入打浆机中,加入滤网,将皮、籽分离出来。浓缩:将上一步过滤网分离出的番茄汁放入旋转蒸发装置中,设置水浴85 ℃,可溶性固形物含量达到28%~30%时,停止加热。杀菌:将浓缩后番茄汁液转移至玻璃瓶中密封,沸水中加热30 min,封装。上述每一步操作取样3份,每份50 mL,作为3次平行操作用,贴上标签后放入-80 ℃冰箱过夜,用冷冻真空干燥脱水处理,干燥后样品放入-20 ℃冰箱备用。
蔡连成认为,领军企业的担当不单单体现于技术的领先,更在于一份对社会、对行业的责任心。 “比如,绿色包装就是我们的责任”,他举例说。“环境保护人人有责。绿色包装其实就是企业和个人的责任,甚至是社会和国家的责任。当然,绿色包装也可以体现产品自身的优势,给消费者带来一种绿色的感觉。我一向认为,环保的这份责任心比企业发展更重要。”
1.2.2 总酚含量变化
称取0.1 g的样品,加入3 mL甲醇,涡旋;超声提取20 min,在4 500 r/min离心5 min,收集上清液,加入3 mL甲醇,重复提取3次,合并上清液,氮气吹至干燥,加入2 mL 50%乙醇。样品避光,放入-4 ℃保存,留待检测。
在125 μL样品提取液中加入500 μL蒸馏水,加入125 μL福林酚使用液;室温下,避光反应6 min,加入1.25 mL 7% Na2CO3溶液和1 mL蒸馏水。充分混合后,将体系避光反应1.5 h,用酶标仪在760 nm波长处测定吸光度。以同比例的去离子水和试剂的混合液作为空白对照。使用没食子酸绘制标准曲线。
1.2.3 总黄酮含量变化
称取0.1 g样品,加入3 mL甲醇,涡旋;超声提取20 min,在4 500 r/min离心5 min,收集上清液,加入3 mL甲醇,重复提取3次,合并上清液,氮气吹至干燥,加入2 mL 50%乙醇。样品避光,放入-4 ℃保存,留待检测。
在125 μL样品提取液中加入500 μL蒸馏水,加入125 μL福林酚使用液;室温下,避光反应6 min,加入1.25 mL 7% Na2CO3溶液和1 mL蒸馏水。充分混合后,将体系避光反应1.5 h。吸取1.00 mL样品提取液,置于10 mL容量瓶中,加入0.4 mL 5% NaNO2,摇匀,放置6 min;加入0.4 mL 10% Al(NO3)3,摇匀,放置6 min;加入4.0 mL 5% NaOH,加水至刻度,摇匀,放置15 min。使用酶标仪在500 nm波长处测定吸光度,以同比例去离子水和试剂的混合液作为空白对照。以芦丁为参照物,绘制标准曲线并计算总黄酮含量。
1.2.4 番茄红素和胡萝卜素含量测定
称取0.1 g样品,加入3 mL氯仿,涡旋;超声提取20 min,在4 500 r/min离心5 min,收集氯仿层,加入3 mL氯仿,重复提取3次,合并氯仿层,氮气吹至干燥,加入2 mL甲基叔丁基醚(MTBE)。样品避光,放入-4 ℃保存,留待检测。检测时,取0.2 mL,用0.22 μm孔径的有机相超滤膜过滤。
类胡萝卜素采用高效液相色谱法进行检测。色谱条件:液相系统为HPLC配DAD二极管阵列检测器;色谱柱YMC C30150×4.6 mm;柱温30 ℃;分析时间15 min;进样量10 μL;流动相A采用MTBE,流动相B采用甲醇作为浓度梯度洗脱;流速0.7 mL/min。检测器DAD,波长440 nm,470 nm。
1.2.5 标志性风味物质的筛选
进样温度260 ℃;分流比为无分流;载气采用氦气(99.999%);流量1 mL/min;柱温40 ℃保持5 min,后以5 ℃/min升至250 ℃,保持5 min;接口温度260 ℃;离子源温度230 ℃;四极杆温度150 ℃;电离方式EI+,70 eV;检测器电压2 306 V;扫描方式为全扫描;质量范围20~400;NIST 2011谱库。
SPME的条件:CTC三位一体自动进样器萃取头,50/30 μm DVB/CAR,戊醛on PDMS,温度50 ℃,振荡时间15 min,萃取时间30 min,振荡速度250 r/min,解析时间4 min,GC循环时间57 min。
1.2.6 戊醛红外谱图的测定
醛类标准溶液的配制:在天平秤上,分别吸取250 mg戊醛于50 mL烧杯中,用适量无水乙醇溶解后转移至50 mL容量瓶,以乙醇定容后分别得到质量浓度5 mg/mL的戊醛溶液,作为标准储藏液。将2种标准溶液分别吸取9,8,7,6,5,4,3,2和1 mL于10 mL容量瓶,加入无水乙醇定容,分别稀释制成4.5,4.0,3.5,3.0,2.5,2.0,1.5,1.0和0.5 mg/mL的标准液。
2, 4-二硝基苯肼衍生液的配制:准确称取0.15 g 2, 4-二硝基苯肼于50 mL烧杯中,加入5 mL磷酸,搅拌使2, 4-二硝基苯肼充分溶解,转移至50 mL棕色容量瓶中,用乙腈定容后,混合均匀。
吸取4.9 mL市售新鲜番茄汁于多个50 mL离心管中,每管分别添加100 μL不同浓度梯度的戊醛标准溶液(5.0,4.5,4.0,3.5,3.0,2.5,2.0,1.5,1.0和0.5 mg/mL的戊醛溶液),涡旋混合均匀,使番茄汁中戊醛质量浓度分别为100,90,80,70,60,50,40,30,20和10 μg/mL。每种浓度重复3次平行取样。向每个离心管中加入25 mL无水乙醇,超声提取15 min,以4 500 r/min离心10 min,取5 mL上层萃取液于新的50 mL离心管中,加入5 mL 2, 4-二硝基苯肼衍生液,涡旋30 s,充分混合,常温下反应30 min,。吸取少量反应后的样液滴加到ATR(Ge晶体)上,用红外光谱仪扫描测量,波长范围为400~4 000 cm-1,扫描次数为32。
1.2.7 红外快速预测模型的建立
运用化学计量学对所得红外数据进行降维处理,提取红外谱图中与戊醛含量变化相关的有效信息,建立快速预测模型。采用主成分分析(principal component analysis,PCA)对整体红外数据进行探索性分析。主成分按方差响应大小排序,表示为PC1,PC2和PC3等,其中PC1包含最多信息。PCA分析结果以主成分得分图的形式直观呈现。偏最小二乘分析(partial least squares,PLS)用于进一步建立戊醛的定量预测模型。采用拉丁划分法将原始数据集划分为训练集和测试集,训练集用于构建最终的偏最小二乘回归模型(PLSR),而测试集用于评价模型预测能力。在建立PLSR模型时,潜变量(Latent variables,LVs)数量的选择尤为重要,过多的LVs会造成模型的过拟合[6]。因此,采用bootstrapped Latin partition程序(10 bootstraps和5-fold Latin partition,BLP)确定最佳LVs的数值[7]。所有数据处理程序都是在个人电脑上使用MATLAB R2019a(MathWorks,Natick,Massachusetts,USA)编写的内部脚本进行。
2 结果与讨论
2.1 总酚含量变化
从图1可以看出,与最初制浆的番茄浆液相比,热破碎以后总酚含量有一定下降。但是与热破碎过程相比,热浓缩和杀菌过程导致总酚含量进一步下降。由于热浓缩的样品是在热破碎的样品基础上进行试验,而杀菌过程又是在热浓缩样品基础上进行试验。所以加热时间更长,导致热效应对总酚含量伤害产生叠加作用。结果也显示,经过杀菌过程的样品总酚含量低于热浓缩的样品总酚含量,热浓缩的样品总酚含量又低于热破碎的样品总酚含量。结果表明,加热的时间增加越多将导致总酚含量下降越为严重。此外,经过滤以后,与最初制浆的番茄浆液相比总酚含量反而有所增加。推测是过滤过程实际上仍旧是一个搅拌和粉碎过程,只是多加一个过滤网。此操作过程对番茄籽和番茄皮进一步进行粉碎。番茄籽和番茄皮本身就含有一定量的酚,从图中的第6个柱状体高度可见,其含量约相当于番茄浆液的50%。因此,固体颗粒番茄籽和番茄皮中的酚在经过进一步粉碎后,又有小部分释放到液体中,从而提高经过滤后番茄汁中总酚的含量。有文献报道[8],番茄酱的加工过程中随着加热时间不同对营养成分产生不同影响。用110 ℃,15 min或110 ℃,30 min的短时间热处理会增加番茄红素、总酚类化合物、黄酮类化合物的含量。
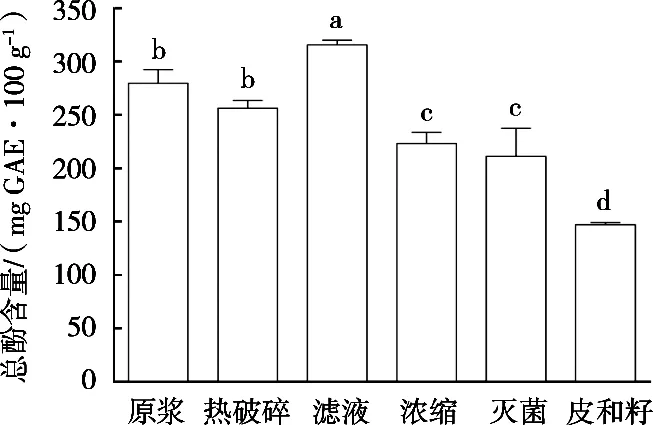
图1 番茄酱加工过程中总酚含量变化
2.2 总黄酮含量变化
从图2可以看出,经过热破碎、热浓缩和杀菌过程的样品相对于番茄浆液总黄酮含量有明显下降。加热对总黄酮量会产生一定影响,使总黄酮含量下降约30%。然而,虽然这3次加工过程中加热时间是累积增加的,但是这种累积增加的热效应并没有进一步影响黄酮含量。3种样品中的总黄酮量在经过前期影响后,含量却基本保持恒定,似乎对后期加热不再敏感。经过滤以后的样品中总黄酮含量与番茄浆液中的含量基本保持不变,不像酚类化合物在此过程中会有进一步释放。然而皮和籽中总黄酮含量相对较多,结果表明黄酮类化学物质主要存在于籽和皮中,不易释放到主要以水溶性物质组成的番茄浆液中。
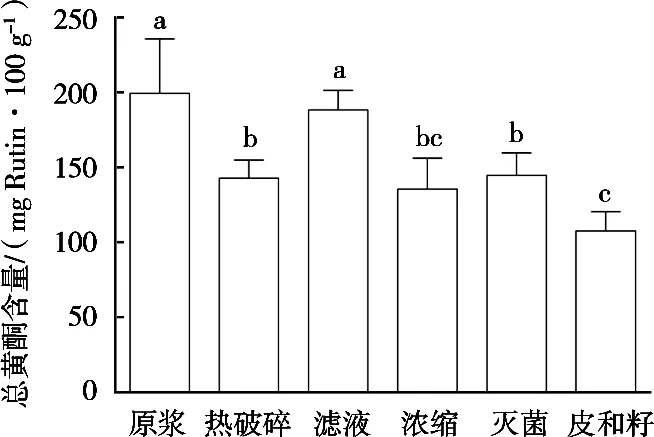
图2 番茄酱加工过程中总黄酮含量
2.3 胡萝卜素和番茄红素含量变化
从图3可以看出,与番茄浆液中β-胡萝卜素含量相比,经热破碎过程后β-胡萝卜素有进一步释放,随后的浓缩和杀菌是继续加热过程,这2个过程造成了β-胡萝卜素成分含量有所下降,但其含量仍能维持与番茄浆液中基本相当的水平。结果表明,短时间加热能促进β-胡萝卜素成分释放并溶解到主要以水溶性物质组成的番茄浆液中,但是长时间加热会造成β-胡萝卜素成分被破坏或降解。此外,经过滤后β-胡萝卜素成分有大幅提高。此过滤过程实际上仍是一个搅拌和粉碎过程,只是多加一个过滤网。这样做实际就对番茄籽和番茄皮进一步进行粉碎,所以有更多的β-胡萝卜素成分从番茄籽和番茄皮中释放并溶解到番茄浆液中。与之相反,由于番茄籽和番茄皮中的β-胡萝卜素成分被大量释放后,造成其本身所含成分的量大幅减少。
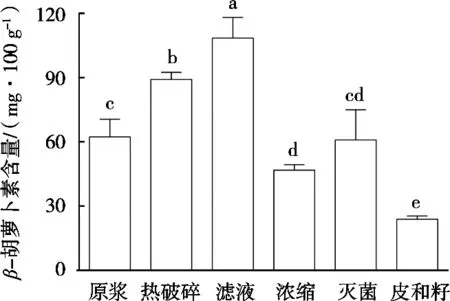
图3 番茄酱加工过程中β-胡萝卜素含量变化
从图4可以看出,与番茄浆液中番茄红素的含量相比,经热破碎过程后番茄红素有进一步释放。随后的浓缩和杀菌是继续加热过程,这2个过程造成番茄红素成分含量有所下降,但其含量仍能维持在高于番茄浆液中的水平。结果表明,短时间加热能促进番茄红素成分释放并溶解到主要以水溶性物质组成的番茄浆液中,但是长时间加热会造成番茄红素成分被破坏或降解。此外,经过滤后番茄红素成分有大幅提高。此过程实际上仍旧是一个搅拌和粉碎过程,只是多加一个过滤网。这样做实际上就对番茄籽和番茄皮进一步进行粉碎,所以有更多的番茄红素成分从番茄籽和番茄皮中释放并溶解到番茄浆液中。与之相反,由于番茄籽和番茄皮中的番茄红素成分被大量释放后,造成其本身所含成分的量大幅减少。
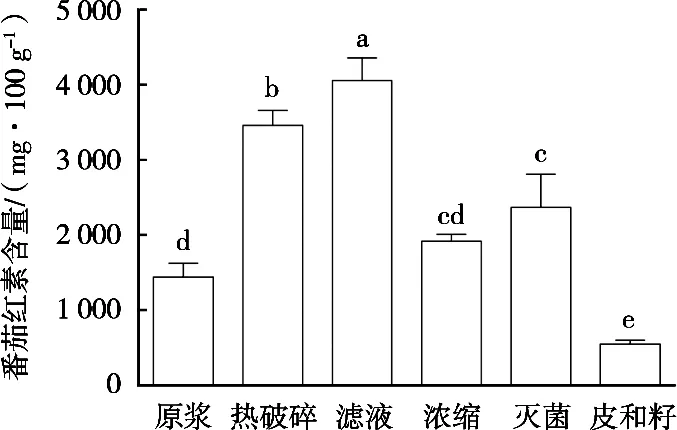
图4 番茄酱加工过程中番茄红素含量变化
2.4 标志性风味物质的筛选
应用SPME-GC/MS技术,采集并分析加工过程不同阶段的番茄制品(包括番茄原浆、热破碎浆、滤液、浓缩液)中的风味物质,得到的GC-MS总离子流图,如图5所示。筛选出7种变化显著的风味物质(表1),除戊醛外,其他几种物质的含量在后续的加工中均有下降趋势,而戊醛含量却有急剧上升,可见番茄制品的加工过程会产生大量戊醛,并因此很大程度影响番茄的风味。后续对戊醛模型进行建立。

表1 番茄加工过程中标志性风味物质
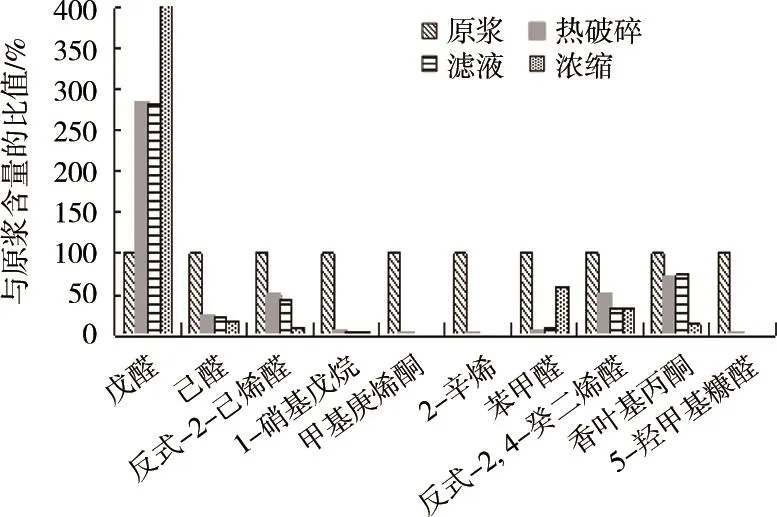
图5 标志性风味物质的变化规律分析
2.5 戊醛模型的建立
如图6所示,添加不同浓度戊醛使得番茄样本的红外吸收有明显增加,且红外峰的吸收强度会随着戊醛浓度的上升有增加趋势,但具体的戊醛添加浓度仅凭直观的原始光谱图判断明显存在困难。因此后续结合多元统计分析尝试自动识别戊醛浓度。
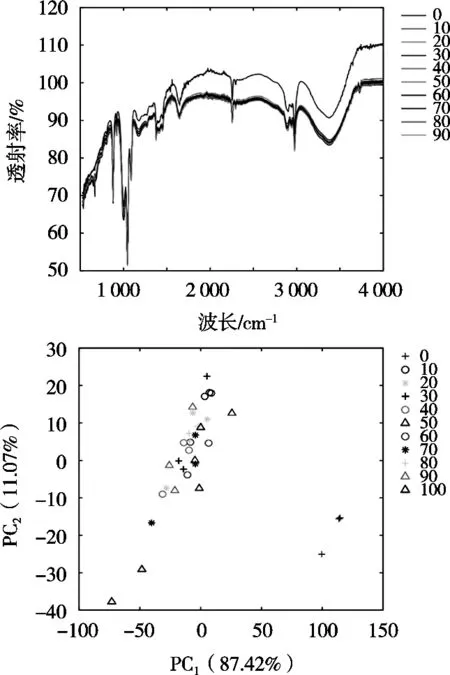
图6 戊醛的红外原始平均图谱(左)和PCA得分图(右)
戊醛原始数据经过归一化处理后进行PCA分析,结果以第一主成分(PC1)和第二主成分(PC2)得分图的形式展现。如图5所示,添加戊醛的番茄样本与空白样本之间得到显著区分,而不同浓度的戊醛添加样本的区分度仍然较差,这与原始平均图谱观察到的现象一致。由于PCA是一种无监督的多元分析方法,其最终结果判定需要人为干涉[9],且PCA得分图中不同浓度的样本之间存在较大重叠,说明二维得分图还不足以有效区分添加戊醛样本的组间差异。因此,采用一种更强大的模式识别方法进一步建立更好的戊醛预测模型。
PLS是一种有监督的多元分析方法,算法中综合降维及预测变量和响应变量之间的相关性[10]。在构建模型前,将原始数据集划分为包含80%样本的训练集和20%样本的测试集,并通过BLP程序确定最佳LVs个数为6,模型预测结果如图7所示。通常,优秀的拟合模型需要较低的RMSE和较高的R2(>0.9)[11]。可以看到所构建的PLSR模型对于训练集和测试集均取得优异的预测效果,R2均大于0.9,且残差值较低。
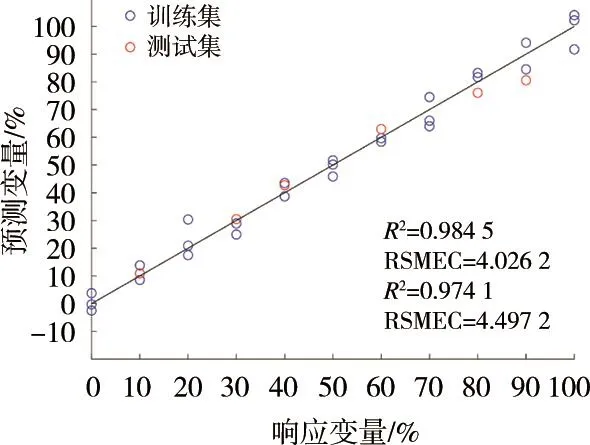
图7 PLSR预测效果
3 结论
番茄酱加工过程中的营养品质变化的关键控制点在于热破碎和浓缩环节。热破碎的过程的控制要点在于如何提升营养物质从细胞基质中释放的效率。而浓缩环节的控制重点在于提升浓缩效率,尽量降低反应温度,缩短蒸发时间。其原因在于多酚、黄酮还有类胡萝卜素的氧化主要集中在这一步骤。
番茄籽中含有丰富的酚类和黄酮类物质,因此对番茄酱的加工过程中的副产物皮籽的开发利用还有很大空间。
建模结果表明红外光谱结合化学计量学用于番茄制品中不同浓度戊醛劣变因子快速检测的可能性。然而,红外光谱结合化学计量学预测番茄样本中己醛劣变因子的效果较差,这可能与建模所采用的样本量不够充分,后续可通过扩大样本量和尝试更多种的预处理方法来建立更优异的模型。此外,品质劣变往往是由于多个劣变因子联合产生的效果,且戊醛与己醛的特征波峰类似。所以,后续研究可采用多种目标物联合进行番茄酱的品质表征。

