龙脑樟萜类的转录和代谢差异分析
黄晓玲, 严寒静, 刘春琰, 李思琪, 田鑫慧, 邵长柳, 庞玉新,4
(1.广东药科大学中药资源学院, 广东 云浮 527300; 2.广东药科大学中药学院, 广州 510006;3.河南农业大学农学院, 郑州 450046; 4.贵州中医药大学药学院, 贵阳 550025)
樟(Cinnamomumcamphora(L.) presl)为樟科樟属植物,其加工产品可供医药、香料工业和建筑工业使用,分布于我国南方及西南各省区。樟在种植过程中发生杂化,分化成不同化学型,龙脑樟(Cinnamomumcamphorachvar. Borneol)为其中一种。单萜为龙脑樟精油的主要成分之一,而右旋龙脑(天然冰片)是单萜化合物中含量最高的成分,具有清热止痛、开窍醒脑、保护神经和抗菌抗病毒作用[1]。随着右旋龙脑应用范围的不断扩大和分子生物技术的快速发展,人们已获悉右旋龙脑的生物合成途径。植物需要先通过胞浆的甲羟戊酸途径(Mevalonic acid,MVA)或质体的甲基赤藓糖醇-4-磷酸途径(2-methyl-D-erythritol-4-phosphate,MEP)生成所有萜类的通用底物异戊二烯焦磷酸(Isopentenyl pyrophosphate, IPP)和异构体二甲基丙烯焦磷酸(Dimethylallyl diphosphate,DMAPP);在依赖金属离子的单萜合酶(Monoterpene synthases,mono-TPS)催化下,由1分子IPP和1分子DMAPP生成的单萜类底物香叶基焦磷酸(Geranyl diphosphate,GPP)转移二磷酸基团生成中间体二磷酸芳樟酯(Linalyl diphosphate,(3 R)/(3 S)-LPP);LPP经反式异构和焦磷酸基团离去两个步骤形成松油基阳离子(Terpinyl cation),通过冰片基二磷酸合成酶(Bornyl diphosphate synthases)环化和碱性磷酸酶(Alkaline phosphatase)水解,最终生成龙脑[2-4]。
形态特征无显著差别的植物由于所含代谢物组成或含量的差异,可被区分为不同的化学型[5]。化学型广泛存在于药用植物中,如广藿香、香薷、薄荷及樟等。樟可划分成龙脑型、樟脑型、桉油素型、异橙花叔醇型、柠檬醛、芳樟醇型、Sesquiterpene及Sesquiterpene alcohol等多种化学型[6]。化学型的不同会影响药效的发挥和加工应用方向。道地药材是指特定地区生产的有效成分含量较高或配比最优的中药材。因此,研究药用植物的化学型是有意义的。高含量右旋龙脑是龙脑樟与其他化学型樟的最大区别,植物精油成分和产量的定性、定量变化是由内在因素或外部因素决定的,可从内在因素对化学型进行解析[7]。转录组学联合代谢组学,不仅可以挖掘差异关键基因,也能获悉代谢产物,从而确定关键候选基因在代谢通路水平上差异基因的核心调控网络,为探究龙脑樟化学型形成机制提供了支持。本研究通过转录组和代谢组对樟脑型樟与龙脑型樟进行比较,为后续龙脑型樟资源开发、品种选育及相关研究提供参考。
1 仪器与试剂
仪器:NanoDrop ND-1000(NanoDrop,Wilmington,DE,USA)、Bioanalyzer 2100(Agilent,CA,USA)、气相色谱仪(8890-7000 D,Agilent,CA,USA)、色谱柱为DB-5 MS毛细管柱(30 m×0.25 mm×0.25 μm,Agilent,CA,USA)、萃取头(120 μm DVB/CWR/PDMS,Agilent,CA,USA)、固相微萃取装置(SPME Arrow,CTC Analytics AG,CH)、老化装置(Fiber Conditioning Station,CTC Analytics AG,CH)、样品加热箱(Agitator,CTC Analytics AG,CH)、电子天平(MS 105 DU,METTLER TOLEDO,CHN)、球磨仪(MM 400,Retsch,CHN)。
试剂:TRIzol 试剂盒(Invitrogen,CA,USA)、氯化钠(分析纯,国药集团化学试剂有限公司)、正己烷(色谱纯,Merck,GER)、标准品(色谱纯,BioBioPha/Sigma-Aldrich,GER)、3-己酮(色谱纯,国药集团化学试剂有限公司)。
2 材料与方法
2.1 试验材料
龙脑樟由广东万森生态科技发展有限公司提供,脑樟(Cinnamomumcamphorachvar. Camphor)来自广东药科大学药圃。本实验随机选取龙脑樟和脑樟无虫害、完整的成熟叶擦拭干净,放入液氮速冻1 h后存放于-80 ℃冰箱保存,用于GC-MS和转录组测序分析。将脑樟组设定为Ctr组,龙脑樟组设为t组,具体信息见表1。
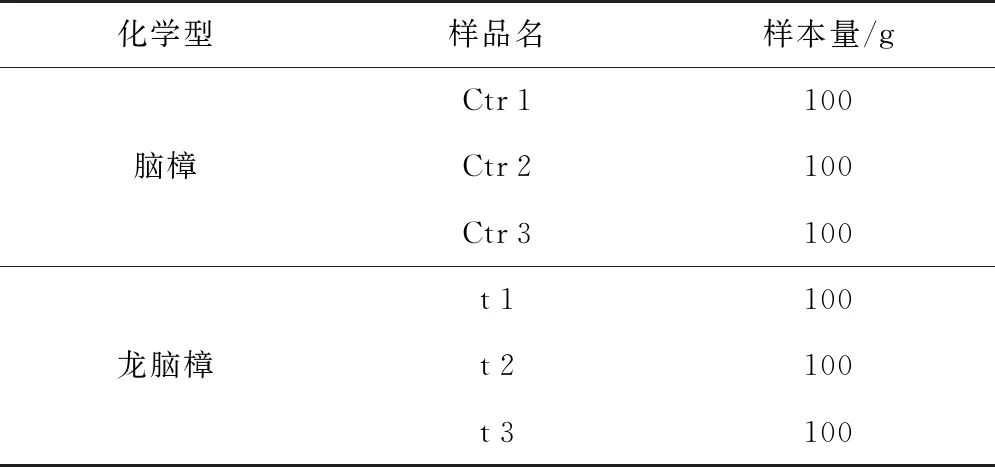
表1 样品分类信息Table 1 Sample classification information
2.2 试验方法
2.2.1代谢组学分析
样品制备:将叶片研磨混合均匀,每个样本称取约0.5 g于顶空瓶中,分别加入含有饱和NaCl溶液和10 μL(50 μg/mL)3-己酮的内标溶液,于全自动顶空固相微萃取装置进行样本萃取。
色谱条件:高纯氦气作为载气,以1.2 mL/min恒流,进样口温度250 ℃,溶剂延迟3.5 min。程序升温:在40 ℃保持3.5 min,以10 ℃/min 升至100 ℃,再以7 ℃/min升至180 ℃,最后以25 ℃/min 升至280 ℃,保持5 min。质谱条件:离子源温度为230 ℃,四级杆温度为150 ℃,质谱接口温度280 ℃,电子能量70 eV,扫描方式为选择离子检测模式(SIM),定性定量离子精准扫描。
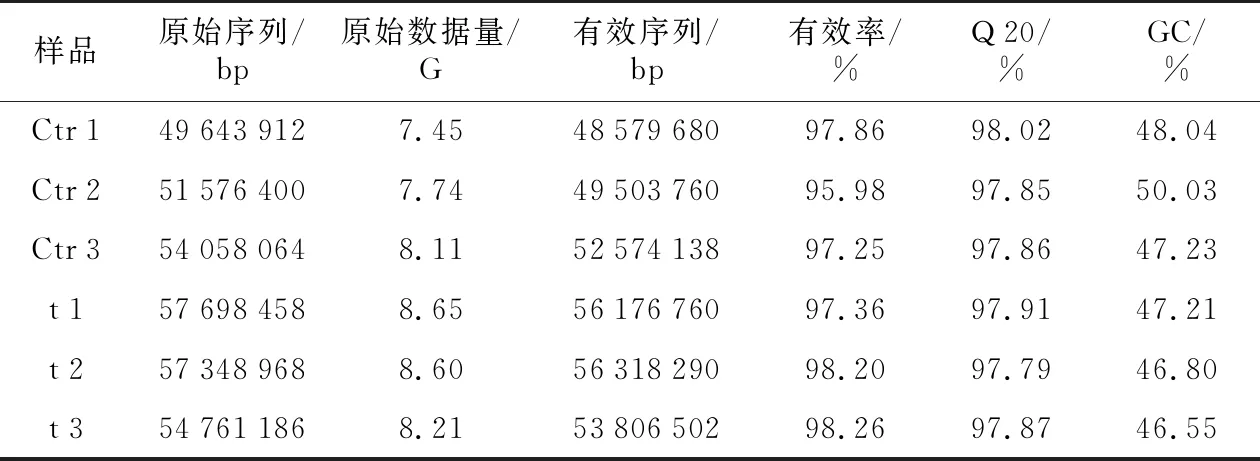
表2 龙脑型樟和樟脑型樟测序结果统计Table 2 Sequencing statistics of borneol-type and camphor-type camphor

表3 龙脑型樟和樟脑型樟拼接结果统计Table 3 Statistics of the splicing results of borneol-type and camphor-type camphor
数据分析:通过Mass Hunter软件处理下机原始数据,用于定性定量分析。检索MWGC数据库,对代谢物结构进行鉴定。对提取得到的数据进行多元统计分析。选择满足|Fold Change|(FC)>2或<0.5,VIP>1条件的两组间显著差异代谢物。
2.2.2样品总RNA的提取、质量检测及建库测序
使用TRIzol 试剂盒提取样品总RNA,利用NanoDrop ND-1000 对总RNA质量和纯度进行质控,再经Bioanalyzer 2100对RNA的完整性进行检测,同时通过琼脂糖电泳进行验证合格后构建cDNA文库,使用Illumina Novaseq 6000进行转录组测序。文库的构建和Illumina上机测序由杭州联川生物医药科技有限公司完成。
2.2.3原始数据质量控制及组装
将测序后得到的原始数据(Raw data),使用Trinity 2.4.0软件进行预处理得到有效序列(Valid reads)。原始数据预处理步骤如下:
1) 去接头(Adaptor);
2) 切除序列中含有N部分(N:未知碱基);
3) 滤除低质量碱基(Q<20部分);
4) 统计原始测序量(Raw Bases)、有效测序量(Clean Bases)、Q 20(质量值≥20的碱基所占比例,测序错误率小于0.01)、GC含量(Clean Bases中G和C的数量总和占总碱基的百分比)。将获得的Clean reads进行De novo拼接,得到最终的Unigene。
2.2.4信息生物学分析
将完整的Unigenes与eggNOG、GO、KEGG、NR、Pfam及Swissprot数据库进行比对注释,注释比对阈值evalue<1×10-5。采用Salmon对Unigenes计算TPM (Transcript Per Million)进行定量,采用R包edgeR对Unigenes进行差异分析。其中,以p<0.05且|FC|>2为条件筛选差异基因。
3 结果与分析
3.1 转录组学研究
3.1.1测序数据统计与拼接结果
两组樟经转录组测序后共获得48.76 G原始数据量,325 086 988 bp原始序列,过滤掉低质量的序列后得到316 959 130 bp有效序列。从表2可知,有效序列所占比例在95.98%~98.26%之间,Q 20所占比例均大于97%,GC碱基含量占总数量的46%~50%,平均含量为47.64%。以上数据说明样品的测序数据质量合格,满足后续的生物信息学分析要求。
对获得的有效序列通过Trinity方法进行组装,共有32 550个Unigenes,N 50长度为1 781 bp。此外,Transcript共68 125条,GC碱基占比43.45%,N 50(1 730 bp)是平均长度的1.58倍,说明转录本完整度较高。具体结果见表3。
3.1.2Unigenes功能注释及分类
将Unigenes比对到不同数据库,注释量占比从小到大依次为:43.16%(KEGG库)、45.93%(Swissprot库)、50.57%(Pfam库)、55.67%(GO库)、60.40%(eggNOG库)、66.39%(NR库),其中,11 696个(36.27%)Unigenes可被所有数据库注释到。各数据库注释结果见表4。
基于KEGG数据库,共有4 172条Unigenes注释到代谢通路中(图1),主要参与碳水化合物、氨基酸、脂质和能量代谢,这4条代谢共占注释的60.20%。遗传信息方面,同时参与翻译(989条),蛋白质折叠、分类和降解(783条),转录进程(398条)。除此之外,信号转换、环境适应及运输和分解代谢均各占注释的11%以上。
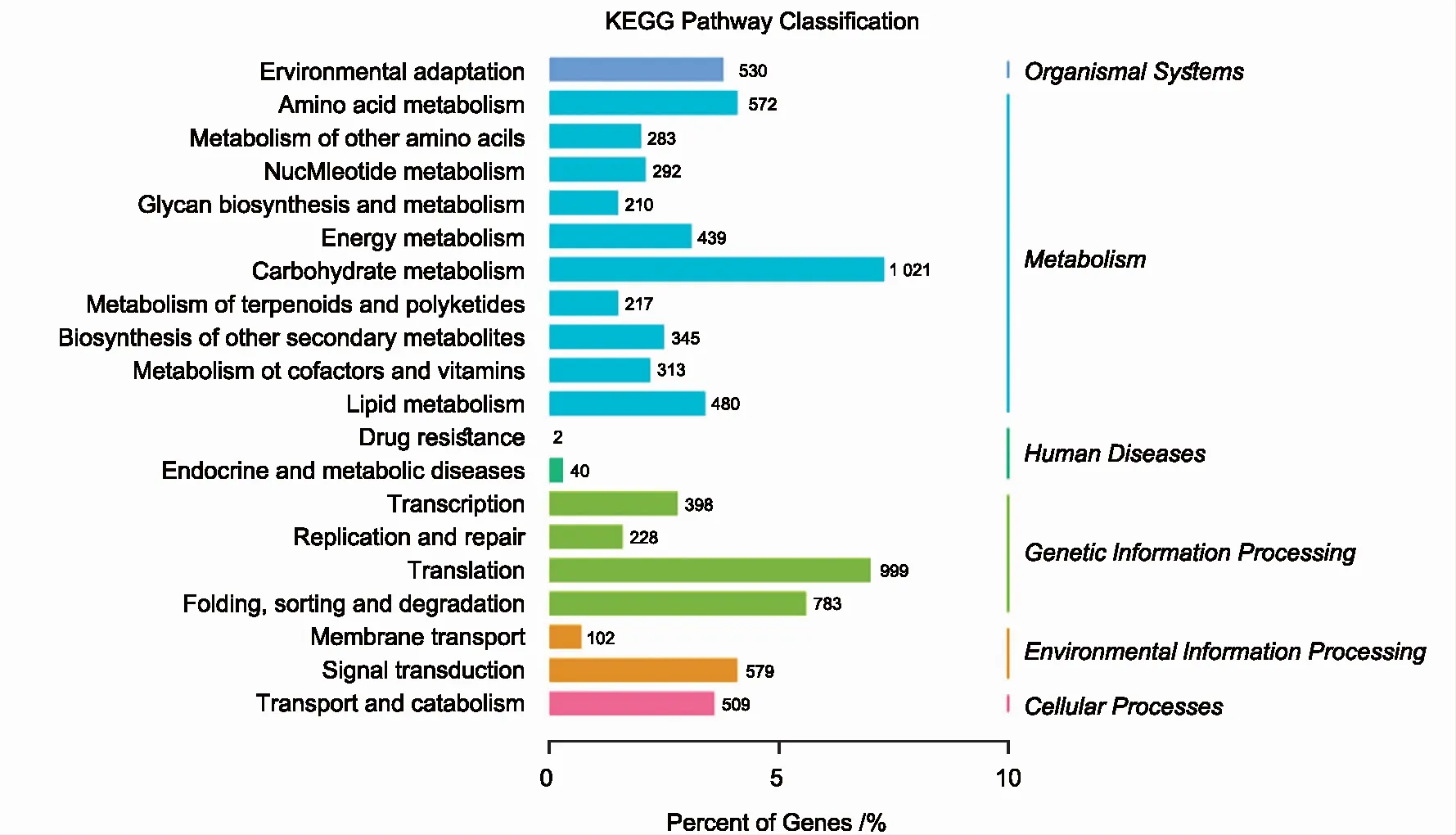
图1 KEGG富集分析Fig.1 KEGG enrichment analysis
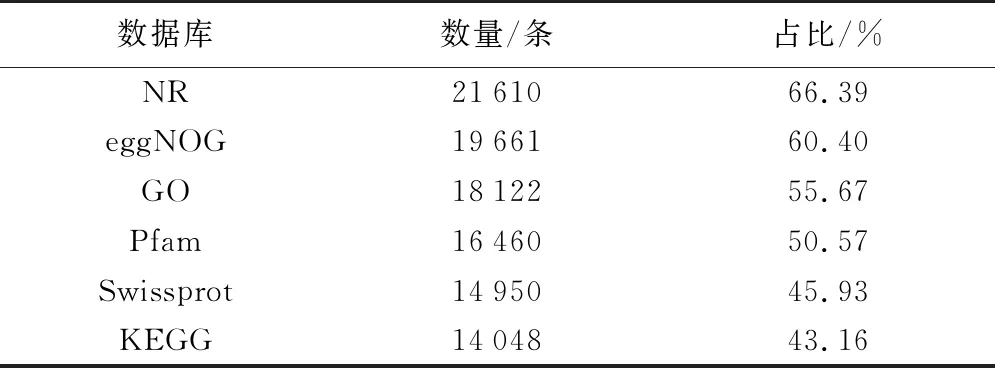
表4 Unigenes注释的统计结果Table 4 Statistical results of Unigenes annotations
3.1.3差异表达基因分析
基于转录组数据筛选两种樟的差异基因,标准为p<0.05且|FC|>2,共筛选出2 345个表达差异显著基因,龙脑樟相对于脑樟上调表达的基因有882个,下调的有1 553个。其中有156个基因是龙脑樟特有的,有105个基因是脑樟特有的,说明两种樟表达存在较大差异。基因的具体分布见图2。
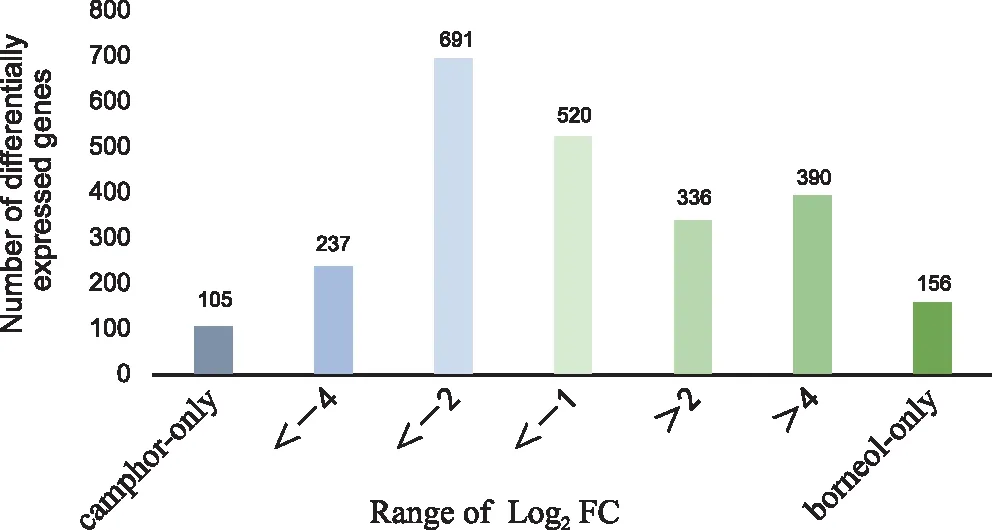
图2 差异表达基因分布统计Fig.2 Statistics of differential gene distribution
3.1.4差异表达基因GO富集分析
将差异基因比对到GO库进行富集分析,共有1 850种基因分布到1 973条目中,其中有634个差异基因属于龙脑樟相对脑樟显著上调部分。图3展示上调差异表达基因数量位居前20的亚类GO分析结果:生物过程(Biological process)显示龙脑樟差异表达基因与生物过程(Biological process)、转录(Transcription,DNA-templated)及转录调控(Regulation of transcription,DNA-templated)密切相关。涉及分子功能(Molecular function) 亚类的差异表达基因主要富集在分子学功能(Molecular function,64个)、ATP结合(ATP binding,78个)和蛋白质结合(Protein binding,92个)。细胞组分(Cellular component)下有208个基因体现在核(Nucleus),126个基因集中在细胞质(Cytoplasm),质膜(Plasma membrane)占有97个差异基因。
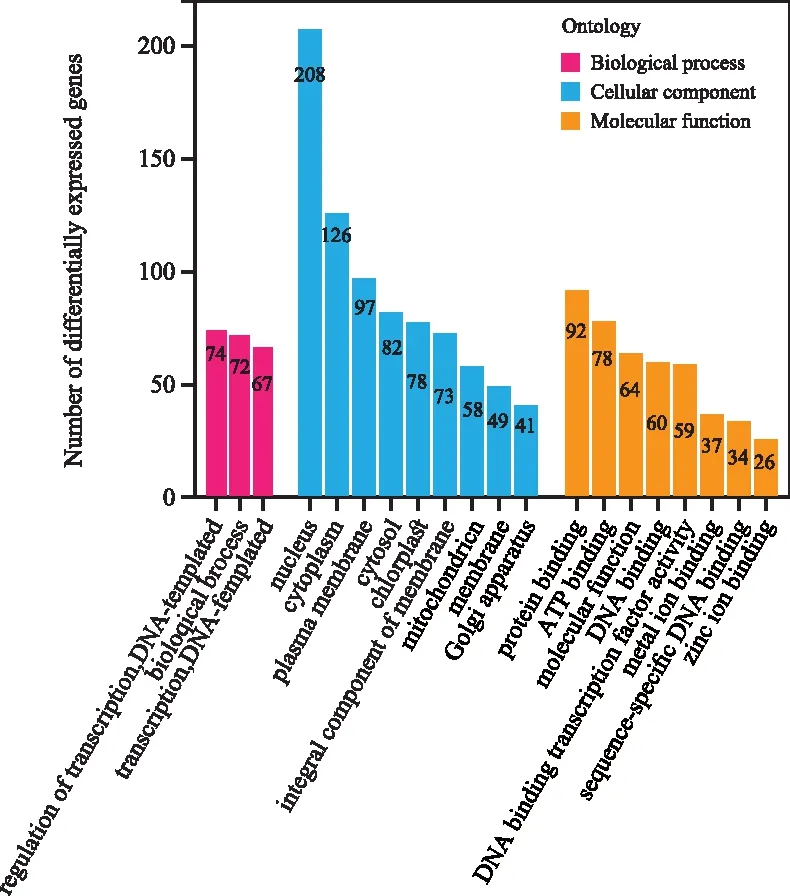
图3 上调表达基因的GO功能富集分析Fig.3 GO functional enrichment analysis of up-regulated differentially expressed genes
3.1.5差异表达基因KEGG富集分析
为获得两组樟之间的代谢差异,对筛选得到的差异表达基因进行KEGG通路富集分析(图4)。与脑樟相比,龙脑樟差异表达基因对类黄酮生物合成通路影响最大,注释到19个差异表达基因;而脑樟的差异表达基因显著富集的途径是果糖和甘露糖代谢,共注释到15个差异表达基因。从代谢通路基因富集个数来看,龙脑樟最重要的通路是糖酵解/糖异生(Glycolysis/Gluconeogenesis),而脑樟是核糖体(Ribosome)。综上可知,龙脑樟的差异表达基因主要与生物代谢物合成更为密切。
3.2 非靶向代谢组学研究
3.2.1代谢物差异筛选结果
采用GC-MS检测两种樟的化学成分,基于数据库,对样本的代谢物进行定性定量分析,共鉴定出867种代谢物。筛选|FC|>2或<0.5和VIP>1的代谢物,共得到468种显著差异代谢物,其中显著上调和下调的差异代谢物分别为249种和219种。由图5可知,龙脑樟与脑樟的整体代谢物存在较大差异,是进行深入分析的基础。
3.2.2OPLS-DA结果
正交偏最小二乘法判别分析(OPLS-DA)是一种更为科学的多变量统计分析方法。图6为OPLS-DA 验证模型,橙色代表随机分组模型R2Y,紫色代表随机分组模型Q2,黑色箭头代表的值为原始模型的R2X,R2Y和Q2值。由图6可知,R2Y=0.999、R2X=0.904、Q2=0.996,说明该模型稳定可靠,具有良好的预测能力。
3.2.3差异代谢物分析
由图7可知,红色代表代谢物含量上调,绿色代表代谢物含量下调。结果表明,龙脑樟的差异代谢物主要与萜类、烃类相关,而脑樟与杂环化合物、酯类代谢物有关。由表5可知,在龙脑樟中,龙脑是其主要化学成分且与脑樟差异较大,而脑樟中主要成分是樟脑。以上说明两种化学型樟主要成分差异明显。
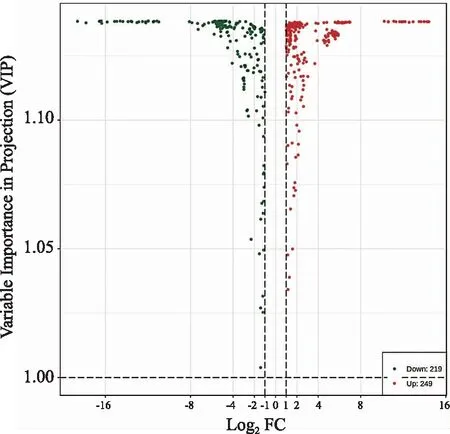
图5 差异代谢物成分分析Fig.5 Differential metabolite components analysis
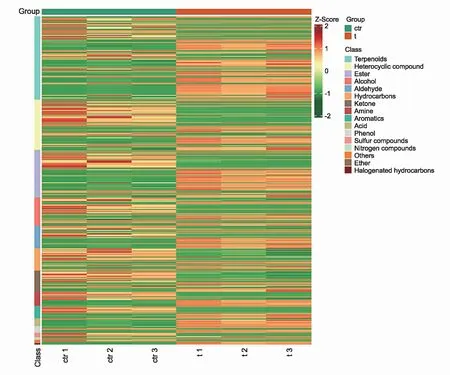
图7 差异代谢物热图Fig.7 Differential metabolite heatmap
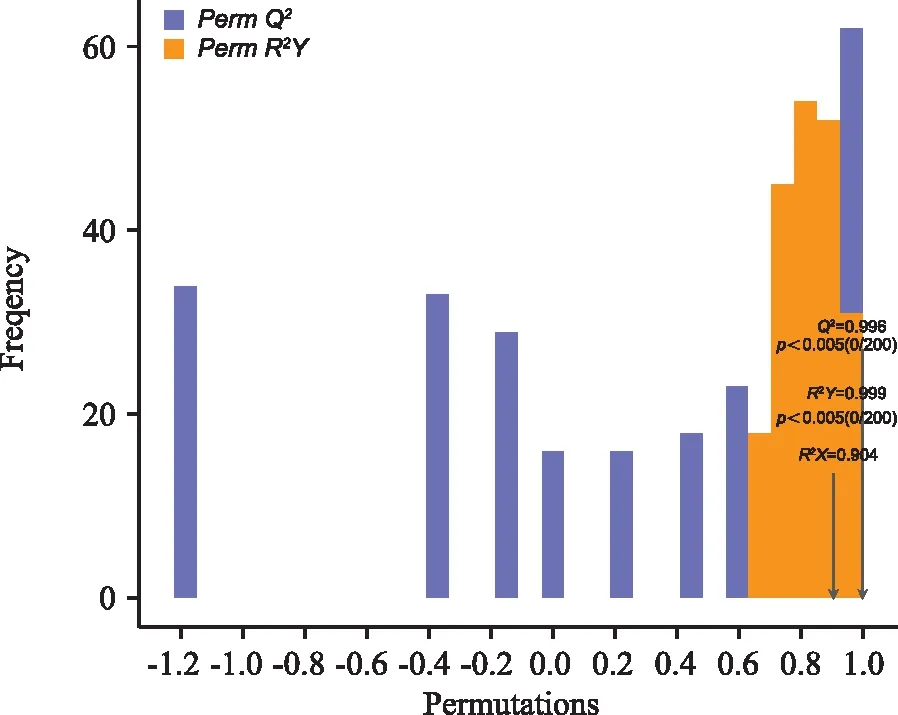
图6 OPLS-DA验证模型Fig.6 Model verification of OPLS-DA
3.2.4差异代谢物通路分析
通过 KEGG 数据库对樟的代谢物进行通路注释分析(图8),共有38个差异代谢可被注释到。结果显示,樟的分解代谢包括:柠檬烯和蒎烯降解(Limonene and pinene degradation)、硫代谢(Sulfur metabolism)、苯丙氨酸代谢(Phenylalanine metabolism)、酪氨酸代谢(Tyrosine metabolism)、甘油磷脂代谢(Glycerophospholipid metabolism)和代谢途径(Metabolic pathways)等 9 个次级分类,其中有 17 种代谢物参与代谢途径,有6种代谢物参与苯丙氨酸代谢途径,有6种代谢物参与柠檬烯和蒎烯降解通路。合成代谢包括:单萜生物合成(Monoterpenoid biosynthesis)、次生代谢物的生物合成(Biosynthesis of secondary metabolites)、倍半萜和三萜生物合成(Sesquiterpenoid and triterpenoid biosynthesis)、萜类骨架生物合成(Terpenoid backbone biosynthesis)和各种生物碱的生物合成(Biosynthesis of various alkaloids)等 11 种2级分类。其中有 13 个代谢物参与次生代谢物的生物合成;有 6 个代谢物参与单萜生物合成。
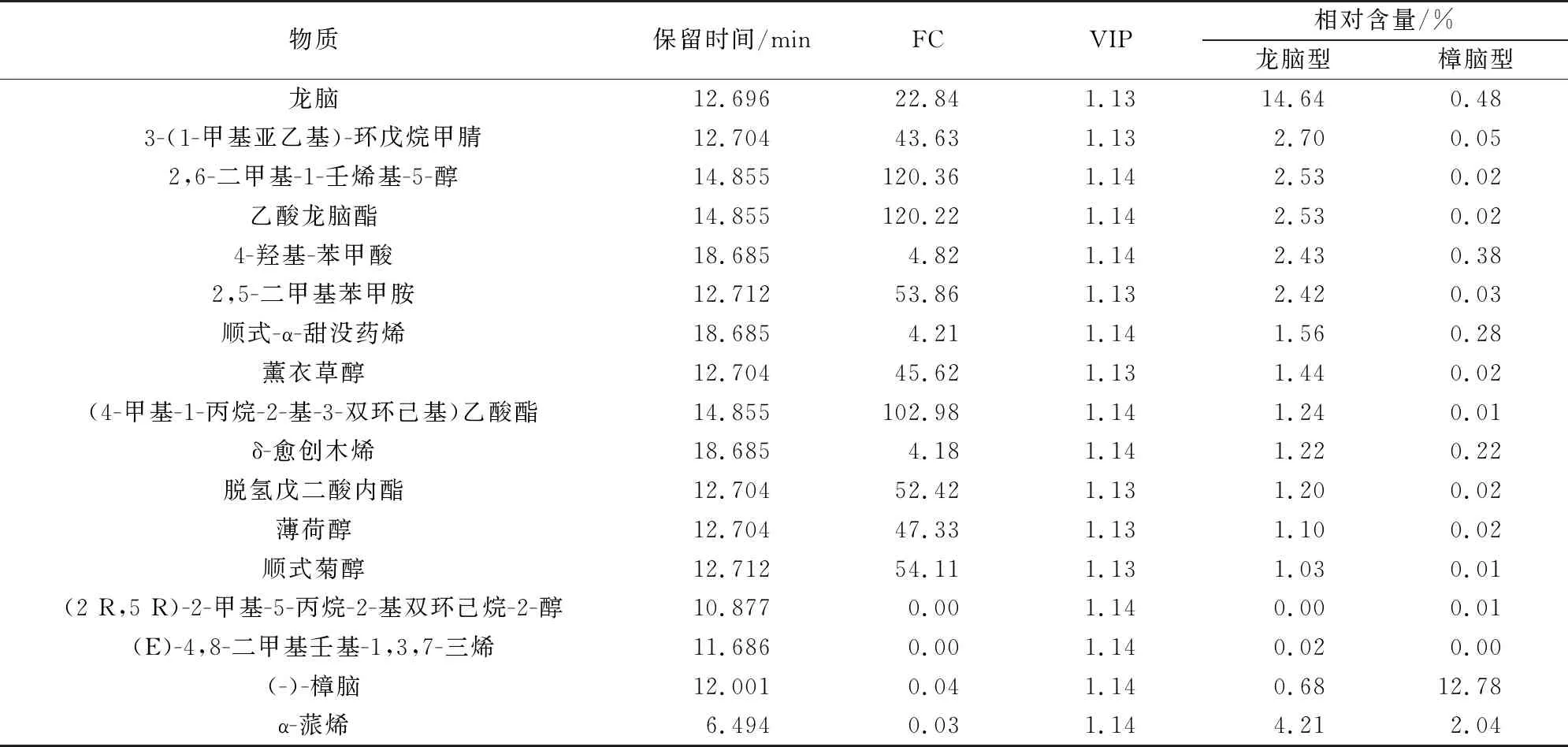
表5 主要化学成分Table 5 Main differential metabolites
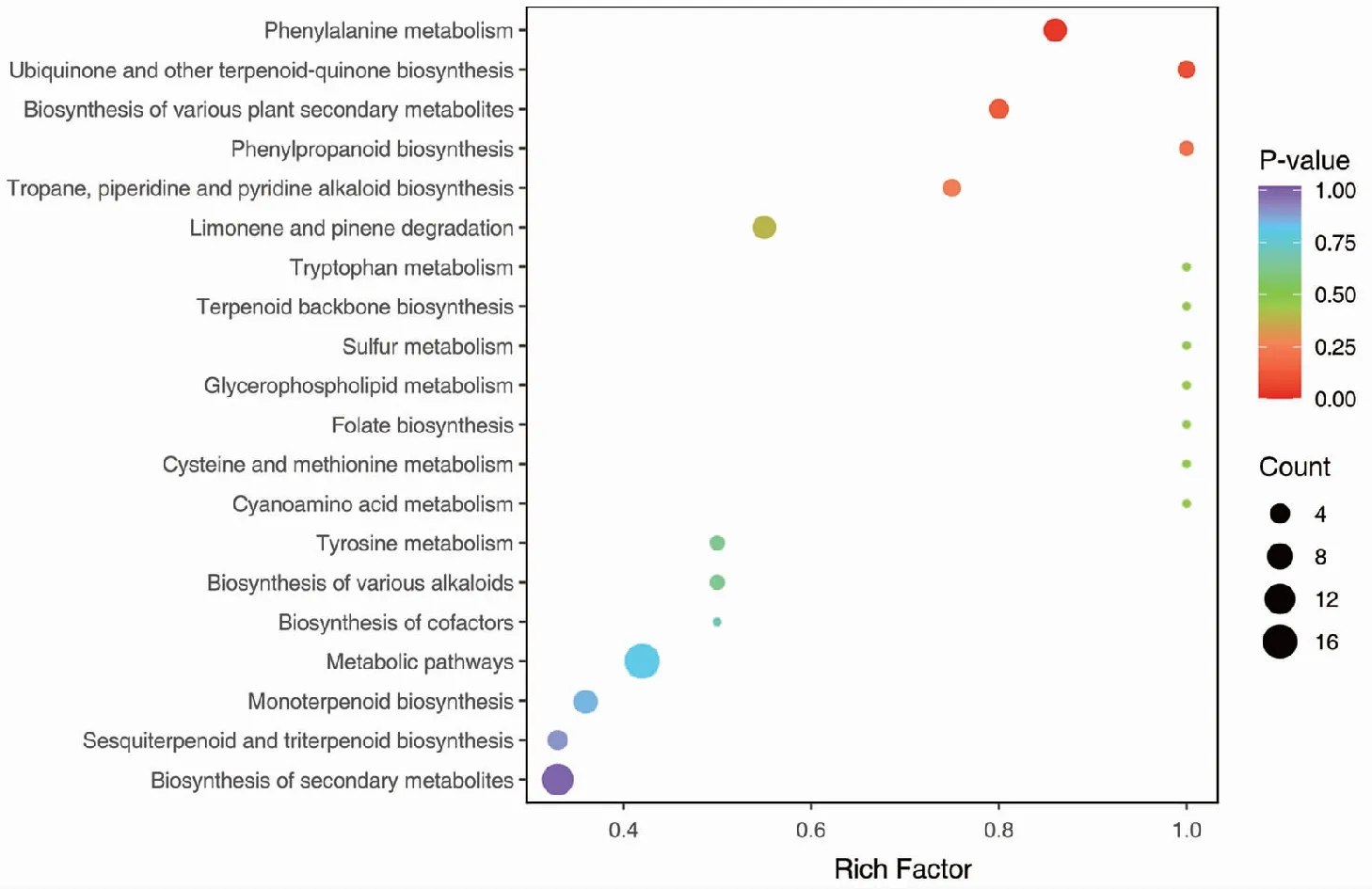
图8 差异代谢物KEGG分类图Fig.8 KEGG classification of differential metabolites
研究表明,萜类成分是影响化学型形成的主要原因。本实验的目的之一是探索2种不同化学型樟形成的相关代谢物,样本间共有 9 种差异代谢物在萜类物质合成通路中富集,有5个为显著上调化合物,萜类物质合成在龙脑樟组呈上调趋势。同时,通过分析代谢途径的上、下调差异代谢物,发现龙脑樟组内显著上调的物质为萜类和酸类化合物,说明萜类物质对龙脑樟的形成有重要作用。
4 萜类物质合成相关基因的挖掘和分析
结合转录组学和代谢组学分析代谢基因、差异代谢化合物与代谢通路,挖掘与萜类差异代谢物相关的基因,根据生物合成表达模式,共筛选出6种差异代谢物。基于转录组学数据发现,有42个基因可调节单萜合成。其中参与萜类骨架生物合成(Terpenoid backbone biosynthesis,Ko 00900)的基因有35个,有57.14%在龙脑樟中上调。萜类骨架通路中大部分酶的基因表现出高转录表达水平(TPM>6),除了4种1-脱氧-D-木酮糖-5-磷酸合酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)和5种羟甲基戊二酰辅酶A还原酶(Hydroxymethylglutaryl-CoA reductase,HMGR)Unigenes外。植物通过MEP和MVA途径生产萜类通用底物,龙脑樟中MEP途径中的Unigenes的表达量高于MVA途径。除此之外,有18个二萜合酶Unigenes和4个参与倍半萜和三萜合酶的Unigenes在龙脑樟上调。总体而言,萜类骨架途径中酶的高表达水平的结果与萜类化合物的高合成率一致,并可知两种化学型中萜烯合成酶(Terpene synthase,TPS)基因的不同表达可能是其萜类成分不同的原因。单萜生物合成中,(-)-薄荷酮((-)-Menthone)、紫苏醇(Perillyl alcohol)和右旋龙脑((+)-Borneol)代谢物在龙脑樟中显著增加,益普二烯酮(Ipsdienone)、香芹酮((-)-Carvone)和右旋樟脑((+)-Camphor)代谢物显著下降。
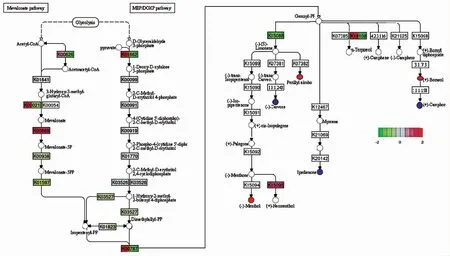
图9 萜类生物合成的代谢组和转录组分析Fig.9 Metabolomic and transcript analysis in the terpene biosynthetic
5 结论与讨论
本研究结合转录组和代谢组,研究龙脑樟萜类物质积累和关键酶基因的变化规律。龙脑樟与糖酵解/糖异生KEGG代谢通路密切相关,而脑樟的形成与果糖和甘露糖代谢相关,说明基础物质参与樟化学型的形成。GC-MS共鉴定出214种萜类化合物,主要成分为单萜。单萜是樟叶片提取物中常见的化合物,在不同化学型中含量有差异。根据代谢成分可知,龙脑樟中右旋龙脑的含量(14.64%)高于脑樟(0.48%),而脑樟中的樟脑含量较高(12.78%)。由此可知,不同的主要单萜类化合物可能主导了两种化学型之间的差异。多年来,与萜类生物合成有关的基因在樟科植物中被广泛研究。目前,已报道的龙脑樟萜类物质合成关键酶相关基因包括PMK[8]、萜烯合成酶1 (Terpene synthase 1,TPS 1)[9]、萜烯合成酶14(Terpene synthase 14,TPS 14)[10]、冰片脱氢酶(Borneol dehydrogenase,BDH 3)[11]等。PMK是MVA途径中的限速酶,在樟的多个化学型中,发现龙脑樟中其表达量最高,CcTPS 14是龙脑樟积累右旋龙脑的主要酶[10]。
从两组樟的转录组中共分离出106个可能参与萜类生物合成的表达单基因,有62个基因被注释到萜类骨架生物合成这一通路中,其中差异表达基因8个,DXS、香叶基香叶基二磷酸还原酶(Geranylgeranyl diphosphate reductase,chlP)、牻牛儿基牻牛儿基焦磷酸合酶(Geranylgeranyl diphosphate synthase,GGPS)、异戊二烯半胱氨酸α-羧基甲基酯酶(Prenylcysteine alpha-carboxyl methylesterase,PCME)和蛋白法尼醇激酶(Farnesol kinase,FOLK)表达量上升。DXS作为MEP途径的第一个限速酶,可催化丙酮酸和甘油醛-3-磷酸缩合生成1-脱氧D-木酮糖5-磷酸,并经一系列酶催化,最终生成通用底物DMAPP和异构体IPP。研究表明,DXS是多种药用植物萜类合成的关键基因,如北苍术[12]、银杏[13]、半枝莲及夏枯草[14]等。在香樟中,单萜物质的合成与DXS基因呈正相关[15]。在本研究中,DXS在龙脑樟显著上调表达,说明龙脑樟更倾向于通过MEP途径合成萜类前体。GGPS是萜类骨架合成途径的结构酶,可催化底物IPP生成前体GPP[16]、牻牛儿基牻牛儿基焦磷酸(Geranylgeranyl pyrophosphate,GGPP)[17]和法尼基焦磷酸(Farnesyl pyrophosphate,FPP)。在牡丹[18]、柳杉[19]、地黄[20]等植物均发现该基因,与植物香味、单萜、倍半萜和三萜生物合成相关。GPP是单萜的直接前体,而右旋龙脑属于环状单萜,该基因在龙脑樟组明显上升表达,与右旋龙脑在龙脑樟中积累相协调,进而说明其在龙脑生物合成中发挥着重要作用。龙脑樟组FOLK显著下调,这与曹瑞兰等[21]发现芳樟(Cinnamomumcamphoravar. linaloolifera Fujita.)内FOLK表达远低于杂樟的结果一致。根据差异基因在萜类骨架生物合成的分布情况,与樟脑型樟相比,龙脑樟可产生多类型的萜类物质。
单萜合酶(Monoterpene synthases, mono-TPS)是单萜生物合成的关键酶,决定了单萜结构的多样性。在单萜生物合成中,(-)-α-松油醇合酶((-)-alpha-terpineol synthase)在龙脑樟组内表达量显著上升,该酶可与被chlP催化生成的前体GPP反应生成α-萜品醇。研究表明,单萜合酶CcTPS 1催化GPP得到酶促反应产物(+)-冰片基二磷酸,产物进一步脱磷酸化,可得到右旋龙脑[9]。
除以上上调差异基因外,4-二磷酸胞苷-2-C-甲基-D-赤藓糖醇激酶(4-diphosphocytidyl-2-C-methyl-D-erythritol kinase4,ispE)、(E)-4-羟基-3-甲基丁-2-烯基二磷酸合酶((E)-4-hydroxy-3-methylbut-2-enyl-diphosphate synthase, gcpE)、羟甲基戊二酰辅酶A合酶(Hydroxymethylglutaryl-CoA synthase, HMGCS)、异戊二烯半胱氨酸氧化酶(Prenylcysteine oxidase,PCYOX1)、蛋白质-S-异戊二烯半胱氨酸 O-甲基转移酶(Protein-S-isoprenylcysteine O-methyltransferase,ICMT)、STE 24 内肽酶(STE 24)和异戊二烯蛋白肽酶(prenyl protein peptidase,RCE1)亦在龙脑樟组内轻微上调。这些调控酶主要分布在玉米素生物合成和单萜化合物生成,而右旋龙脑属于含氧单萜类成分,说明在龙脑樟内可通过上调相关途径提高右旋龙脑的含量。

