不同处理对“温185”核桃种子萌发及幼苗生长的影响
丁文文, 郭 松, 张 锐, 包建平, 郭 龙
(1.塔里木大学园艺与林学学院, 新疆 阿拉尔 843300;2.新疆兵团塔里木盆地生物资源保护利用重点实验室, 新疆 阿拉尔 843300;3.南疆特色果树高效优质栽培与深加工技术国家地方联合工程实验室, 新疆 阿拉尔 843300;4.新疆兵团第一师阿拉尔市三团农业发展服务中心, 新疆 阿克苏 843000)
核桃(JuglansregiaL.)系胡桃科(Juglandaceae)核桃属(Juglans)具有较高适应性的落叶果树,位列世界著名的四大干果(核桃、扁桃、腰果、榛子)之首[1-2]。据国家统计局统计,到2020年我国核桃产量已达480万t,共20个省(区、市)的一千余个县栽培核桃,云南、新疆、四川、陕西和山西等省区核桃产量较高,合计占全国核桃产量的77%[3]。新疆核桃栽培历史悠久,在首批国家级核桃良种选育过程中,绝大部分选自新疆核桃或父母本为新疆核桃[4]。随着南疆核桃产区的不断扩大,逐步形成了以阿克苏、和田和喀什南疆三地州核桃种植区,三地核桃种植面积为33.17万hm2,年产值100.7亿元,面积、产值均居全疆果树种植第二位[5-7]。目前新疆成为我国核桃种植大省区,已建成以“温185”和“新新2号”品种为主的全国最大薄皮核桃产区,成为发展特色林果业带动经济增长的新动力[8-9]。
目前,我国的核桃产业正进入快速发展期,培育良好的苗木技术已成为核桃产业发展的重要因素之一[10]。贾彩霞[11]研究发现,核桃干藏种子的果壳和种仁均含有一定量的内源抑制物质,不利于种子的萌发,因此,在播种前需要经过一定的预处理打破休眠。植物激素作为植物体内的信号分子,在种子休眠和萌发的调控机理[12]、调节幼苗生长[13]等方面具有重要作用,在打破文冠果、青蒿、杉木、翅碱等种子休眠方面广泛应用,起到调节和稳定植物生理周期的作用,对提高经济效益具有重要的意义[14]。尤其是GA3、NAA和IAA等植物生长促进型激素在植物萌芽期对种子的萌发和种胚的发育具有显著促进作用[15-16]。目前,有学者以GA3、IBA、NAA、6-BA等植物激素处理核桃种子,结果表明,经激素处理有利于打破种子休眠、提高萌发率和促进种子幼苗生长等[17-19],但将浸种前种子进行去壳预处理以促进发芽、缩短发芽周期等相关研究鲜见报道,鉴于此,本研究对核桃干果种子进行预处理,即设置不同种子状态(带壳核桃种子及去壳核桃种子),结合不同浓度GA3和NAA浸种处理,探究其对“温185”核桃种子萌发及幼苗生长的影响,以期寻求提高核桃发芽率和加快苗期生长的有效途径,进而为激素处理在核桃种子萌发过程中的应用提供理论支持。
1 材料与方法
1.1 试验地概况
采集的核桃树位于新疆阿克苏地区温宿县核桃林场,温宿县位于托木尔峰南,邻接塔里木盆地,昼长夜短且温差较大,是典型的暖温带大陆性气候。年日照时长2 850 h,阳光辐射充足,年均气温10.1 ℃,无霜期185 d,年降水量65 mm,气候干旱,适宜核桃生长[20]。实验于2021年8月至次年2月在塔里木大学园艺试验站节能型日光温室内进行。
1.2 试验材料
供试种子于核桃果实完全成熟期,采自新疆阿克苏地区温宿县的核桃林场,品种为“温185”。所用植物激素:GA3(≥90%,北京索莱宝科技有限公司生产),NAA(≥99%,上海源叶生物有限公司生产)。
1.3 试验方法
1.3.1种子预处理
选取种仁饱满、无霉无虫,且单果重大于等于12 g的干果作为实验材料,自然晾干。实验材料分干果核桃果实(以下称带壳种子)和核桃种子(以下称为去壳种子),去壳种子用核桃夹子把核桃夹出环形裂口,去除果壳取出种子。GA3、NAA分别设50、150、250、350、450 mg/L等5个浓度,以清水处理为对照(ck),20粒种子为一个处理,重复3次。
1.3.2浸种催芽处理
将备好的试验材料在室温(20±2)℃环境中浸泡,以清水处理为ck。
1) 带壳种子:不同浓度GA3、NAA水溶液浸泡7 d。
2) 去壳种子:不同浓度GA3、NAA水溶液浸泡24 h。种子完成浸泡后清水洗净,放在湿润的发芽盒内,置于30 ℃恒温培养箱中催芽处理,每日观察种子发芽情况,及时清除腐烂霉变种子,7 d后进行播种。
1.3.3播 种
核桃种子催芽处理后用无菌水冲洗,2021年10月将种子播入营养钵(基质比例园土∶草炭土∶蛭石=2∶1∶1,用0.5%高锰酸钾溶液浇透,置于阴凉处2 d备用)。播后浇透水用薄膜覆盖,每日观测种子发芽情况。
1.4 数据处理
播种前统计种子萌芽数,播种30 d后统计发芽率、烂种率,播种90 d后,对种子的生长情况进行观测,每处理随机选取10株幼苗,测定苗高、主根长、须根数、叶片数和腋芽数等生长指标。
萌芽率/%=(催芽后种子露白数/供试种子数)×100%;
发芽率/%=(发芽总粒数/供试种子数)×100%;
烂种率/%=[(害虫数+腐烂数)/供试种子数]×100%。
用DPS 7.05软件对各项指标进行方差分析和相关性分析,选取LSD多重比较进行方差分析(p<0.05);用Origin 2021软件作图,Excel 2019软件制表。
2 结果与分析
2.1 不同处理对核桃种子发芽的影响
2.1.1不同处理对核桃种子萌芽率的影响
该试验萌芽率于播种前统计,此时萌芽率表现出种子内部生理活动对激素处理的应答反应。由图1可知,不同种子状态(带壳核桃和去壳种子)在GA3和NAA处理下,萌芽率随浓度增加总体呈先升后降的趋势,且各处理显著高于ck。当GA3浓度为150 mg/L和450 mg/L处理时,去壳种子萌芽率较带壳种子存在显著差异,而NAA在250~450 mg/L处理间,去壳种子萌芽率较带壳种子存在显著差异,其余处理不同种子状态间不存在显著差异。
由图1可以看出,GA3不同浓度的促进效果350 mg/L>250 mg/L>150 mg/L>450 mg/L>50 mg/L,各处理均显著高于ck(p<0.05)。带壳种子和去壳种子萌芽率最高分别达79.39%和86.03%。当NAA浓度为250 mg/L时带壳种子和去壳种子的萌芽率达到最高,分别达76.32%和84.47%,分别较ck提高了25.53%和25.50%。其次,带壳种子的较优处理为150 mg/L的NAA(达72.98%),去壳种子的较优处理为350 mg/L的NAA(达82.96%),与最优处理无显著差异(p>0.05)。综上可知,GA3、NAA对核桃种子萌发均具有促进作用,但随浓度增加其促进作用逐渐减弱,而去壳种子处理较带壳种子处理更有利于提高种子萌芽率。
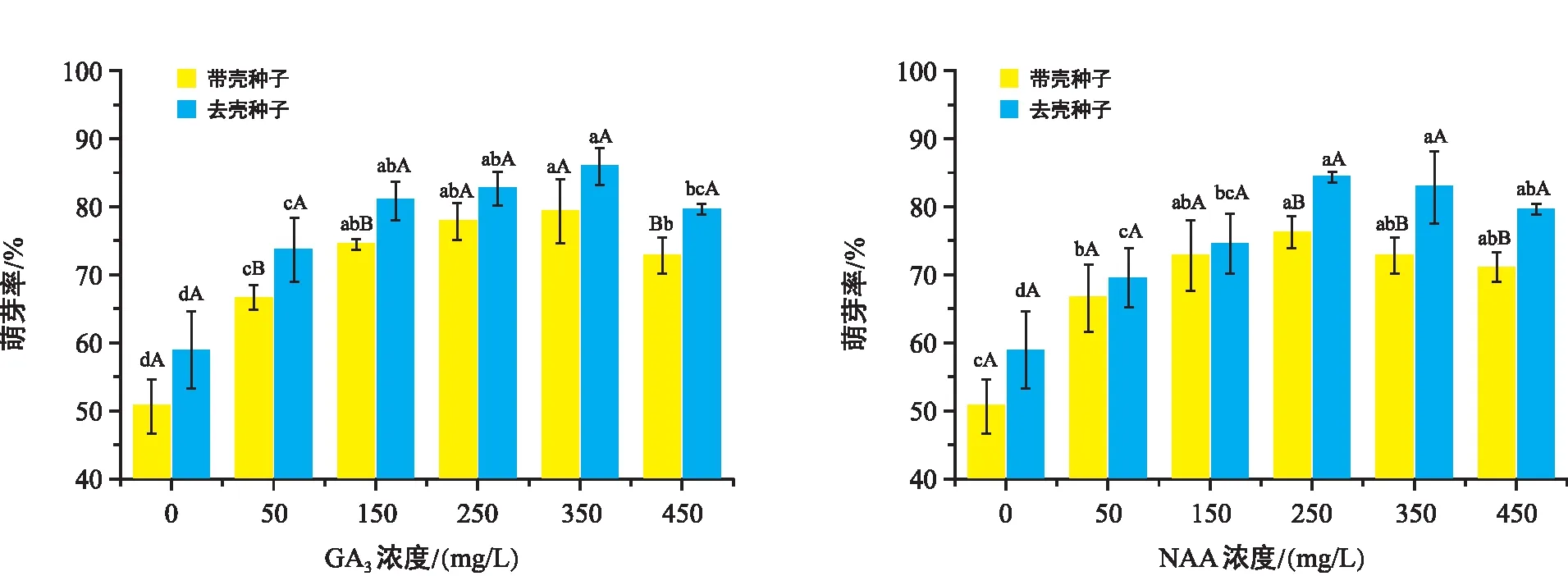
注:图中不同小写字母表示同一激素下不同浓度的差异显著性(p<0.05),不同大写字母表示同一浓度下不同种子状态的差异显著;图中误差线为标准误。下同。图1 不同处理对“温185”核桃种子萌芽率的影响Fig.1 Effect of different treatments on seed germination rate of Wen 185 Juglans regia L.
2.1.2不同处理对核桃种子发芽率的影响
由图2可知,不同状态的核桃种子在GA3和NAA处理下,发芽率随浓度增加总体呈先升后降的趋势。除ck外,其余各处理在带壳种子和去壳种子处理间均无显著差异(p>0.05)。
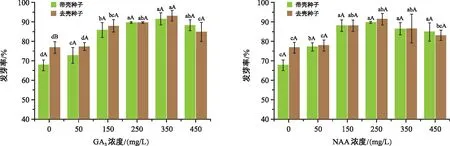
图2 不同处理对“温185”核桃种子发芽率的影响Fig.2 Effect of different treatments on seed germination rate of Wen 185 Juglans regia L.
不同状态种子,用不同浓度GA3处理与ck均存在显著差异(p<0.05)。GA3在50~350 mg/L处理下发芽率逐渐达到最高,带壳种子和去壳种子分别为91.49%和93.06%,当浓度超过350 mg/L时发芽率开始降低。GA3处理梯度下,仅有浓度450 mg/L时带壳种子发芽率优于去壳种子,两处理相差6.75%。250 mg/L的NAA处理下发芽率达到最高,带壳种子和去壳种子分别为89.82%和91.40%。NAA处理时,带壳种子在50~450 mg/L处理发芽率显著高于ck,而去壳种子处理仅在150~350 mg/L处理的发芽率显著高于ck(p<0.05),可见NAA对去壳种子发芽率有促进作用的浓度集中在250 mg/L左右。结果表明,去壳种子处理优于带壳种子,GA3和NAA随浓度增加能显著提升种子发芽率,且GA3处理的促进效果优于NAA处理。
2.1.3不同处理对核桃种子坏种率的影响
由图3可知,不同种子状态下随浓度增加,GA3处理的坏种率总体呈下降趋势,而NAA处理总体呈先下降后略有升高趋势,带壳种子和去壳种子的坏种率无显著差异(p>0.05)。
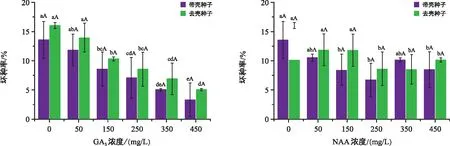
图3 不同处理对“温185”核桃种子坏种率的影响Fig.3 Effect of different treatments on rotten seed rate of Wen 185 Juglans regia L.
不同GA3浓度处理下,去壳种子坏种率均高于带壳种子。GA3处理在150~450 mg/L时坏种率逐渐降低,且显著低于ck(p<0.05),带壳种子和去壳种子分别为3.33%和5.09%。与ck相比,带壳种子GA3浓度由低到高坏种率依次降低了1.75、5.00、6.47、8.51、10.26个百分点;去壳种子GA3质量浓度由低到高坏种率依次降低了2.12、5.73、9.14、7.49、10.99个百分点。不同种子状态下,250 mg/L的NAA处理时坏种率达到最低,与ck差异显著(p<0.05),较ck分别降低了6.84%和7.49%。50 mg/L和350 mg/L的NAA处理时,带壳种子与ck相比无显著差异(p>0.05),其他各处理坏种率与ck相比差异显著(p<0.05)。350 mg/L的NAA处理下,带壳种子坏种率高于去壳种子。综上可知,带壳种子坏种率普遍低于去壳种子,GA3在种子萌发过程中浓度越高坏种率越低,而NAA对坏种率的影响不稳定,说明GA3能够减少坏种的发生。
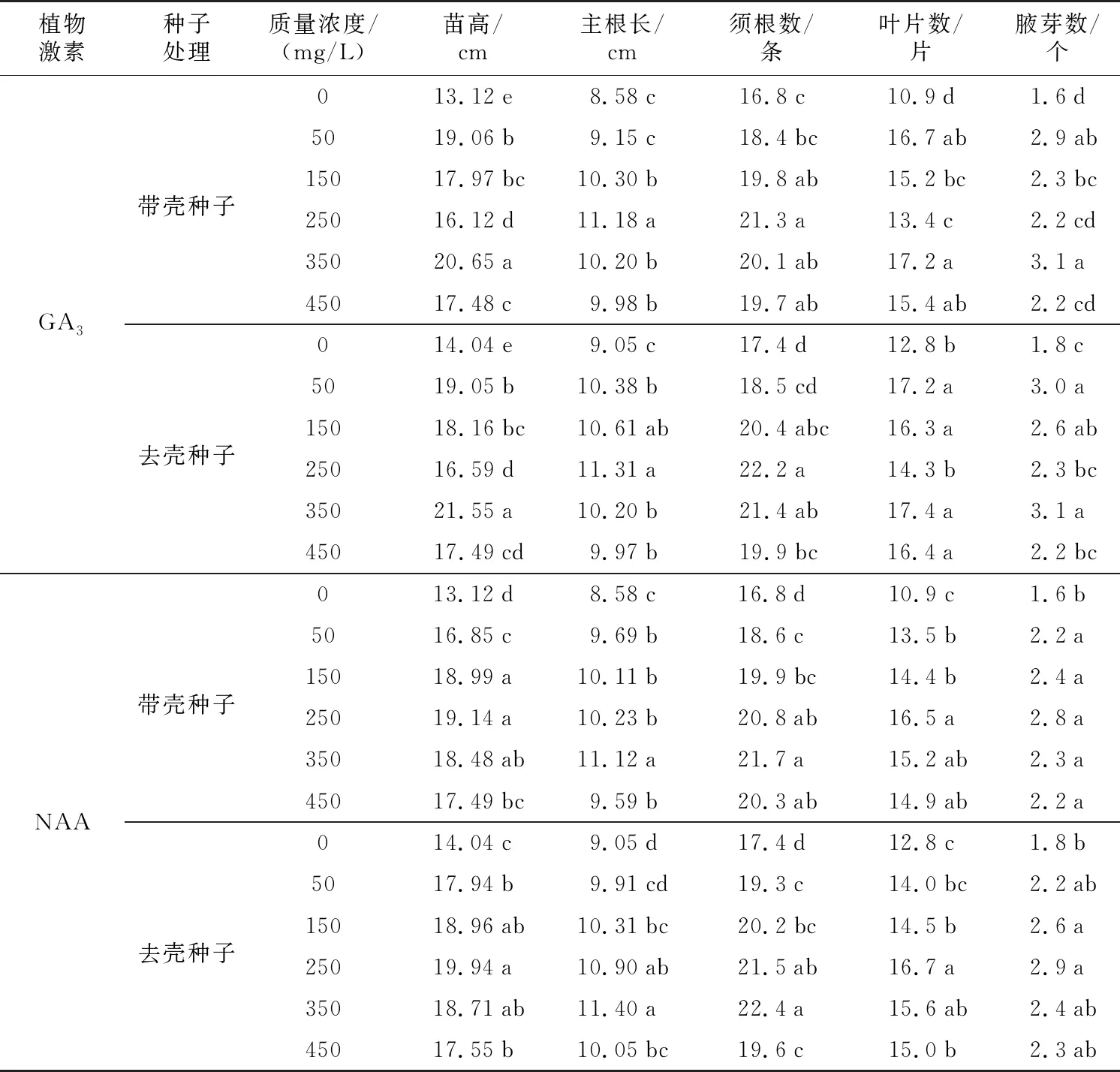
表1 不同种子状态及激素处理对核桃幼苗生长的影响Table 1 Effects of different seed states and hormone treatments on seedling growth

表2 影响幼苗生长指标因素的主次顺序与最优水平Table 2 The primary and secondary order and optimal level of factors affecting seedling growth indexes
2.2 不同处理对核桃幼苗生长的影响
由表1可知,不同种子状态和激素处理对核桃幼苗的苗高、主根长、须根、叶片数和腋芽的影响不同。分析比较不同种子状态下,不同GA3、NAA浓度处理对生长指标的影响程度、主次顺序以及各指标的最优水平,如表2所示,幼苗苗高、叶片数和腋芽数受种子是否带壳影响较大,R值分别为7.51、6.30和1.50,最优处理水平下,苗高达到21.55 cm,叶片数达到17.40片,腋芽数达到3.10个。而幼苗的主根长和须根受NAA影响较大,最优处理浓度为350 mg/L,主根长和须根数分别达到11.40 cm和22.4条。由此可知,GA3和NAA处理后,对核桃种子幼苗的生长起到了不同的促进效果,GA3对幼苗生长的地上部指标影响较大,NAA对幼苗生长的地下部指标影响较大。
2.3 核桃幼苗各项生长指标相关性分析
苗高、叶片和腋芽属于幼苗的地上部分,而主根和须根属于幼苗的地下部分。由表3可知,“温185”核桃幼苗各生长指标均为正相关,其苗高与叶片数和腋芽的生长呈极显著正相关(r>0.707 9),与主根长和须根数无显著相关性(r<0.576 0);主根长与须根数生长呈极显著正相关(r>0.707 9),与叶片数和腋芽无显著相关性(r<0.576 0);须根数与叶片数和腋芽之间也无显著相关性(r<0.576 0);叶片数与腋芽的生长呈极显著相关关系(r>0.707 9)。结果表明,核桃幼苗在生长过程中,地上部分各指标间存在显著性正相关,地下部分各指标间存在显著性正相关,地上与地下部分相关性不明显。
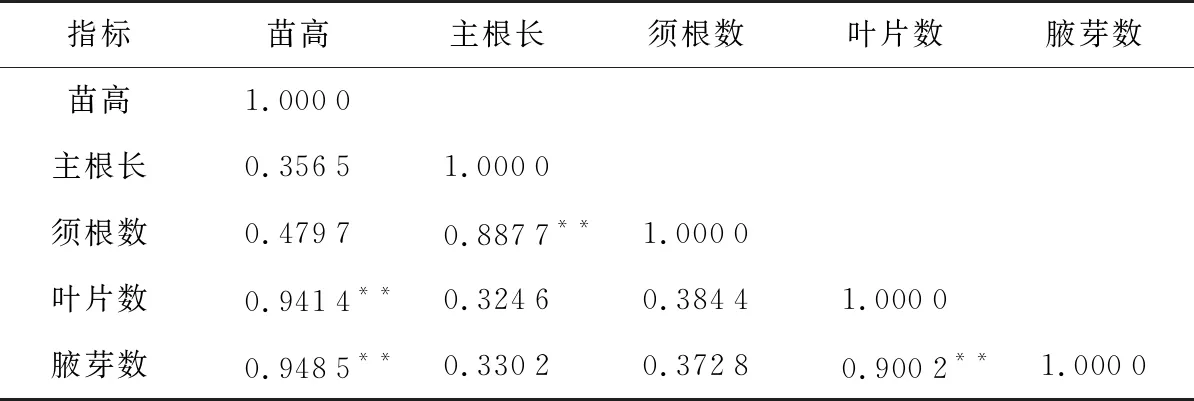
表3 幼苗生长指标相关性分析Table 3 Correlation analysis of growth indexes of seedlings
3 讨 论
3.1 预处理方式对种子萌发的影响
植物生长调节剂是一种与植物内源激素相似,有生理生化效应的人工合成物质[21-22],在种子的萌发过程中,植物激素可以打破种子的休眠状态,加快细胞分裂的速度,为种子的萌发创造良好的条件。外源激素不仅对植物生长发育具有调控作用,还对植物种子萌发起到促进或抑制的作用[23-24]。
研究发现,100~1 600 mg/L的GA3浸泡去壳核桃种子,发芽率、发芽势和发芽指数呈先增后减趋势,当浓度为200 mg/L时处理效果最优,但种子总体反应亦不敏感[25]。本试验进行带壳种子与去壳种子预处理,发现不同状态种子的萌芽率和发芽率与ck相比,随浓度增加均存在显著差异,但去壳种子总体优于带壳种子,这一结果与汤王外等[26]研究带壳及去壳金铁锁种子的萌发试验,去壳种子能显著提高发芽率的结果一致。所以适当的机械破损在种子发芽过程中,更有利于种子进行吸胀作用,以提前结束种子休眠,促进种子内部物质的相互转化。
3.2 不同植物激素处理对种子萌发的影响
种子萌发期和幼苗期是植物最为敏感的两个时期[27],在本研究中不同植物激素处理与ck相比,对种子的萌芽率、发芽率及幼苗生长均有提升,但不同激素促进效果不同。这与高焕章等[17]用不同植物生长调节剂水溶液浸泡建始核桃种子,其发芽率和幼苗指标均表现出差异的结果一致。王巍[18]研究不同浓度赤霉素对核桃种子萌发及幼苗生长的影响,发现不同浓度赤霉素的作用部位不同。李俊南等[19]对薄壳山核桃种子研究发现,GA3处理发芽率表现为先上升后下降再上升的趋势,浓度最大时(250 mg/L)发芽率最高(达90%),幼苗生长过程中,地上部和地下部粗生长受GA3影响较大。向亮等[28]对翅碱蓬种子的研究结果表明,高浓度激素溶液影响内部生理活动,从而对种子的萌发促进作用逐渐减弱,甚至产生抑制作用。说明植物激素的适用对象广泛,低浓度激素处理有利于种子萌发及幼苗生长,而高于一定浓度则会产生抑制作用。
GA3可以解除种子休眠,使种胚周围的组织软化,有利于胚芽突破种皮促进种胚的生长[29]。本实验中,GA3处理不同状态的核桃种子,发芽率表现为随浓度增加先升高趋于稳定后下降,在GA3浓度为250~350 mg/L时发芽率较优,幼苗的地上生长指标受影响也较大,且变化趋势与发芽率相似,这与廖建良等[30]对青蒿种子萌发的研究发现,种子发芽率随GA3浓度升高逐渐降低的实验结果相悖。袁芳等[31]对喜马拉雅紫茉莉种子研究发现,NAA处理不利于其萌发。李韦瑶等[32]研究发现,50~800 mg/L的NAA处理对山韭种子的萌发有抑制作用,且随NAA浓度的增加,山韭种子的发芽和形态指标均呈下降趋势。有研究表明,NAA可以促进细胞分裂和组织分化,诱导形成不定根,也能影响细胞分裂、细胞伸长和分化,促进种子发芽和不定根、侧芽的形成[33]。本研究中,NAA较ck显著提高萌发率,但超过250 mg/L则产生抑制作用,对于幼苗的生长指标,实验认为,中低质量浓度的NAA有利于主根和须根的生长且随浓度变化对地下部影响较大。植物激素具有微量高效的作用,而且作用效果与施用方法和施用物质量以及施用种子种类有一定的关系,不同种子对不同植物生长调节剂的敏感程度不同,使得该激素在不同的材料上表现出较大的差异性。
3.3 核桃种子幼苗生理指标的综合分析
植物激素在改善种子萌发和幼苗发育上具有积极作用,不同种子状态及浸种处理对苗高生长指标影响不同。由主次顺序发现,激素种类对苗高、腋芽及须根指标影响较大,GA3处理的苗高和腋芽优于NAA处理,而主根长和须根数NAA处理优于GA3处理;主根长与叶片数受种子状态影响较大,去壳处理优于带壳处理。李俊南等[28]研究GA3和NAA处理薄壳山核桃种子发现,最优处理苗高为15.1 cm,叶数为5片,主根长达15.65 cm,须根数达51.8条,而本试验中苗高最高达21.55 cm、叶片数达17.4片、主根长和须根数分别为11.4 cm和22.4条。差异可能来自实验浸种催芽温度(30 ℃)影响,适宜高温时幼苗生长速度加快,而地下部指标较低,推测是种子播种在营养钵内,生长受到一定抑制,也与不同人员对指标统计方法不同有关。本实验以GA3和NAA浸种处理,虽较ck有明显提升,但同浓度不同激素间差异不明显,为明确不同植物激素对核桃种子发芽和幼苗的相互作用,可减小浓度梯度,增加地上与地下指标统计等做进一步研究。
4 结 论
本研究对不同状态“温185”核桃种子在不同植物激素浸种处理下种子萌发和幼苗生长进行初步探究,发现去壳种子处理优于带壳种子处理,GA3和NAA在适宜条件下对核桃种子萌发率、发芽率均有显著促进作用,烂种率随浓度增加有所降低。GA3浸种幼苗苗高、叶片数、腋芽的生长效果优于NAA浸种效果,可显著提高种子萌发的各项指标并有效促进植株地上部分生物量的积累,而NAA对地下部的影响优于GA3处理,可促进植物根系生长、诱导形成不定根。综合“温185”核桃种子发芽情况及形态指标得出,两种激素的最适浸种浓度为GA3350 mg/L和NAA 250 mg/L。

