花生种子在低温胁迫下的萌发抑制生理研究
王艺喆, 苏良辰
(遵义医科大学珠海校区, 广东 珠海 519041)
花生(ArachishypogaeaL.)是我国重要的油料作物和经济作物之一,种植面积常年保持在450万hm2以上,仅次于印度(800万hm2),居世界第2位[1]。萌发期是花生生产过程中最重要也是最脆弱的一个阶段,在此过程中种子遭受环境胁迫会对花生产量造成严重影响[2-3]。其中,低温对花生种子萌发和幼苗生长发育有重要影响,也是影响花生春季和秋季播种的重要因素,极大制约了我国花生生产的种植面积[4-5]。
花生种子萌发是一个多因素参与的复杂调控过程,其中,抗氧化酶能清除种子萌发过程中产生的自由基及氧化中间产物,维持细胞自由基的低水平状态并保护细胞膜不受损伤,为种子正常萌发提供适宜的条件[6-8]。同时,植物激素互作在种子萌发过程中发挥关键调控作用。赤霉素能增强细胞伸长并促进胚的生长,而脱落酸则抑制种子萌发、促进种子休眠[9]。细胞分裂素能够解除种子休眠、促进萌发,增强胚的膜透性及促进赤霉素释放[10]。赤霉素和脱落酸的拮抗作用调控着种子萌发的整个过程,赤霉素能够直接或者间接抵消脱落酸的抑制作用,而脱落酸又能抑制赤霉素合成[11-12]。因此,花生种子中抗氧化酶活性和植物激素水平变化与低温条件下种子的萌发关系密切。
本研究通过测定低温条件下的粤油7号花生种子中渗透调节物质含量、抗氧化酶活性等生理生化指标和萌发相关植物激素合成基因的相对表达量,探讨了花生萌发时期低温对于种子生理生化的影响规律,为深入研究花生的低温栽培育种提供实验基础。
1 材料与方法
1.1 植物材料与培养
供试花生品种为粤油7号,由实验室保存。将带壳种子分别置于25 ℃和15 ℃培养箱中7 d以上。选取颗粒饱满未发芽的种子洗净,转移至超纯水浸湿滤纸的培养皿上。分别在25 ℃(常温处理组)和15 ℃(低温处理组)培养箱(光照0 h,湿度70%)中培养,每组50粒花生。分别在0 h,24 h,48 h取花生胚,液氮速冻后于-80 ℃冰箱保存备用,用于后续生化指标和基因相对表达量的测定。
1.2 实验方法
1.2.1发芽率的测定
胚芽突破种皮定为发芽,每个组做3个重复,每个培养皿中50粒花生种子,从第一天开始每天统计种子发芽数。
发芽率/%=(发芽种子数/培养皿种子总数)×100%。
1.2.2胚中各项生化指标的检测
超氧化物歧化酶(SOD)、丙二醛(MDA)和蛋白浓度分别按照碧云天公司的S 019、S 0131和P 0012 S试剂盒进行检测。脯氨酸(Pro)、过氧化物酶(POD)和可溶性糖分别按照Solarbio公司的BC 0295、BC 0095、BC 0030试剂盒进行检测。
1.2.3基因表达量检测
利用FastPure Plant Total RNA试剂盒提取总RNA,M-MuLV第一链cDNA合成试剂盒进行cDNA合成。采用实时定量PCR技术检测胚中AhYUC1、AhGA20OX1、AhIPT5、AhACS1和AhNCED1的表达量,引物见表1,使用仪器为MX 3500 P Real-time PCR system。PCR反应条件为:95 ℃预变性30 s;95 ℃变性10 s;60 ℃退火延伸30 s,共40个循环。每个样品3次重复,最后取平均值。
1.2.4数据处理
采用SPSS 25.0统计软件处理数据,多组间的差异采用单因素方差分析,p<0.05表示有显著性差异。用Origin 2019软件作图。
2 实验结果
2.1 不同温度处理下的花生种子萌发率
实验结果表明,25 ℃培养24 h和48 h时种子萌发率分别为60.00%和76.67%,种子正常萌发。而在15 ℃低温培养48 h内没有种子萌发(图1)。说明花生种子萌发受温度影响较大,种子在低温条件下无法正常萌发。

注:红色标尺表示长度。图1 不同温度下花生种子萌发情况Fig.1 Seed germination at different temperatures
2.2 不同温度对花生萌发过程中MDA含量的影响
MDA是膜脂过氧化的主要产物,可以反映细胞或组织中膜脂的过氧化程度。由图2可知,不同温度条件下培养的花生种子中MDA含量都是先上升后下降,但低温条件下的花生种子变化幅度明显小于常温组。同0 h相比,24 h处理后,常温处理组与低温处理组分别上升了395.79%、121.23%;48 h处理后,常温处理组上升了37.89%,而低温处理组下降了10.22%。随着种子的萌发,种子膜脂过氧化程度提高,MDA含量增加,达到峰值后开始减小。
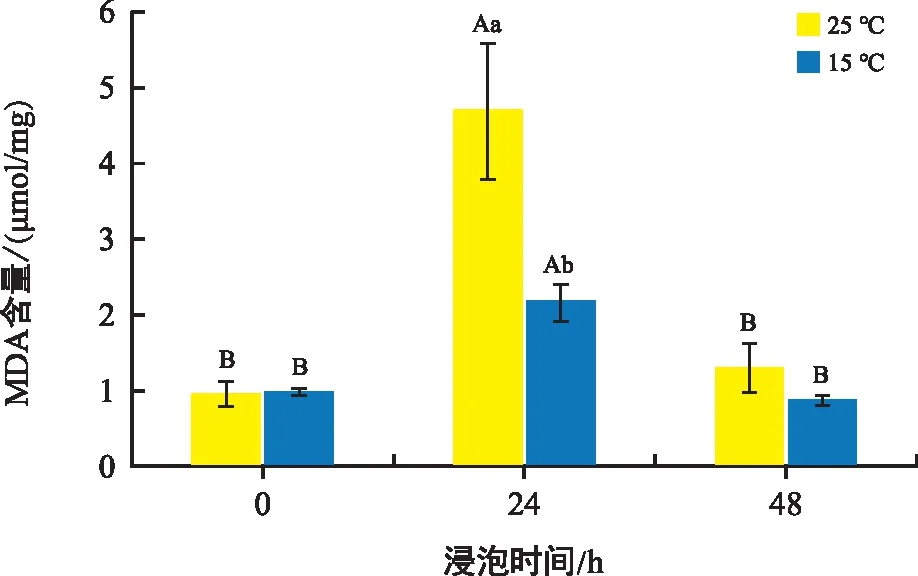
注:不同大写字母表示相同温度不同时间下具有显著性差异,不同小写字母表示相同时间不同温度下具有显著性差异,p<0.05。下同。图2 不同温度和时间下花生胚中MDA含量变化Fig.2 Changes in malondialdehyde content in peanut embryos at different temperatures and times
2.3 不同温度对花生萌发过程中Pro含量的影响
由图3可知,常温处理24 h和48 h的种子Pro含量较0 h分别上升了41.70%和30.89%。低温处理组的种子Pro含量在24 h和48 h较0 h分别下降40.96%和60.31%,下降趋势明显。
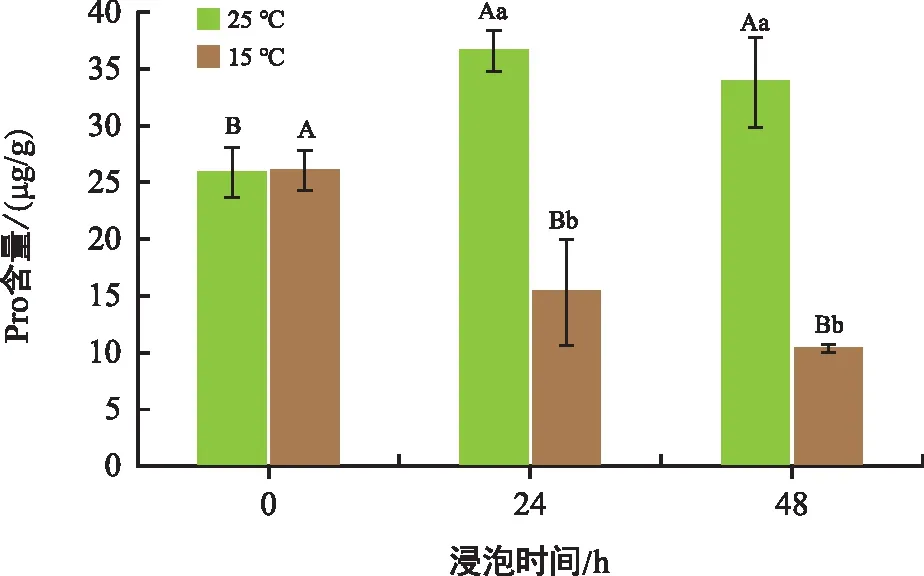
图3 不同温度和时间下花生胚中Pro含量变化Fig.3 Proline content in peanut embryos changes at different temperatures and times
2.4 不同温度对花生萌发过程中POD活性的影响
由图4可知,常温处理组花生种子中的POD含量在各时间点没有明显变化。但是在低温处理组中POD的含量随着种子培养时间的延长含量不断上升,且低温组中的POD含量均高于常温组。
2.5 不同温度对花生萌发过程中SOD活性的影响
SOD是生物体内的一种抗氧化金属酶,它能够催化超氧阴离子自由基歧化生成氧和过氧化氢,在细胞氧化与抗氧化平衡中起到至关重要的作用。由图5可以看出,与对照相比,常温处理组SOD活性在24 h、48 h分别上升了34.49%、18.24%,而低温处理组分别上升了8.83%、14.39%。随着培养时间的延长,SOD活性都有所增加。0 h、24 h、48 h时低温处理组的SOD活性分别比常温处理组高42.52%、15.33%、37.89%。
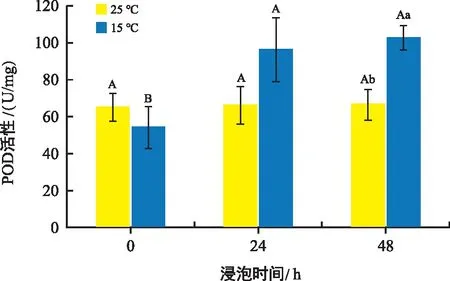
图4 不同温度和时间下花生胚中POD活性变化Fig.4 Changes in peroxidase content in peanut embryos at different temperatures and times
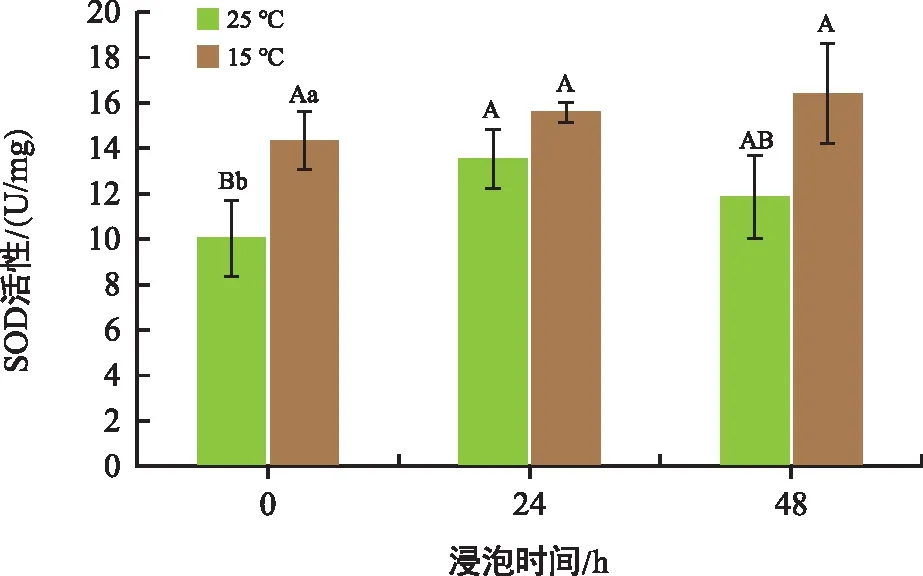
图5 不同温度和时间下花生胚中SOD活性变化Fig.5 Changes in superoxide dismutase content in peanut embryos at different temperatures and times
2.6 不同温度对花生萌发过程中可溶性蛋白含量的影响
植物可溶性蛋白和可溶性糖都是植物细胞内调节渗透压的物质,还可以作为防冻剂或稳定剂,往往作为细胞抗胁迫生理指标。由图6可知,与0 h相比,常温组24 h、48 h组可溶性蛋白浓度下降了52.58%、65.69%,低温组24 h、48 h组蛋白浓度分别下降了53.73%、61.78%。两组随着培育时间的延长可溶性蛋白浓度都有所下降,但组间无显著差异。
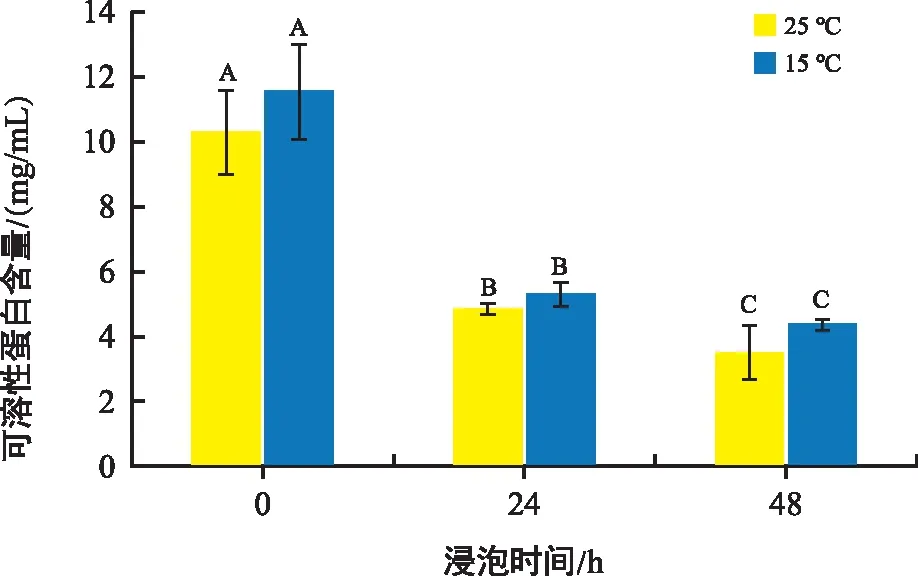
图6 不同温度和时间下花生胚中可溶性蛋白含量变化Fig.6 Changes in protein content in peanut embryos at different temperatures and times
2.7 不同温度对花生萌发过程中可溶性糖含量的影响
如图7所示,在低温胁迫下,低温组的可溶性糖含量高于常温组。相比于0 h,常温处理24 h、48 h组可溶性糖含量分别降低63.67%、58.60%,低温组24 h、48 h分别降低了29.39%、37.85%。低温处理组中可溶性糖下降幅度较小。相同处理时间条件下,低温组的可溶性糖含量明显高于常温组。
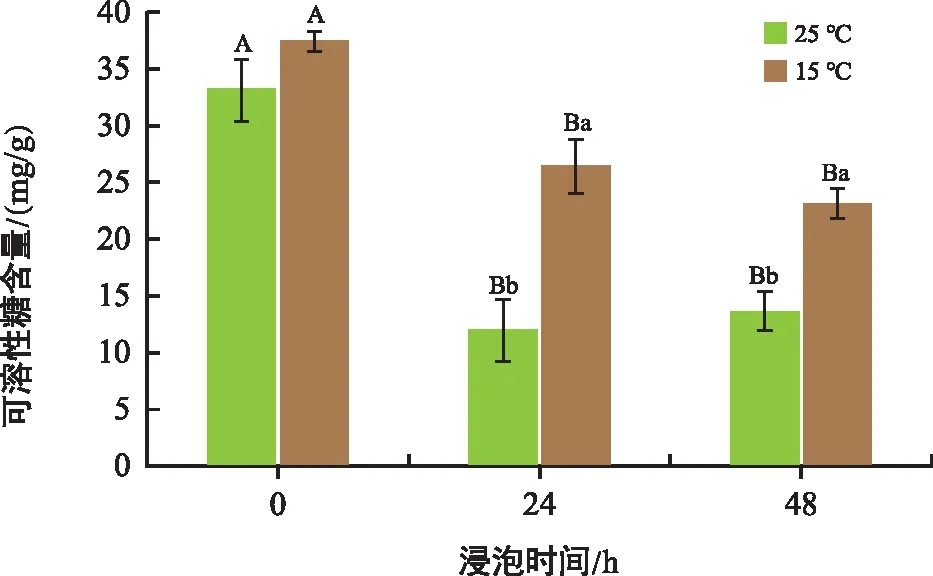
图7 不同温度和时间下花生胚中可溶性糖含量变化Fig.7 Changes in soluble sugar content in peanut embryos at different temperatures and times
2.8 低温对花生萌发过程中相关植物激素合成基因表达的影响
为探究低温胁迫对花生种子萌发中内源激素基因的表达变化,分析了花生AhYUC1(生长素合成相关基因)、AhGA20OX1(赤霉素合成相关基因)、AhIPT5(细胞分裂素合成相关基因)、AhACS1(乙烯合成相关基因)和AhNCED1(脱落酸合成相关基因)在不同温度下的基因相对表达量。由图8可以看出,AhYUC1、AhGA20OX1、AhIPT5、AhACS1和AhNCED1基因表达水平受低温胁迫诱导。在低温胁迫24 h后,花生胚中AhYUC1基因表达量上调7.19倍,AhGA20OX1基因表达量上调96.11倍,AhIPT5基因表达量上调80.08倍,AhACS1基因表达量上调4.73倍,AhNCED1基因表达量上调了2.32倍。其中AhYUC1和AhGA20OX1的表达趋势一致,表达量逐渐升高,AhIPT5、AhACS1和AhNCED1的表达趋势一致,都是先升高后降低,在24 h达到峰值。常温处理组,AhYUC1、AhGA20OX1和AhIPT5的变化趋势一致,表达量先上升后下降,在24 h达到峰值,表达量分别上调1.29倍、16.19倍和8.07倍,AhACS1和AhNCED1的表达趋势一致,逐渐下降,在处理48 h后达到最低,表达量分别下调了90.00%和96.00%。
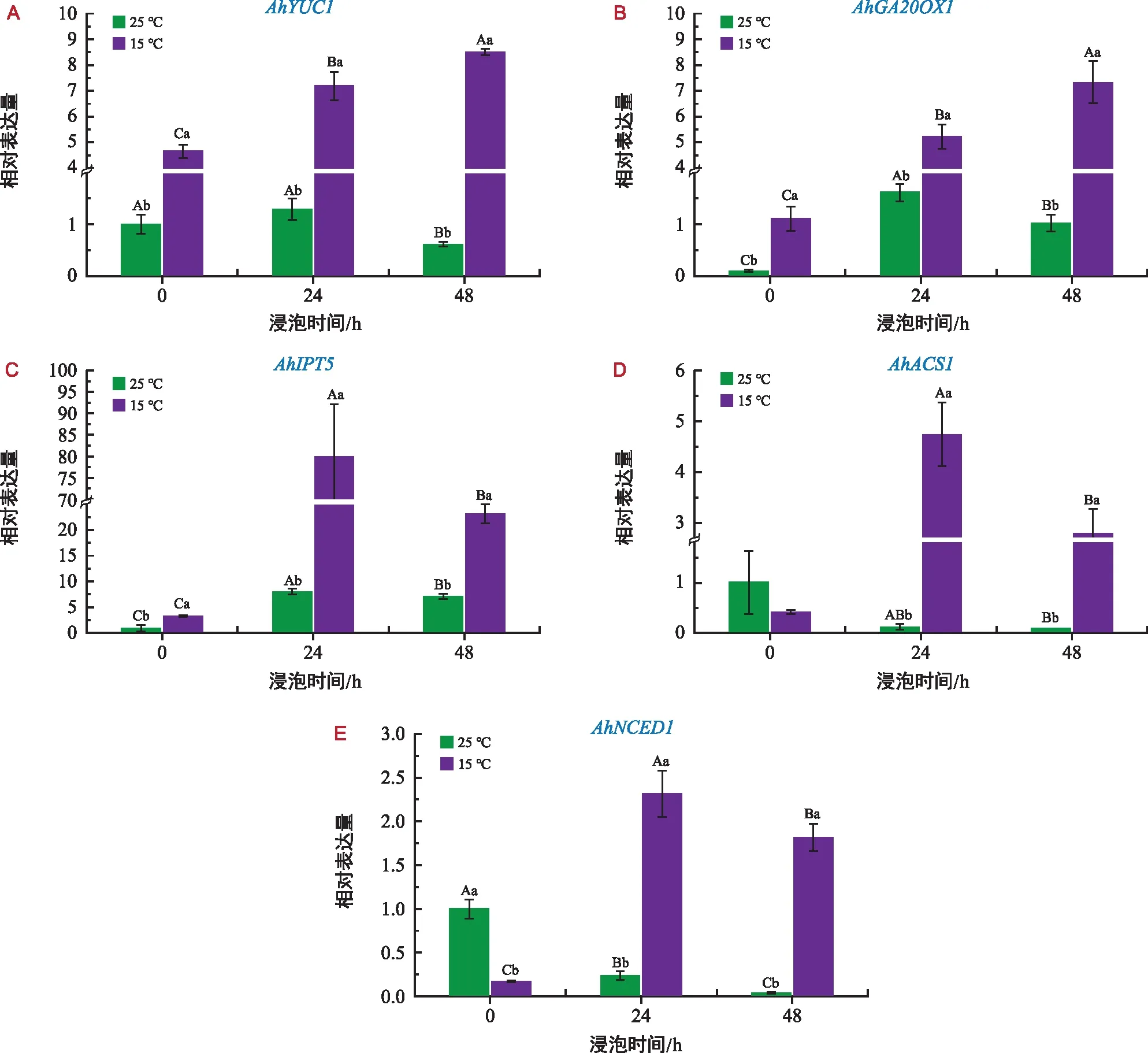
图8 低温对花生胚AhYUC1、AhGA20OX1、AhIPT5、AhACS1、AhNCED1表达的影响Fig.8 Effect of low temperature on the expression of peanut embryos AhYUC1,AhGA20OX1,AhIPT5,AhACS1 and AhNCED1
3 讨 论
植物中发挥关键保护作用的抗氧化酶类主要为SOD和POD。研究表明,种子在低温下的萌发率和抗氧化酶含量与植物的抗氧化能力成正比,同时与MDA等过氧化代谢产物含量成反比。Aiju等[13]在玉米萌发的研究中发现,13 ℃低温预处理4 d的玉米种子较常温培养的种子总抗氧化能力明显下降。并且在抗性品系中,1~6 d的SOD活性显著高于对照组,同时POD活性在总体水平上也显著高于对照组;而MDA含量在抗性品系中表现出较低水平的累积[14]。本研究发现,随着萌发的进行,低温处理组中的POD和SOD酶活性均明显高于常温处理组,呈不断上升的变化趋势。同时,低温处理组中的MDA和Pro含量也显著低于常温处理组。可溶性蛋白和可溶性糖含量都会下降,但低温组下降幅度小于常温组,且低温处理组的含量都高于常温处理组。这表明花生种子在萌发过程中遭受低温胁迫影响,种子显著降低了细胞内的代谢活动,并在细胞内合成大量抗氧化物质以降低有害物质积累,保护种子活力,从而延缓种子萌发。
花生种子在不同温度条件下的萌发活力受细胞内多种植物激素的调节控制。据报道,赤霉素(Gibberellins,GAs)和脱落酸(Abscisic Acid,ABA)之间的植物激素平衡密切调控种子的萌发状态,两者在多个水平上相互作用[15-16]。本研究中,花生种子无论在常温条件还是在低温条件下,AhGA20OX1和AhIPT5基因的表达量均出现不同程度的上调,但在低温条件下AhYUC1、AhGA20OX1和AhIPT5基因上调表达的幅度更为明显。说明在不同的处理温度下萌发促进因子均上调。萌发抑制因子在不同温度条件的表现则显示出明显的差异,常温处理组中的AhACS1和AhNCED1基因的表达量出现明显的下调,而低温处理组中两个基因显著上调表达。这表明在低温条件下,花生种子中的萌发抑制因子的上调表达影响了种子的萌发过程。综合以上结果认为,低温条件下种子的萌发延迟受到萌发抑制因子的影响最显著。低温胁迫下,花生种子达到了生长发育的新稳态,从而抑制了萌发进程,在这一过程中脱落酸和乙烯的生物合成在其中发挥了关键的抑制作用。此研究为提高花生种子在低温胁迫条件下的萌发率提供前期实验基础。

