药物诱导肺癌细胞衰老的体外研究
石邈 续力云 陈志军 陆畅畅 周吉航 黄燕燕
作者单位:316021 舟山医院胸心外科(石邈、陈志军),细胞分子生物实验室(续力云、陆畅畅、周吉航、黄燕燕)
肺癌是全球发病率和死亡率最高的恶性肿瘤,其5 年生存率低于20%[1]。目前治疗肺癌的方法主要有手术、放疗、化疗、靶向治疗、免疫治疗及联合治疗[2],然而机体本身就存在抗肿瘤的防御机制,细胞衰老就是其中之一。细胞衰老是细胞永久失去增殖能力但仍保留正常细胞代谢活力的一种状态。一般而言,当机体受到外界不良刺激,如氧化应激、DNA 损伤等,细胞周期就会停滞,随之细胞开始出现衰老。越来越多的研究表明细胞衰老不仅与肿瘤抑制有关,而且与正常衰老、内环境稳态和其他许多退行性疾病也息息相关[3-5]。
虽然药物诱导的细胞凋亡是抗肿瘤的主要机制,但是细胞衰老也在其中发挥了一定的作用[6]。有研究发现在肺癌患者接受放射治疗的过程中,抑制肿瘤生长的方式是细胞衰老而非细胞凋亡[7]。那么抗癌药物是否也能诱导细胞衰老,从而抑制恶性肿瘤细胞的增殖,这极大地吸引了研究者的兴趣。本研究分别选用顺铂(cisplatin,DDP)、Nutlin-3 的活性异构体(Nutlin-3a)、4-异硫脲基丁腈盐酸盐(kevetrin hydrochlorid,Kevetrin)等3 种药物体外处理肺癌细胞,探讨药物诱导肿瘤细胞衰老的可能机制和对肿瘤治疗的潜在价值。
1 材料和方法
1.1 细胞来源及培养 人肺腺癌细胞A549、人大细胞肺癌细胞H460 和人非小细胞肺癌细胞H2228 均购于中国科学院上海细胞库。A549 细胞完全培养基为含10%FBS 的F12 培养基,H460 和H2228 的完全培养基均为含10%FBS 的RPMI 1640 培养基,培养条件为37 ℃、5%CO2培养箱中传代培养。
1.2 主要试剂 DDP(批号:232120,美国Sigma 公司);Nutlin-3a(批号:SML0580,美国Sigma 公司);Kevetrin(批号:903507,美国Sigma 公司);β-半乳糖苷酶细胞衰老染色试剂盒(批号:K146501,美国Thermo Fisher Scientific 公司);Click-iT®EdU Alexa FluorTM555 Imaging Kit 试剂盒(批号:C10338,美国Thermo Fisher Scientific 公司);衰老相关分子p53 抗体(批号:2527T,美国Cell Signaling Technology 公司);p21 抗体(批号:2947s,美国Cell Signaling Technology 公司);β-actin 抗体(批号:20536-I-AP,美国Proteintech 公司);甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(批号:BL006B,北京Biosharp Life Sciences)等;Real-time qPCR 试剂(批号:RR820A,日本Takara 公司);CCK-8 细胞增殖与毒性检测试剂盒(批号:C008,七海生物科技公司);ABI 荧光定量PCR 仪(型号:7500,美国Applied Biosystems 公司)。
1.3 细胞衰老检测 采用β-半乳糖苷酶染色。吸弃细胞培养液,加入1 ml β-半乳糖苷酶染色固定液,室温固定15 min,吸去固定液,加入1 ml 染色工作液,37 ℃恒温箱中孵育过夜,培养1 周后,光学显微镜下观察各组细胞的形态和间质变化,镜下观察染色,阳性细胞(衰老细胞)呈深蓝色,阴性细胞无着色。各组随机计数40 个细胞中的阳性细胞数,计算阳性细胞率(%)。各组独立重复实验3 次。具体分组如下:设置对照组和不同浓度DDP(1.562 5、3.125、6.25、12.5 μmol/L)处理组分别处理A549、H460、H2228 肺癌细胞株;同理,设置二甲基亚砜(dimethyl sulfoxide,DMSO)对照组和不同浓度Nutlin-3a(2、4、8、16 μmol/L)处理组分别处理A549、H460、H2228 肺癌细胞;设置空白对照组和100 μmol/L Kevetrin 处理组分别处理A549 肺癌细胞。1.4 细胞增殖实验 采用EdU染色。在细胞培养液中加入EdU 工作液,室温孵育2 h;去上清液,加入1 ml 3.7%甲醛固定液,室温孵育15 min,用含3%BSA 的PBS 洗1 次;加入1 ml 含0.5% Triton®X-100 PBS 通透液,室温作用15 min,用含3%BSA 的PBS 洗1 次;随后加入试剂盒中的Click-iT®reaction cocktail,室温避光孵育30 min,用含3%BSA 的PBS 洗1 次,加入试剂盒组分G: Hoechst®33342 室温孵育30 min,染核,PBS 洗1次后;荧光显微镜下观察、拍照,处于增殖状态的细胞为红色阳性细胞,蓝色为细胞核。各组随机计数40 个细胞中的阳性细胞数,计算增殖细胞阳性率(%),各组分别独立重复实验3次。具体分组为:设置6.25 μmol/L DDP 及其对照组、8 μmol/L Nutlin-3a 及其DMSO 对照组分别处理A549 细胞。
1.5 细胞存活率检测 采用CCK-8 法。取100 μl 细胞密度为5×104个/ml 的对数生长期肺癌细胞,接种于96 孔板,次日根据实验分组换液,换成含相应浓度药物的培养液,作用72 h 后,向每孔加入10 μl CCK-8溶液,培养箱继续孵育2 h,酶标仪测定450 nm 处吸光度(A)值。实验组药物浓度分别为6.25 μmol/L DDP、8 μmol/L Nutlin-3a 和100 μmol/L Kevetrin,每组各设置6 个复孔。计算细胞存活率,细胞存活率=[(A实验孔吸光度-A空白孔吸光度)/(A对照孔吸光度-A空白孔吸光度)]×100%。
1.6 肺癌细胞p21 mRNA 表达水平 采用Real-time qPCR 法。具体为:提取细胞样本RNA,反转录为cDNA,作为PCR 扩增模板,PCR 反应体系各做3 份复孔,ABI 荧光定量PCR 仪上机检测,扩增程序如下:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火20 s,68 ℃延伸35 s,重复40 个循环。p21 正向引物:5'-CCATGTGGACCTGTCACTGT- 3',反向引物:5'- GTGGTAGAAATCTGTCATGCTGG-3';GAPDH 正向引物:5'-CATCATCCCTGCCTCTACTG-3',反向引物:5'-GCCTGCTTCACCACCTTC-3'。以GAPDH 作为内参,采用2-ΔΔCt法分析不同药物对p21 表达水平的影响。
1.7 肺癌细胞p53 和p21 蛋白表达检测 采用Western blot 法。取1×105个/ml 的对数生长期细胞接种于24 孔板,参照1.3 分别设置3 种不同药物不同浓度梯度药物处理组和空白对照组。DDP 和Nutlin-3a 药物处理细胞1 周,Kevetrin 药物处理细胞1 和2 h,以及对应时间的各自对照组细胞,细胞裂解液充分裂解细胞,提取蛋白样品,经12%SDS-PAGE 凝胶电泳后,转膜于0.45 μm 硝酸纤维素膜,5%脱脂奶粉封闭1 h,一抗4 ℃孵育过夜;TBST 洗膜3 次各10 min,辣根过氧化物酶标记山羊抗兔IgG 二抗(1∶10 000)室温孵育1 h,TBST 洗膜3 次各10 min,将膜置于ECL 化学发光剂中显影、拍照,β-actin 或GAPDH 作为内参,检测各分组细胞p53 和p21 蛋白表达水平。
1.8 统计学处理 采用SPSS 23.0 统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;两组间比较采用两独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 DDP、Nutlin-3a 和Kevetrin 对肺癌细胞衰老的影响 光学显微镜下观察到1.562 5、3.125、6.25、12.5 μmol/L DDP 处理的A549、H460 和H2228 细胞胞体增大,β-半乳糖苷酶蓝染衰老细胞增多,见图1(插页)。统计分析发现,与对照组比较,不同浓度DDP 处理组A549、H460 和H2228 阳性细胞率均增加,差异均有统计学意义(均P<0.05),见图2。此外,光学显微镜下观察发现2、4、8、16 μmol/L Nutlin-3a 处理的H460、H2228肺癌细胞,8 μmol/L Nutlin-3a处理的A549细胞,100 μmol/L Kevetrin 处理的A549 细胞,均发现蓝染衰老细胞增多,见图3(插页)。统计分析发现,与DMSO 对照组比较,不同浓度Nutlin-3a 处理组H460 和H2228 阳性细胞率均增加,差异均有统计学意义(均P<0.05),见图4A。与DMSO 对照组比较,8 μmol/L Nutlin-3a 处理组A549 阳性细胞率增加,差异有统计学意义(8.33%±0.83%比30.47%±1.67%,P<0.01),见图4B。与空白对照组比较,100 μmol/L Kevetrin 处理组A549 阳性细胞率增加,差异有统计学意义(18.33%±1.67%比71.67%±1.67%,P<0.01),见图4C。

图1 光学显微镜下观察1.562 5、3.125、6.25、12.5 μmol/L DDP 处理组和对照组对A549、H460 及H2228 肺癌细胞衰老的影响

图2 不同浓度DDP 处理组和对照组阳性细胞率比较

图3 光学显微镜下观察所见(A:光学显微镜下观察2、4、8、16 μmol/L Nutlin-3a 处理组及DMSO 对照组对H460 及H2228 细胞衰老的影响;B:光学显微镜下观察8 μmol/L Nutlin-3a 处理组及DMSO 对照组对A549 细胞衰老的影响;C:光学显微镜下观察100 μmol/L Kevetrin 处理组及空白对照组对A549 细胞衰老的影响)
2.2 DDP 和Nutlin-3a 对肺癌细胞增殖的影响 利用EdU 染色观察6.25 μmol/L DDP 及其对照组、8 μmol/L Nutlin-3a 及其DMSO 对照组对A549 细胞株增殖的影响,结果发现,在荧光显微镜下各药物处理组的红色阳性细胞,即正处于细胞增殖分裂状态的细胞数目明显少于对照组,见图5A、B(插页)。统计分析发现,与对照组比较,6.25 μmol/L DDP 处理组增殖细胞阳性率降低,差异有统计学意义(53.33%±1.67%比8.33%±0.83%,P<0.05),见图5C(插页)。与DMSO 对照组比较,8 μmol/L Nutlin-3a 处理组增殖细胞阳性率降低,差异有统计学意义(28.33%±1.67%比0.83%±0.08%,P<0.05),见图5D(插页)。

图5 DDP 和Nutlin-3a 对A549 肺癌细胞增殖的影响(A:6.25 μmol/L DDP 对A549 细胞增殖的影响,EdU 染色,×400;B:8 μmol/L Nutlin-3a 对A549 细胞增殖的影响,EdU 染色,×400;C:6.25 μmol/L DDP 处理组及对照组增殖细胞阳性率比较,与对照组比较,aP<0.05;D:8 μmol/L Nutlin-3a 处理组及DMSO 对照组增殖细胞阳性率比较;与DMSO 对照组比较,aP<0.01)
2.3 DDP、Nutlin-3a 和Kevetrin 对肺癌细胞存活率的影响 给药72 h 后,与各自对照组比较,6.25 μmol/L DDP、8 μmol/L Nutlin-3a 和100 μmol/L Kevetrin 处理组A549、H460、H2228 细胞存活率均降低,差异均有统计学意义(均P<0.05),见图6。

图6 DDP、Nutlin-3a 和Kevetrin 对肺癌细胞存活率的影响(A:6.25 μmol/L DDP 处理组和对照组肺癌细胞存活率比较,与对照组比较,aP<0.05;B:8 μmol/L Nutlin-3a 处理组和DMSO 对照组肺癌细胞存活率比较,与DMSO 对照组比较,aP<0.05;C:100 μmol/L Kevetrin 处理组和空白对照组肺癌细胞存活率比较,与空白对照组比较,aP<0.05)
2.4 DDP、Nutlin-3a 和Kevetrin 对A549 肺癌细胞p21 mRNA 表达水平的影响 与对照组比较,6.25 μmol/L DDP处理组肺癌细胞p21 mRNA表达水平上调,差异有统计学意义(1.000±0.104比5.400±0.717,P<0.05),见图7A。与DMSO 对照组比较,8 μmol/L Nutlin-3a 处理组肺癌细胞p21 mRNA表达水平上调,差异有统计学意义(1.018±0.063 比45.340±18.530,P<0.05),见图7B。与空白对照组比较,100 μmol/L Kevetrin 处理组肺癌细胞p21 mRNA 表达水平上调,差异有统计学意义(0.890±0.153 比11.400±2.642,P<0.05),见图7C。

图7 DDP、Nutlin-3a 和Kevetrin 对A549 肺癌细胞p21 mRNA 表达水平的影响(A:6.25 μmol/L DDP 处理组和对照组肺癌细胞p21 mRNA 表达水平比较,与对照组比较,aP<0.05;B:8 μmol/L Nutlin-3a 处理组和DMSO 对照组肺癌细胞p21 mRNA 表达水平比较,与DMSO 对照组比较,aP<0.05;C:100 μmol/L Kevetrin 处理组和空白对照组肺癌细胞p21 mRNA 表达水平比较,与空白对照组比较,aP<0.05)
2.5 DDP、Nutlin-3a 和Kevetrin 对肺癌细胞p53 和p21蛋白表达的影响 与对照组比较,不同浓度DDP 处理组肺癌细胞p53 和p21 蛋白表达水平均升高,且p21 蛋白表达水平随着药物浓度的梯度增高而升高,见图8。与DMSO 对照组比较,不同浓度Nutlin-3a 处理组A549、H460 细胞p53 和p21 蛋白表达水平均升高,见图9A、B。与空白对照组比较,100 μmol/L Kevetrin 处理组A549 细胞p21 蛋白表达水平上调,p53 蛋白表达水平变化不明显,见图9C。

图8 DDP 对肺癌细胞p53 和p21 蛋白表达的影响(A:不同浓度DDP 对A549 细胞p53 和p21 蛋白表达水平的影响;B:不同浓度DDP 对H460 细胞p53 和p21 蛋白表达水平的影响;C:不同浓度DDP 对H2228 细胞p53 和p21 蛋白表达水平的影响)
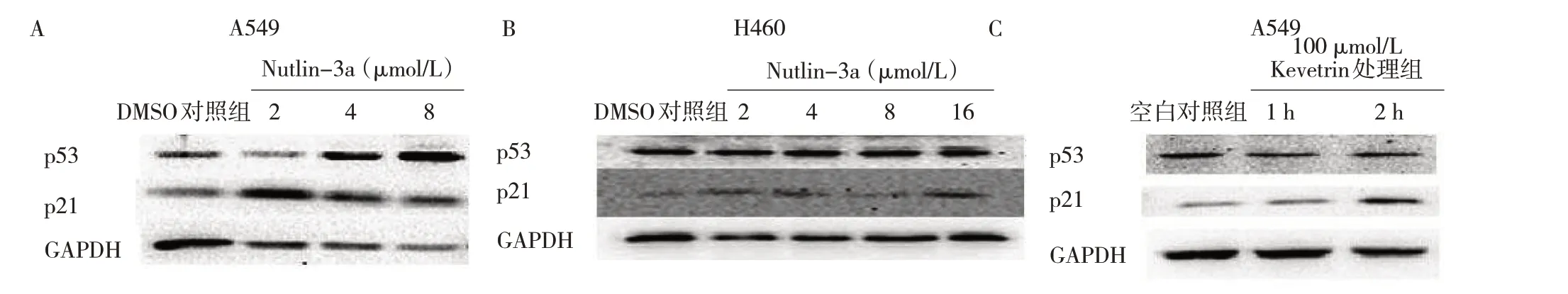
图9 Nutlin-3a、Kevetrin 对肺癌细胞p53 和p21 蛋白表达的影响(A:不同浓度Nutlin-3a 对A549 细胞p53 和p21 蛋白表达水平的影响;B:不同浓度Nutlin-3a 对H460 细胞p53 和p21 蛋白表达水平的影响;C:100 μmol/L Kevetrin 对A549 细胞p53 和p21 蛋白表达水平的影响)
3 讨论
DDP 作为临床治疗肺癌患者的一线基础化疗用药,目前一致认为铂类药物发挥抗肿瘤的主要机制是抑制DNA 复制,其主要作用在细胞有丝分裂的G2 期,能够诱导肿瘤细胞死亡。Nutlin-3a 是以MDM2-p53 为靶点设计开发的MDM2 抑制剂,是当下肿瘤药物研发的热点之一。众所周知,p53 是抑癌基因,而MDM2 是p53 基因的一个重要抑制因子,两者相结合可使p53 蛋白降解,导致抑癌作用减弱[7]。相反,另一种药物Kevetrin 也是抗肿瘤药物,能够激活p53 抑癌基因的能力,抑制肿瘤生长[8]。
上述3 种药物都具有抗肿瘤生长作用,但在有关能够诱导肺癌细胞衰老方面研究甚少。研究表明衰老细胞会停止分裂,然而不同于静止的细胞,衰老细胞不仅体积会增大,而且在显微镜下观察到细胞形态会变得平滑而不规则,细胞内衰老相关β-半乳糖苷酶活性增加[4]。本研究设计了3 种药物对肺癌细胞作用的体外试验,探讨药物是否能够诱导肺癌细胞衰老,结果发现,DDP、Nutlin-3a 及Kevetrin 处理的A549、H460 和H2228 细胞,胞体增大,β-半乳糖苷酶蓝染阳性衰老细胞增多,阳性细胞率增高。
细胞衰老的主要特征表现是细胞周期停滞,即细胞停止分裂,同时伴随着线粒体功能紊乱,促炎反应增强[9-11]。既往研究认为,在机体内,一方面细胞衰老是对抗肿瘤形成、发展的天然保护屏障,包括恶性肿瘤的放射治疗和化疗药物[12];另一方面,衰老细胞过多的积累将会反向损害器官组织的正常功能,并促进衰老[13]。本研究通过药物的细胞毒性实验及EdU 染色细胞增殖实验,发现DDP、Nutlin-3a 和Kevetrin 均可使肺癌细胞存活率明显降低,细胞增殖能力减弱,这也许是其发挥诱导肺癌细胞衰老机制之一。
以往研究发现,无论是体外还是体内实验,利用化学药物治疗恶性肿瘤后,肿瘤细胞停止生长,出现衰老,并且p53 参与其中的分子调控,同时还说明了p21 是p53 影响基因表达的主要中介[3]。此外,细胞在衰老的过程中,它的基因表达谱会发生急剧变化,尤其是与细胞周期抑制因子或者激活因子相关的基因,其中包括p21 和p16 的过表达,抑制了编码蛋白质刺激细胞周期的基因[14]。本研究发现,6.25 μmol/L DDP、100 μmol/L Nutlin-3a 及8 μmol/L Kevetrin 可使A549 肺癌细胞p21 mRNA 表达水平上调,且DDP 和Nutlin-3a可上调A549、H460 和H2228 肺癌细胞p53 和p21 蛋白表达水平。
细胞衰老特征的主要表现包括了不可逆性细胞周期停滞、细胞形态扁平增大、基因表达和染色质结构的改变以及衰老相关的β-半乳糖苷酶和分泌型表型的获得[15]。故本研究不足之处未能分析检测药物诱导下肺癌细胞衰老时细胞内染色质的改变及衰老细胞的衰老相关分泌表型。
以往研究大多认为细胞衰老能够抑制肿瘤生长,然而近期研究发现,衰老细胞在肿瘤中持续存在,在癌症中诱导衰老可能会在化疗或靶向治疗时促进复发[16]。因此,鉴定由衰老细胞特异性表达而在增殖细胞中缺失的治疗靶点很有必要[17]。总之,本研究发现DDP、Nutlin-3a、Kevetrin 3 种药物都能够诱导肺癌细胞衰老,抑制肿瘤细胞增殖,这也许对今后肺癌的治疗提供一种新策略。

