CircASH2L调节miR-128-3p/MKNK2轴对卵巢癌细胞紫杉醇耐药性的影响
莫 蕊,陈燕娥,吴 颖,陈 绵
(海口市妇幼保健院妇产科,海口 570203)
卵巢癌是常见的女性生殖系统恶性肿瘤,病死率很高,早期不易确诊,就诊时多为晚期,此时主要依靠化疗缓解肿瘤进展,但因癌细胞化疗耐药性的获得,疗效并不理想,且易复发。紫杉醇作为一种广谱抗癌化学药物,是晚期卵巢癌的治疗首选,尽量减轻卵巢癌的紫杉醇耐药性,可有效改善患者预后[1-3]。环状RNA(circular RNA,circRNA)在肿瘤发生发展过程中发挥重要作用,其中缺失-小同源异形-2样蛋白(Absent-Small-Homeotic-2-Like protein,ASH2L)在其中起到致癌作用,其高表达水平与肿瘤的恶性程度相关,可促进胰腺肿瘤侵袭、增殖和血管生成[4]。CircASH2L还可介导卵巢癌的发展、转移和预后,敲除CircASH2L基因可抑制卵巢癌细胞的侵袭和生长,并抑制异种移植的血管和淋巴管生成,发挥抗癌作用[5],但CircASH2L在肿瘤的紫衫醇耐药及卵巢癌发生发展中具有何种作用目前还没有明确。
miR-128-3p是一种肿瘤抑制因子,上调其表达可在体外显著抑制大肠癌细胞的增殖、迁移、侵袭和凋亡抵抗性,并在体内阻碍实体肿瘤生长[6],还可抑制胶质母细胞瘤细胞的活性、增殖、迁移、侵袭和多药耐药相关蛋白1(resistance-associated protein 1,MRP1)表达,恢复其对替莫唑胺的敏感性[7]。研究显示,miR-128-3p在卵巢癌组织和细胞中表达减少,过表达miR-128-3p可显著诱导卵巢癌细胞凋亡,降低其细胞活力和迁移侵袭能力[8]。MAP激酶相互作用丝氨酸/苏氨酸激酶2(MAP kinase interacting serine/threonine kinase 2,MKNK2)作为一种重要的肿瘤调控因子,在化疗耐药卵巢癌细胞中表达显著上调,与耐药卵巢癌患者的不良预后密切相关,敲除MKNK2基因可显著降低卵巢癌细胞的化疗耐药性,抑制其增殖[9]。以上文献提示miR-128-3p和MKNK2均是减弱卵巢癌细胞紫杉醇耐药性的潜在靶点。由生物信息学分析可知CircASH2L可能通过miR-128-3p调控MKNK2表达,因而预测CircASH2L可能通过调节miR-128-3p/MKNK2轴影响卵巢癌细胞的紫杉醇耐药性,本文通过敲低体外培养的人卵巢癌紫杉醇耐药细胞株SKOV3-TR30中CircASH2L表达,对此预测做验证研讨。
1 材料与方法
1.1 主要试剂与仪器 人卵巢癌细胞株SKOV3、人卵巢癌紫杉醇耐药细胞SKOV3-TR30(中国医学科学院肿瘤细胞库研究所);含双抗RPMI 1640培养基(YC-1003S,上海语纯);LipofectamineTM2000(invitrogen);野生型miR-128-3p报告质粒、CircASH2L过表达质粒、突变型miR-128-3p报告质粒、野生型MKNK2 3'-UTR报告质粒、突变型MKNK2 3'-UTR报告质粒、miR-128-3p mimics、miR-128-3p mimics阴性对照、miR-128-3p inhibitor、miR-128-3p inhibitor阴性对照、CircASH2L siRNA质粒、CircASH2L空载质粒、miR-128-3p及CircASH2L、MKNK2、多重耐药1(multidrug resistance 1,MDR1)、MRP5、β-actin、U6引物(上海吉玛);紫杉醇、MTT试剂盒/细胞增殖检测试剂盒、双荧光素酶报告基因检测试剂盒(北京索莱宝);一步法反转录荧光定量试剂盒、Trizol试剂、Annexin V凋亡检测试剂盒(上海生工);兔源抗人β-actin、MRP5、P-糖蛋白(P-glycoprotein,P-gp)、MKNK2一抗(美国Abcam公司)等。荧光定量PCR仪、酶标仪购自美国Bio-Rad公司;流式细胞仪购自美国BECKMAN COULTE公司;电泳仪电源、迷你双垂直电泳槽、迷你双垂直转印电泳槽购自上海江美;化学发光凝胶成像仪购自北京森西赛智科技有限公司。
1.2 方法
1.2.1 实时荧光定量PCR检测卵巢癌细胞中miR-128-3p与CircASH2L、MKNK2表达 解冻复苏的SKOV3和SKOV3-TR30细胞,用RPMI 1640(含双抗)细胞完全培养基(加10%胎牛血清)培养,传代后收集两种细胞。Trizol试剂提取细胞中总RNA,采用一步法反转录荧光定量试剂盒进行PCR扩增实验,具体方法和反应条件参考说明书。miR-128-3p以U6为内参,CircASH2L、MKNK2以β-actin为内参。引物序列,miR-128-3p:F-5'-TGCGGCAGTGGTTTTACCCTATG-3',R-5'-CCAGTGCAGGGTCCGAGGT-3';U6:F-5'-GCTTCGGCAGCACATATACTAAAAT-3',R-5'-CGCTTCACGAATTTGCGTGTCAT-3';CircASH2L:F-5'-GCTGGGCAGGAAAACCTATT-3',R-5'-TTTCCCAGGTCTCTGTCTGG-3';MKNK2:F-5'-TCATGCAAGCTTATGTGGAGCTGGAAG-3',R-5'-TTGATGCTAGATCAGCGGCGTTTGAGT-3';MDRl:F-5'-AAAAGATCAACTCGTAGGAGTG-3',R-5'-GCACAAAATACACCAACAA-3';MRP5:F-5'-GCTGTTCAGTGGCACTGTCAG-3',R-5'-TCAGCCCTTGACAGCGACCTT-3';β-actin:F-5'-CCGTACCACTGGCATCGTG-3',R-5'-GCCATCTCTTGCTCGAAG-3'。以2-ΔΔCt方法分析基因相对表达量。
1.2.2 SKOV3-TR30细胞分组处理及收集标本 SKOV3-TR30细胞进行传代后,接种在无菌24孔板培养,24h后随机分为对照组、紫杉醇组、紫杉醇+阴性对照组、紫杉醇+CircASH2L敲低组、紫杉醇+CircASH2L敲低+miR-128-3p inhibitor组。对照组不进行干预处理,紫杉醇组加20nmol/L紫杉醇处理[10],紫杉醇+阴性对照组加20nmol/L紫杉醇处理同时使用LipofectamineTM2000转染miR-128-3p inhibitor阴性对照和空载质粒(具体转染步骤参考LipofectamineTM2000说明书),紫杉醇+CircASH2L敲低组加20nmol/L紫杉醇处理同时以同法转染CircASH2L siRNA,紫杉醇+CircASH2L敲低+miR-128-3p inhibitor组细胞加20nmol/L紫杉醇处理同时以同法转染CircASH2L siRNA和miR-128-3p inhibitor,各组都于转染及药物处理24h后收集细胞备用。
1.2.3 MTT实验检测细胞增殖情况 SKOV3-TR30细胞进行传代后,按10000细胞/孔接种于无菌96孔板,24h后按1.2.2中方法分组处理,24h后每孔加适量MTT工作液急性培养4h,吸出上清,以二甲基亚砜溶解底部结晶,混匀后以酶标仪测量每孔吸光值。细胞增殖率=实验处理组吸光值/对照组吸光值×100%。
1.2.4 流式细胞实验检测细胞凋亡情况 SKOV3-TR30细胞进行传代后,接种在无菌24孔板培养24h,按1.2.2中方法分组处理,24h后以胰酶消化收集各组细胞后计数,每组取约1×106个细胞,PBS洗涤,采用Annexin V凋亡检测试剂盒通过FITC/PI双染法检测每组细胞凋亡情况,具体转染步骤参考试剂盒说明书。
1.2.5 实时荧光定量PCR检测细胞miR-128-3p与CircASH2L、MKNK2、MDR1、MRP5表达 收集各组细胞中总RNA,进行实时荧光定量PCR实验,具体按1.2.1中方法进行。
1.2.6 免疫印迹实验检测细胞MKNK2、P-gp、MRP5表达 以高强度RIPA裂解液裂解提取各组细胞中总蛋白,以改良型BCA蛋白浓度测定试剂盒测量其浓度,具体方法参考说明书。根据蛋白浓度测定结果每组取出20μg总蛋白进行变性、电泳分离、湿转转移处理,以脱脂牛奶封闭其非特异位点后裁下各目的蛋白MKNK2、β-actin、P-gp、MRP5,孵育一抗、二抗后显色,采集显色后蛋白条带图像,以Image J软件定量各蛋白灰度值后进行统计分析,以β-actin作为内参,得到其相对表达。
1.2.7 检测MKN-45细胞中CircASH2L对miR-128-3p及miR-128-3p对MKNK2的靶向调控 SKOV3-TR30细胞进行传代后,接种在无菌24孔板中培养24h,随机分为miR-128-3p突变+CircASH2L空载组(转染突变型miR-128-3p报告质粒+空载质粒)、miR-128-3p突变+CircASH2L过表达组(转染突变型miR-128-3p报告质粒+CircASH2L过表达质粒)、miR-128-3p野生+CircASH2L空载组(转染野生型miR-128-3p报告质粒+空载质粒)、miR-128-3p野生+CircASH2L过表达组(转染野生型miR-128-3p报告质粒+CircASH2L过表达质粒)、MKNK2突变+miR-128-3p mimics阴性对照组(转染突变型MKNK2 3'-UTR报告质粒+miR-128-3p mimics阴性对照)、MKNK2突变+miR-128-3p mimics组(转染突变型MKNK2 3'-UTR报告质粒+miR-128-3p mimics)、MKNK2野生+miR-128-3p mimics阴性对照组(转染野生型MKNK2 3'-UTR报告质粒+miR-128-3p mimics阴性对照)、MKNK2野生+miR-128-3p mimics组(转染野生型MKNK2 3'-UTR报告质粒+miR-128-3p mimics),按1.2.2中方法进行转染,24h后采用双荧光素酶报告基因检测试剂盒测量各组细胞双荧光素酶相对活性,具体方法参考试剂盒说明书。
2 结 果
2.1 CircASH2L、miR-128-3p、MKNK2在卵巢癌细胞中的表达 与SKOV3细胞相比,SKOV3-TR30细胞中CircASH2L与MKNK2 mRNA表达升高,miR-128-3p表达降低,差异均有统计学意义(P<0.05),见图1。
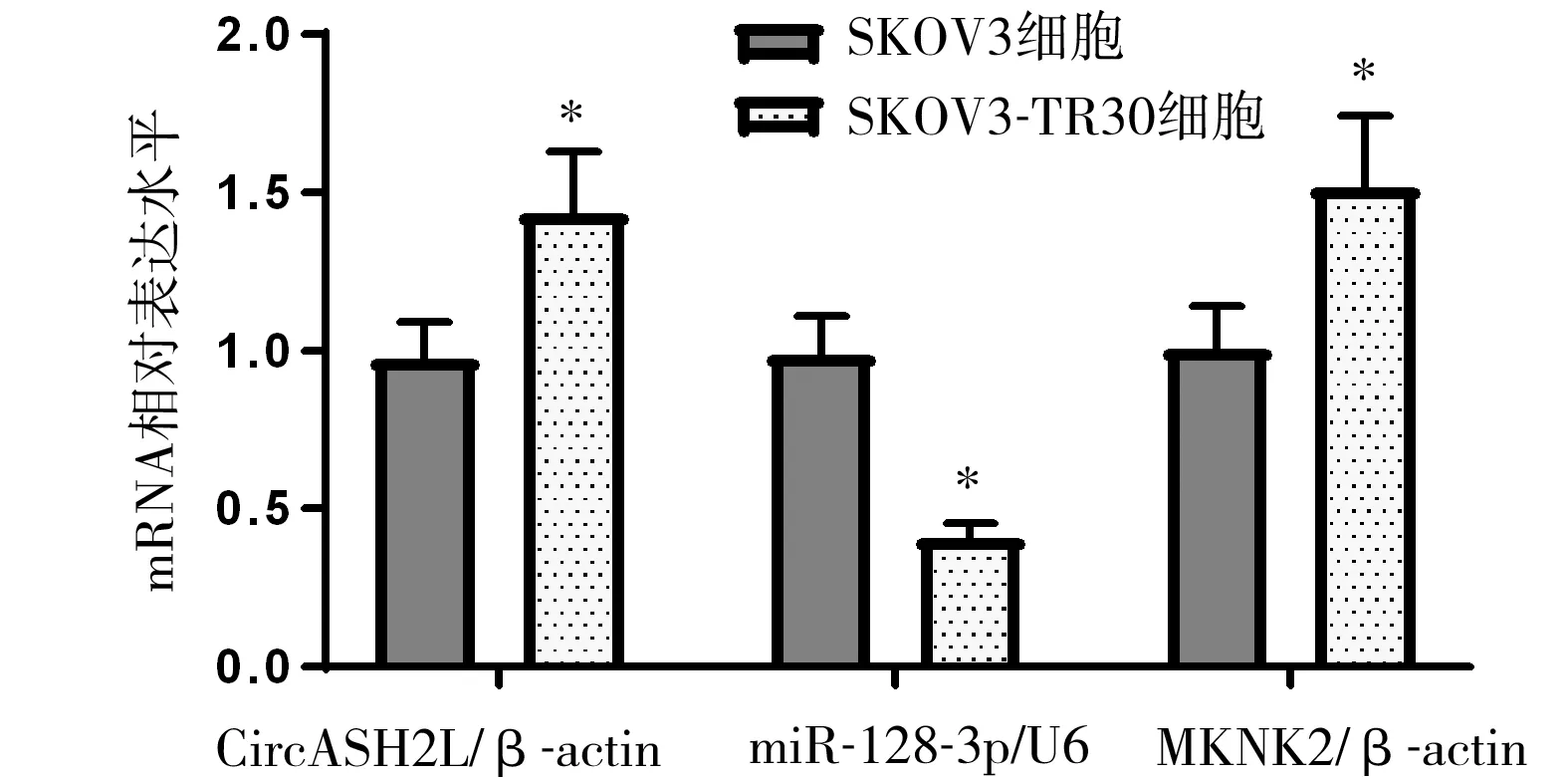
图1 各组细胞miR-128-3p与CircASH2L、MKNK2 mRNA表达
2.2 SKOV3-TR30细胞中CircASH2L对miR-128-3p的靶向调节及miR-128-3p对MKNK2的靶向调节 查询数据库发现CircASH2L和miR-128-3p之间有结合位点,见图2。与miR-128-3p野生+CircASH2L空载组比较,miR-128-3p野生+CircASH2L过表达组相对荧光素酶活性降低,差异有统计学意义(P<0.05);miR-128-3p突变+CircASH2L空载组与miR-128-3p突变+CircASH2L过表达组之间相对荧光素酶活性无明显差异,差异无统计学意义(P>0.05),见图3。
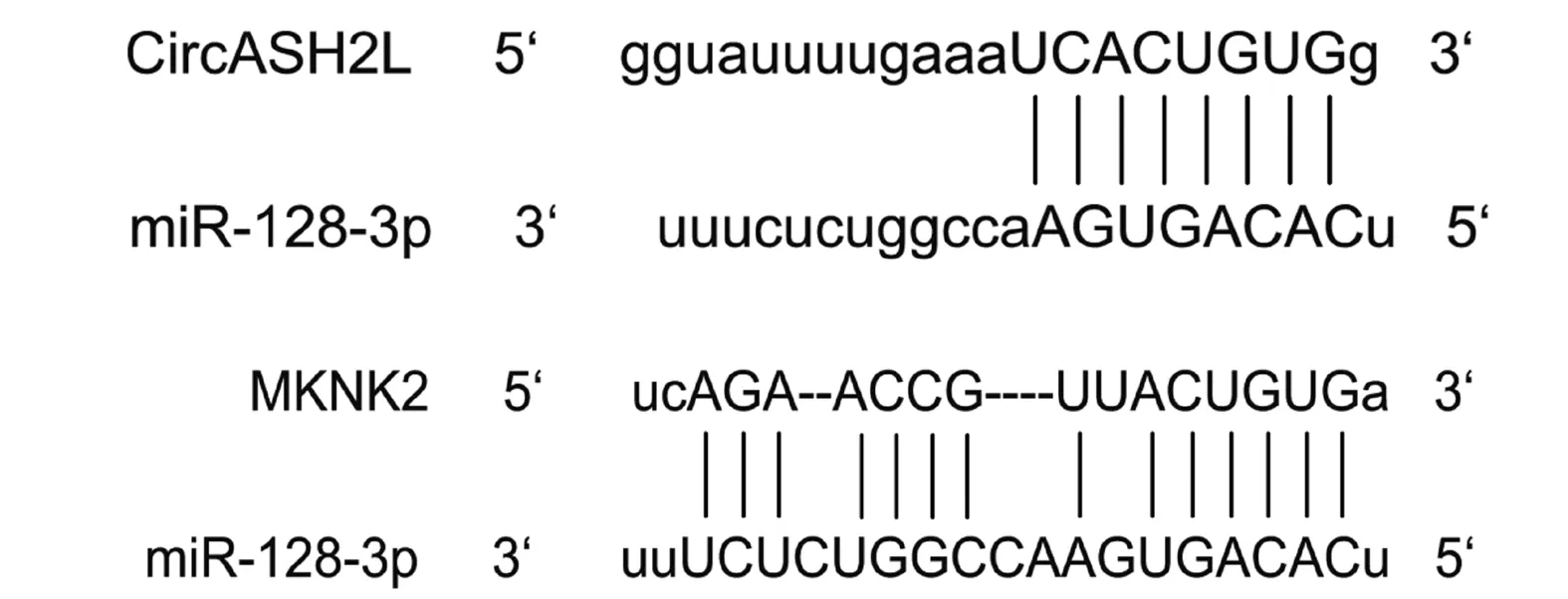
图2 miR-128-3p和MKNK2、CircASH2L的结合位点
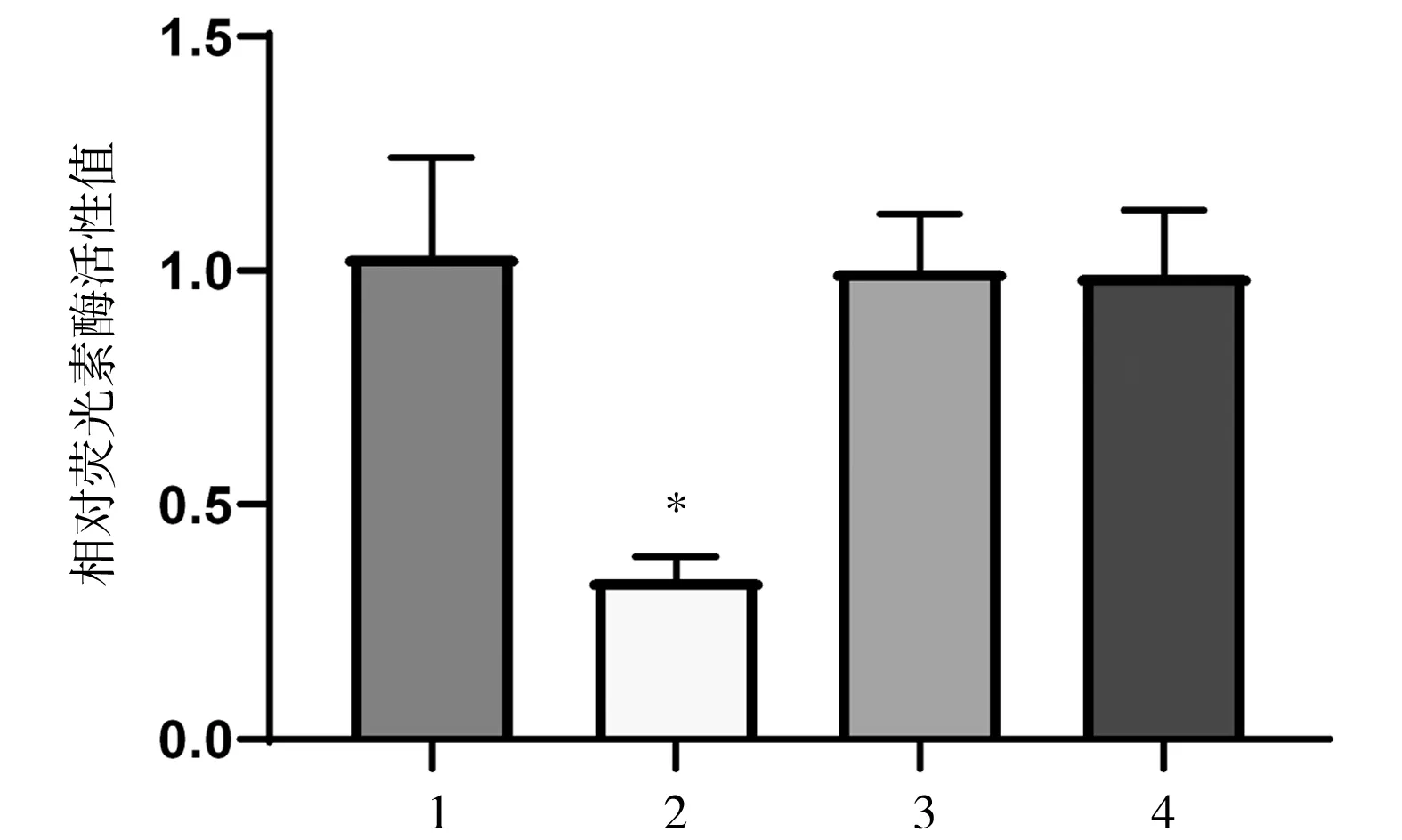
图3 各组SKOV3-TR30细胞相对荧光素酶活性值比较
miR-128-3p和MKNK2之间有结合位点,见图2。与MKNK2野生+miR-128-3p mimics阴性对照组比较,MKNK2野生+miR-128-3p mimics组相对荧光素酶活性降低(P<0.05);MKNK2突变+miR-128-3p mimics阴性对照组与MKNK2突变+miR-128-3p mimics组之间相对荧光素酶活性无明显差异,差异无统计学意义(P>0.05),见图4。
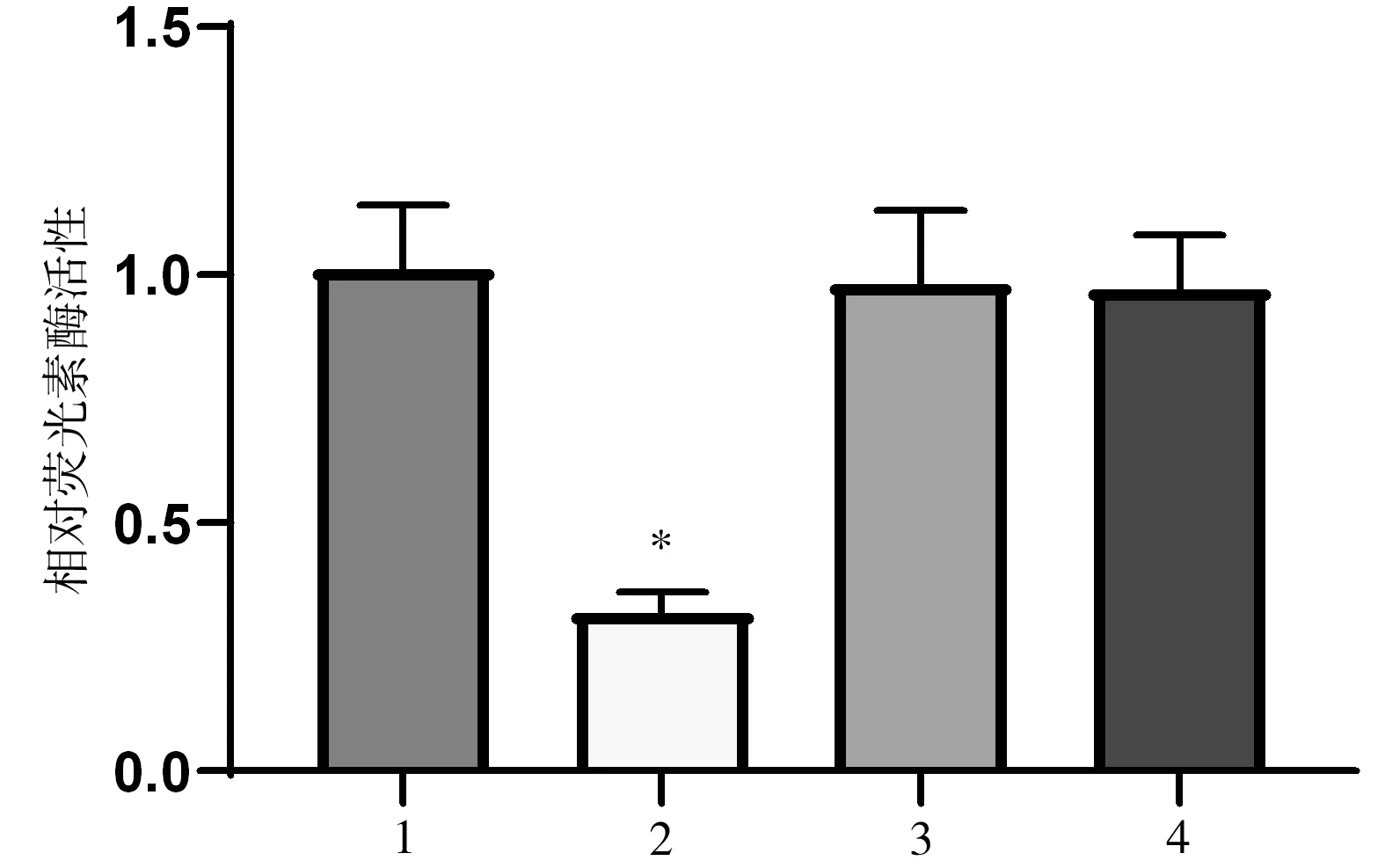
图4 各组SKOV3-TR30细胞相对荧光素酶活性值比较
2.3 各组细胞增殖率比较 与对照组、紫杉醇组相比,紫杉醇+CircASH2L敲低组的细胞增殖率降低,差异有统计学意义(P<0.05);与紫杉醇+CircASH2L敲低组相比,紫杉醇+CircASH2L敲低+miR-128-3p inhibitor组的细胞增殖率升高,差异有统计学意义(P<0.05),见图5。
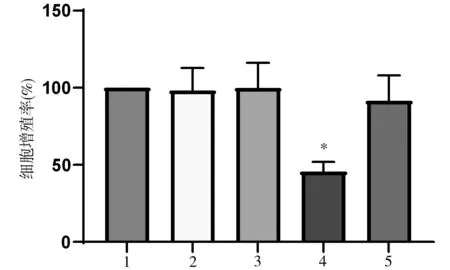
图5 各组细胞增殖率比较
2.4 各组细胞凋亡率比较 与对照组、紫杉醇组相比,紫杉醇+CircASH2L敲低组的细胞凋亡率升高,差异有统计学意义(P<0.05);与紫杉醇+CircASH2L敲低组相比,紫杉醇+CircASH2L敲低+miR-128-3p inhibitor组的细胞凋亡率降低,差异有统计学意义(P<0.05),见图6。
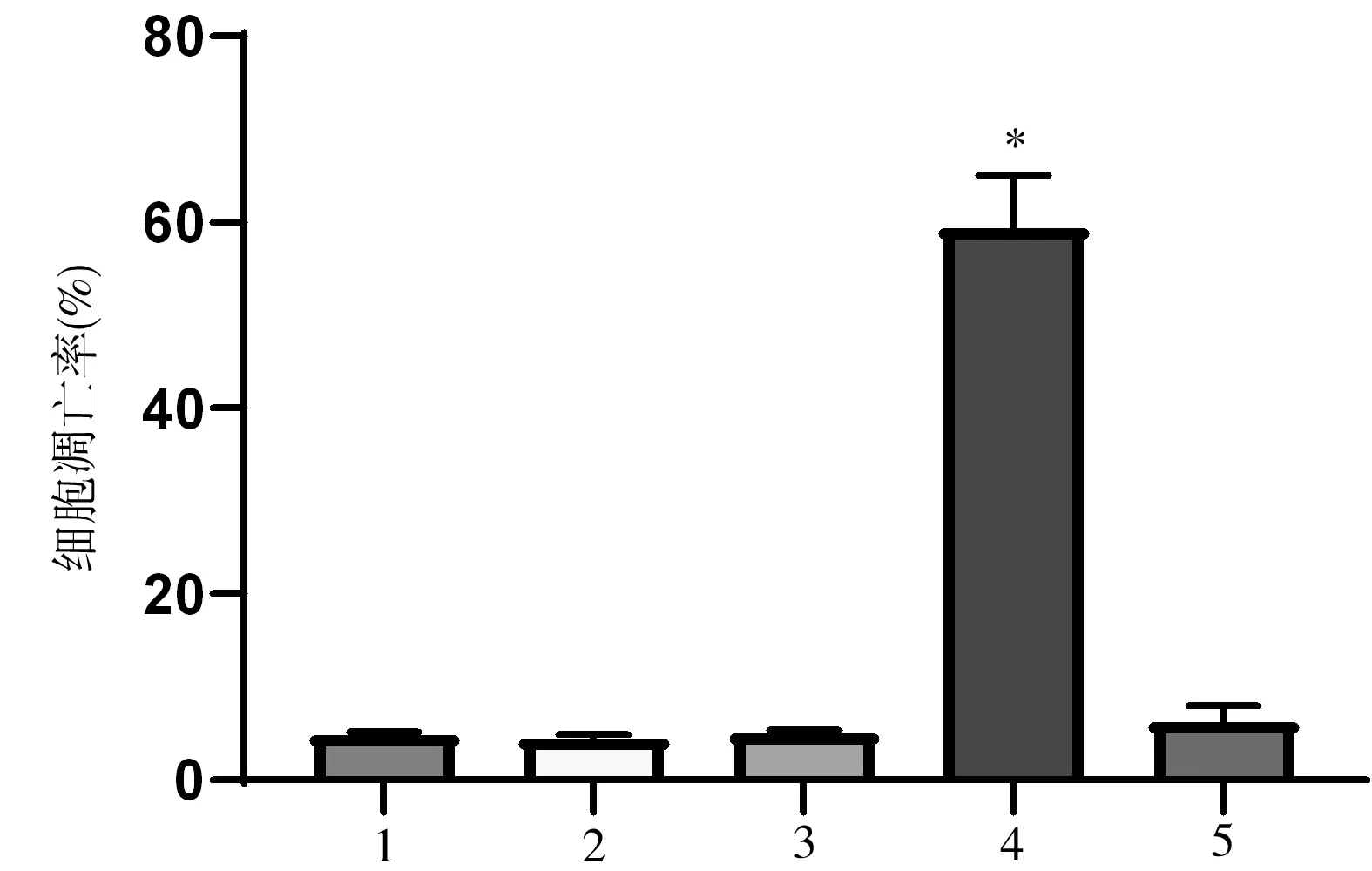
图6 各组细胞凋亡率比较
2.5 各组细胞miR-128-3p与CircASH2L、MKNK2、MDR1、MRP5 mRNA表达 与对照组、紫杉醇组相比,紫杉醇+CircASH2L敲低组细胞CircASH2L、MKNK2、MDR1、MRP5 mRNA表达降低,miR-128-3p表达升高,差异有统计学意义(P<0.05)。与紫杉醇+CircASH2L敲低组相比,紫杉醇+CircASH2L敲低+miR-128-3p inhibitor组细胞CircASH2L mRNA表达无明显变化,差异无统计学意义(P>0.05),MKNK2、MDR1、MRP5 mRNA表达升高,miR-128-3p表达降低,差异均有统计学意义(P<0.05),见图7。
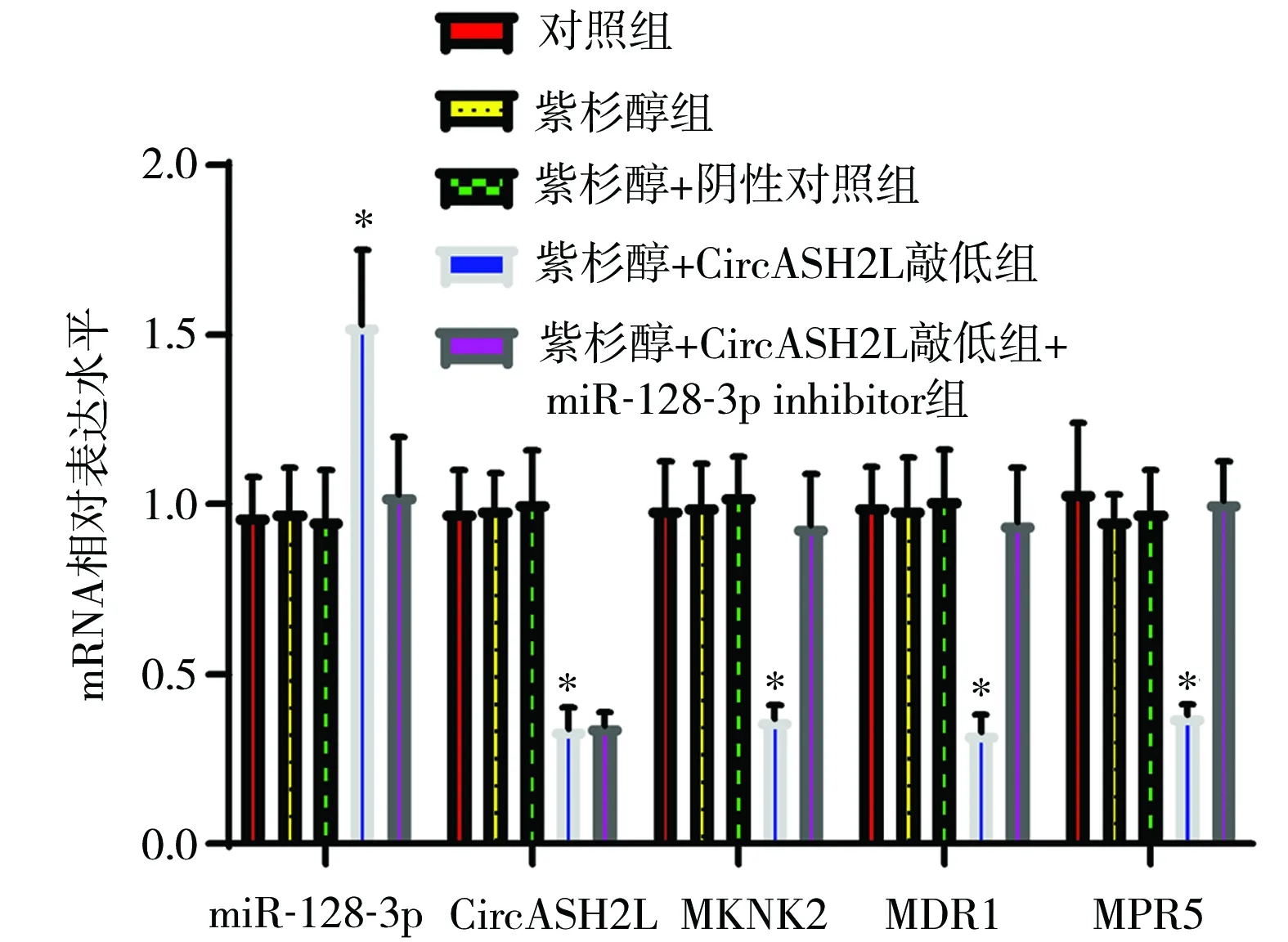
图7 各组细胞miR-128-3p及CircASH2L、MKNK2、MDR1、MRP5 mRNA水平比较
2.6 Western blot法检测细胞中MKNK2与耐药相关蛋白P-gp、MRP5表达 与对照组、紫杉醇组相比,紫杉醇+CircASH2L敲低组细胞MKNK2、P-gp、MRP5蛋白表达降低,差异均有统计学意义(P<0.05)。与紫杉醇+CircASH2L敲低组相比,紫杉醇+CircASH2L敲低+miR-128-3p inhibitor组细胞MKNK2、P-gp、MRP5蛋白表达升高(P<0.05),见图8。
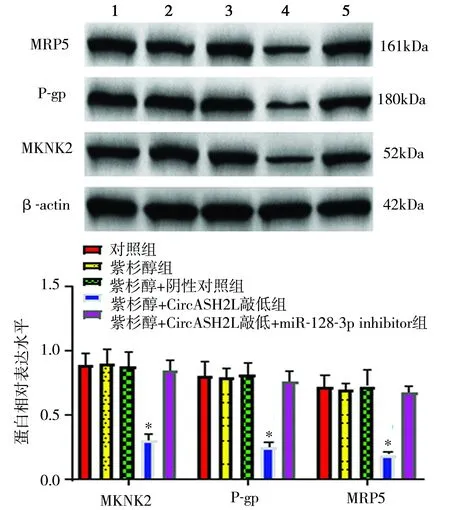
图8 各组细胞MKNK2、P-gp、MRP5蛋白相对表达水平比较
3 讨 论
化疗是晚期卵巢癌患者的主要治疗手段,紫杉醇作为顺铂之后的新一代抗癌药,在卵巢癌临床治疗中得到广泛应用,但耐药性的产生极大减弱了其疗效。尽量减轻卵巢癌的紫杉醇耐药性已成为临床肿瘤研究的重点[3,11-12]。CircASH2L可调控细胞周期、生长、凋亡、迁移和侵袭,敲除CircASH2L基因可触发细胞周期阻滞,抑制成纤维细胞样滑膜细胞增殖、迁移和侵袭,并促进其凋亡[13]。CircASH2L作为一种环状RNA还具有明显致癌活性,能增强胰腺癌和卵巢癌的增殖、侵袭、血管生成和体内成瘤性,延缓两种肿瘤的恶性进展[4-5]。本研究结果显示,相比卵巢癌细胞株SKOV3,其紫杉醇耐药细胞株SKOV3-TR30中CircASH2L表达升高,表明CircASH2L介导卵巢癌细胞紫杉醇耐药过程,以20nmol/L紫杉醇处理SKOV3-TR30细胞,不影响其细胞增殖率及凋亡率,而以CircASH2L siRNA质粒敲低SKOV3-TR30细胞中CircASH2L表达,可降低紫杉醇处理的SKOV3-TR30细胞中耐药基因MDR1、MRP5 mRNA表达及其翻译蛋白P-gp、MRP5表达,并降低细胞增殖率,升高其凋亡率。表明敲低CircASH2L表达可抑制SKOV3-TR30细胞耐药性,增强紫杉醇对其的杀伤力,揭示CircASH2L可促进卵巢癌细胞紫杉醇耐药性产生,敲低其表达可增强其对紫杉醇的敏感性。
通过查询Starbase数据库进行生物信息学分析可推测CircASH2L可能通过下调miR-128-3p调控MKNK2表达。双荧光素酶报告基因实验结果证实CircASH2L可靶向下调SKOV3-TR30细胞中miR-128-3p表达,miR-128-3p可靶向下调SKOV3-TR30细胞中MKNK2表达,且敲低SKOV3-TR30细胞CircASH2L可升高其miR-128-3p表达,降低MKNK2 mRNA及蛋白表达。表明CircASH2L可通过靶向下调miR-128-3p而增强MKNK2表达,从而促使卵巢癌细胞紫杉醇耐药性产生。miR-128-3p是具有抗癌活性的RNA分子,可抑制肿瘤耐药产生,过表达miR-128-3p可抑制胶质母细胞瘤生长并诱导其凋亡,增强其对替莫唑胺的敏感性[14]。miR-128-3p可减轻大肠癌化疗耐药性,增加其细胞内奥沙利铂的积累,在体内外提升大肠癌的化疗效果[15]。上调miR-128-3p可显著抑制卵巢癌细胞增殖和迁移侵袭,并诱导其大量凋亡[8]。MKNK2是调节细胞周期、凋亡和血管生成的蛋白激酶超家族成员,可介导肿瘤的生长、转移和耐药性,抑制其表达可发挥显著抗肿瘤作用,抑制胶质母细胞瘤体内增殖及前列腺癌细胞体外生长、上皮间充质转化和进展[16-17],还能提高前列腺癌患者对恩扎鲁胺的敏感性,减轻其耐药性[18]。阻断MKNK2信号可抑制黑色素瘤从增殖状态到侵袭状态的表型转换,增强抗PD-1免疫疗法敏感性[19],显著减轻卵巢癌化疗耐药细胞的增殖活性和耐药性[11]。本研究结果显示,相比SKOV3细胞,SKOV3-TR30细胞中miR-128-3p表达降低,MKNK2 mRNA表达升高,表明miR-128-3p和MKNK2可介导卵巢癌细胞紫杉醇耐药性的产生;敲低CircASH2L和miR-128-3p,相比仅敲低CircASH2L,紫杉醇处理的SKOV3-TR30细胞中MKNK2及MDR1、MRP5 mRNA表达升高,MKNK2及P-gp、MRP5蛋白表达升高,增殖率增加,凋亡率降低。表明下调miR-128-3p可减弱敲低CircASH2L对MKNK2及耐药相关基因表达的降低作用,拮抗其对紫杉醇杀伤力的增强作用,最终逆转敲低CircASH2L对卵巢癌细胞紫杉醇耐药性的抑制作用,揭示CircASH2L减弱卵巢癌细胞紫杉醇耐药性是通过上调miR-128-3p实现的。
综上所述,CircASH2L在卵巢癌紫杉醇耐药细胞株SKOV3-TR30中高表达,并可通过靶向下调miR-128-3p而升高MKNK2表达,进而促进卵巢癌细胞对紫杉醇产生耐药性,敲低CircASH2L可通过上调miR-128-3p而降低MKNK2表达,从而抑制卵巢癌细胞的紫杉醇耐药性,增强紫杉醇对卵巢癌耐药细胞的杀伤力。本文探索发现了调控卵巢癌细胞紫杉醇耐药性的新型作用靶点和分子机制,有利于减轻卵巢癌临床治疗中的耐药性,改进提升其化疗疗效。

