阴道内乳杆菌与粪肠球菌共培养生长状态及其上清液对阴道加德纳菌抑制作用的体外研究
张晓宇,孙 茜,冯旸子,2,何渊慧,白会会,杜梦瑶,范琳媛,刘朝晖
(1.首都医科大学附属北京妇产医院/北京妇幼保健院妇科,北京 100026;2.首都医科大学,北京 100069;3.首都医科大学附属北京同仁医院妇科,北京 100730)
细菌性阴道病(bacterial vaginosis,BV)是育龄妇女中最常见的阴道感染之一,其特点是厌氧菌的过度生长取代了有益的乳杆菌。由于所涉及微生物的多样性和复杂性,BV的发病机制尚不完全清楚[1]。BV的反复发作与生物膜的存在密切相关,生物膜是一个有协同作用的黏附在生物组织上的细菌结构群。密集、结构化和多微生物的生物膜主要是由阴道加德纳菌(G.vaginalis)群构成的,其黏附在阴道上皮细胞上的巨大能力也促进了其他BV相关厌氧菌的黏附和生长,如阴道阿托巴菌、双路普雷沃菌、羞怯动弯杆菌等[2-3]。
阴道中能产乳酸的微生物称为乳酸菌,而肠球菌属中的粪肠球菌是革兰氏阳性兼性厌氧球菌,作为乳酸菌(lactic acid bacteria,LAB)中的一员,可在健康女性阴道中存在[3-6]。肠球菌菌株会产生抗菌化合物,包括细菌素、过氧化氢,在多项研究中都被作为益生菌抑制病原体的生长、生物膜形成和毒素产生。益生菌通过各种机制发挥作用,如干扰病原体黏附、病原体、毒素受体的降解或其他变化、抑制物质的产生[如细菌素和(或)有机酸]以及刺激免疫。粪肠球菌还可用于预防和治疗某些人类疾病[4-8]。
目前BV的治疗主要为口服或局部应用抗厌氧菌药物,如甲硝唑或克林霉素等。广谱抗菌药物使用后,阴道炎症状虽消失,但阴道内乳杆菌数量仍较少,阴道微生态环境未恢复,对致病菌的抵抗力弱,易引起阴道炎的复发。细菌性阴道病经12个月有效治疗后复发率高达69%,此外过多地使用抗菌药物治疗复发性和难治性阴道炎,将导致耐药性的产生及杀灭阴道内优势乳杆菌[9-10]。乳杆菌是活菌制剂,常规治疗并补充乳杆菌制剂对阴道炎的治疗效果更好,复发率更低。近年来,越来越多的研究表明,粪肠球菌作为一种乳酸菌,能通过产生有机酸、细菌素等代谢产物抑制致病菌生长,可用于肠道菌群失调的防治,并以非炎症方式刺激免疫系统。但目前对于粪肠球菌在阴道的益生作用研究甚少。本研究通过体外研究探究了正常人阴道内乳杆菌与粪肠球菌的比例及乳杆菌与粪肠球菌共培养对加德纳菌生物膜形成的影响。
1 材料与方法
1.1 材料
1.1.1 菌种来源及诊断标准 粪肠球菌采用标准菌株(ATCC-29212)、阴道来源加德纳菌采用Nugent革兰染色评分法作为诊断标准,在首都医科大学妇产医院从临床诊断为BV患者的阴道分泌物标本中分离纯化粪肠球菌和阴道加德纳菌,在妇科阴道微生态评价系统中诊断为菌群异常患者的阴道分泌物标本中分离纯化卷曲乳杆菌,使用16sDNA PCR扩增并鉴定证实。
1.1.2 试剂 牛脑心浸液基础培养基、葡萄糖粉剂、可溶性淀粉、MRS培养基均购自solarbio life science;PBS缓冲液购自Beijing Four-Ring Sunny Bioscience Co.LTD;结晶紫购自Beijing Solarbio Science &Technology Co.LTD;95%酒精购自天津市华东试剂厂。
1.2 方法
1.2.1 乳杆菌、粪肠球菌、阴道加德纳菌培养 乳杆菌与粪肠球菌培养:将卷曲乳杆菌、粪肠球菌分别接种于MRS培养基,培养皿置37℃孵箱培养24h,转种2次后,分别挑取直径1mm左右的乳杆菌菌落和粪肠球菌菌落3~5个,悬浮于1mL改良牛脑心浸液基础培养基BHI培养液(sBHI),调整其浊度达到0.5麦氏标准,使其浓度为1.5×108(CFU)/mL。
阴道加德纳菌培养:将阴道加德纳菌接种于MRS血琼脂培养基,培养皿置于37℃孵箱厌氧培养48h,转种2次,分别挑取直径约1mm,悬浮于1mL改良牛脑心浸液基础培养基BHI培养液(sBHI),调整其浊度达到0.5麦氏标准,使其浓度为1.5×108(CFU)/mL。
1.2.2 乳杆菌与粪肠球菌共培养 将上述培养好的乳杆菌悬液稀释150倍使其浓度为1×106(CFU)/mL,同法将粪肠球菌悬液稀释150和1500倍,使其浓度为1×106(CFU)/mL和1×105(CFU)/mL,然后按一定比例分别加到96孔板,设置3组平行对照,根据试验结果弃去误差较大的数据,1~10孔乳杆菌比粪肠球菌比例分别为3000∶1、2000∶1、1000∶1、500∶1、100∶1、10∶1、1∶1、1∶2、1∶3、1∶4,确保每个孔内总菌量相等。用盐水加乳杆菌、盐水加粪肠球菌作为对照,对照组所加菌量与实验组一致,最终根据实验结果确定乳杆菌与粪肠球菌的比例为2∶1,并应用于以下实验。
1.2.3 乳杆菌与粪肠球菌2∶1比例共培养状态下生长曲线测定 将乳杆菌与粪肠球菌2∶1比例共培养加到96孔板,设置6组平行对照,根据试验结果弃去误差较大的数据,对照组为单乳杆菌和单粪肠球菌,每孔总体积均为200μL,乳杆菌与粪肠球菌浓度均为1×106(CFU)/mL,置37℃孵箱静置培养,分别于培养24、48、72h,将其搅匀后使用酶标仪580nm波长检测不同菌液OD值,比较同一时间乳杆菌、粪肠球菌、乳杆菌与粪肠球菌2∶1比例共培养的菌量差异,以及不同时间菌量的变化趋势。
1.2.4 乳杆菌与粪肠球菌2∶1比例共培养状态下乳酸形成测定 用D-乳酸检测试剂盒(Sigma)和L-乳酸检测试剂盒(Sigma)测定乳杆菌与粪肠球菌2∶1比例共培养所产生的乳酸含量,设置6组平行对照,根据试验结果弃去误差较大的数据,对照组为单乳杆菌和单粪肠球菌,比较乳杆菌与粪肠球菌2∶1比例共培养和单独培养的产酸能力。
1.2.5 乳杆菌与粪肠球菌2∶1比例共培养状态下生物膜形成测定 将乳杆菌与粪肠球菌2∶1比例共培养加到96孔板,设置6组平行对照,根据试验结果弃去误差较大的数据,对照组为单乳杆菌和单粪肠球菌,每孔总体积均为200μL,乳杆菌与粪肠球菌浓度均为1×106(CFU)/mL,置37℃孵箱静置培养,分别于培养24、48、72h弃菌液,PBS漂洗,室温干燥;加0.2%结晶紫染色30min,PBS 漂洗3次,室温干燥;加95%酒精200μL脱色5min,将液体移到新96孔板内。使用酶标仪580nm波长检测混合菌液OD值。以空白组的均值加3倍标准差为临界值(ODc),待检测微孔内OD值小于1ODc,介于1~2ODc,介于2~4ODc,大于4ODc分别代表行成生物膜能力为无、弱、中和强。
1.2.6 乳杆菌与粪肠球菌2∶1比例共培养上清液对加德纳菌及其生物膜的抑制作用 将单乳杆菌与单粪肠球菌分别接种于MRS培养液,乳杆菌于37℃、5%CO2静置培养48h,同法粪肠球菌培养4h,将已培养好的单乳杆菌菌液和单粪肠球菌菌液3000r/min离心10min,取上清,经0.22μm孔径的无菌滤器过滤,收集滤液即为含有乳杆菌、粪肠球菌的上清液。将2∶1乳杆菌与粪肠球菌混合上清与加德纳菌加至96孔板,设置6组平行对照,根据试验结果弃去误差较大的数据,对照组为单加德纳菌、加德纳菌+盐水、加德纳菌+单乳杆菌上清液、加德纳菌+单粪肠球菌上清液及肉汤,37℃、5%CO2静置培养,分别于培养24、36、48h弃菌液,PBS漂洗,室温干燥;加0.2%结晶紫染色30min,PBS漂洗3次,室温干燥;加95%酒精200μL脱色5min,将液体移到新的96孔板。使用酶标仪580nm波长检测洗脱液的OD值。以空白组的均值加3倍标准差为临界值(ODc),待检测微孔内OD值小于1ODc、介于1~2ODc、介于2~4ODc、大于4ODc分别代表形成生物膜能力为无、弱、中和强。
2 结 果
2.1 乳杆菌与粪肠球菌共培养 培养24h:乳杆菌与粪肠球菌比例为100∶1时成膜能力最好,乳杆菌与粪肠球菌比例为1000∶1菌量最多;培养48h:乳杆菌与粪肠球菌比例为3000∶1时成膜能力最好,乳杆菌与粪肠球菌比例为1000∶1、500∶1时菌量最多;培养72h:乳杆菌与粪肠球菌比例为10∶1时成膜能力最好,乳杆菌与粪肠球菌比例为2000∶1、1000∶1时菌量最多。
随着乳杆菌与粪肠球菌比例逐渐降低,这两种菌混合培养后的成膜能力及菌量变化无明显规律,鉴于正常阴道环境中乳杆菌比粪肠球菌多,通过体外研究确定乳杆菌与粪肠球菌合适比例为2∶1,以下实验均以乳杆菌与粪肠球菌2∶1比例进行研究。见表1。
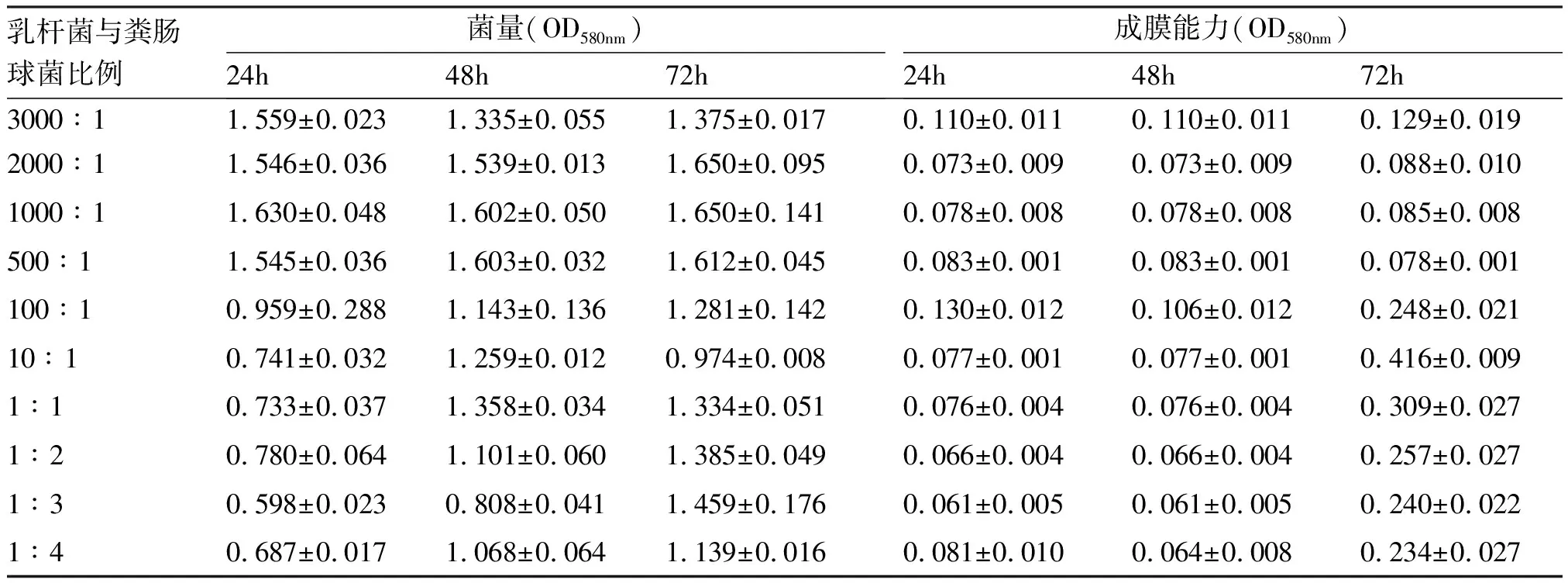
表1 不同比例乳杆菌与粪肠球菌共培养生长曲线及成膜能力
2.2 乳杆菌与粪肠球菌2∶1比例共培养状态下生长曲线测定 24h时2∶1乳杆菌与粪肠球菌共培养的菌量比单乳杆菌和单粪肠球菌少,48、72h时2∶1乳杆菌与粪肠球菌共培养的菌量介于单乳杆菌与单粪肠球菌之间。随着时间增加,2∶1乳杆菌与粪肠球菌共培养后菌量呈上升趋势,但没有单乳杆菌菌量多(P<0.05),表明乳杆菌与粪肠球菌共培养后对细菌的生长无协同作用。见表2。
2.3 乳杆菌与粪肠球菌2∶1比例状态下生物膜形成测定 24h时乳杆菌与粪肠球菌2∶1比例共培养的成膜能力比单乳杆菌和单粪肠球菌差,48、72h时乳杆菌与粪肠球菌2∶1比例共培养的成膜能力比单乳杆菌和单粪肠球菌好。随着时间增加,乳杆菌与粪肠球菌共培养后成膜能力逐渐增强,且比单乳杆菌和单粪肠球菌好,表明乳杆菌与粪肠球菌共培养后对成膜能力有协同作用。见表2。
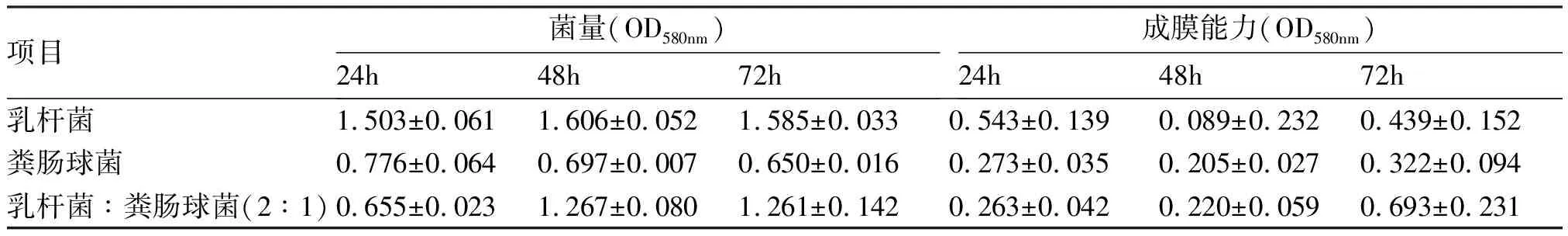
表2 乳杆菌、粪肠球菌、2:1乳杆菌与粪肠球菌共培养生长曲线及成膜能力
2.4 2∶1乳杆菌与粪肠球菌共培养状态下乳酸形成测定 D-乳酸产量:培养24h后乳杆菌、粪肠球菌、2∶1乳杆菌与粪肠球菌共培养为0nmol;L-乳酸产量:2∶1乳杆菌与粪肠球菌共培养为0.487nmol,乳杆菌为0.787nmol,粪肠球菌为0.801nmol。2∶1乳杆菌与粪肠球菌共培养后产L-乳酸比单乳杆菌和单粪肠球菌少,表明乳杆菌与粪肠球菌共培养后产酸能力未增强,可能两者在产乳酸能力方面存在拮抗作用。见表3。
2.5 2∶1乳杆菌与粪肠球菌上清液对加德纳菌及其生物膜的抑制作用 24h时单乳杆菌上清液对加德纳菌成膜能力无明显抑制作用,而单粪肠球菌上清液及2∶1乳杆菌与粪肠球菌共培养的上清液对加德纳菌生物膜形成有明显抑制作用,差异有统计学意义(P<0.05),且2∶1乳杆菌与粪肠球菌共培养的上清液对加德纳菌成膜能力的抑制作用比单粪肠球菌上清液强,见图1。48h和72h时单乳杆菌上清液、单粪肠球菌上清液、2∶1乳杆菌与粪肠球菌共培养上清液对加德纳菌的成膜能力均有很强的抑制作用,差异有统计学意义(P<0.05),且2∶1乳杆菌与粪肠球菌共培养上清液对加德纳菌成膜能力的抑制作用比单乳杆菌和单粪肠球菌上清液强,表明乳杆菌与粪肠球菌共培养后对加德纳菌成膜能力的抑制有协同作用。见图1。

图1 不同条件下加德纳菌成膜能力比较 A:24h时在不同条件下加德纳菌成膜能力比较;B:48h时在不同条件下加德纳菌成膜能力比较; C:72h时在不同条件下加德纳菌成膜能力比较
3 讨 论
3.1 阴道乳杆菌与粪肠球菌可能具有协同作用 健康妇女的阴道菌群以乳杆菌为主,还有一些厌氧菌和兼性厌氧菌,如粪肠球菌等。乳杆菌可通过各种机制抑制机会性致病菌的入侵和定植,如降低阴道pH值、产生生物活性物质、竞争营养物质和黏附部位,以及调节宿主的免疫反应[1-2]。粪肠球菌作为乳酸菌(lactic acid bacteria,LAB)中的一员,可在健康女性阴道中存在,并可产生抗菌化合物,包括细菌素、过氧化氢,在多项研究中都被作为益生菌抑制病原体的生长、生物膜形成和毒素产生[3-6]。作为共生细菌,粪肠球菌可参与营养物质的代谢,以维持其生存环境的pH值,合成对正常功能至关重要的维生素和其他代谢物,防止病原微生物的结合和传播,并对人体免疫系统产生影响[7]。为了探究乳杆菌与粪肠球菌是否具有协同作用,本文通过将乳杆菌与粪肠球菌共同培养来模拟正常阴道的微生态环境。
研究发现[8-15],粪肠球菌作为一种益生菌制剂,能调节人体和动物体内肠道菌群平衡、提高机体基础免疫、降低胆固醇、分解吸收致癌物等有毒有害物质等多种功能特性。除人用和饲料添加用益生菌制剂外,粪肠球菌还有很多其他方面的应用。粪肠球菌作为发酵剂乳酸菌添加到很多种干酪中,能促进干酪成熟并产香、产细菌素,也能在生物保鲜中发挥有益的作用或作为发酵剂的辅剂来提高不同奶酪的感官特性。粪肠球菌在食品及肉类中应用的研究报道也很多,很多食品源性肠球菌具有产生细菌素的能力,能对肉中的病原体和腐败微生物具有抗菌能力,肠球菌素已成为传统化学防腐剂的热门替代选择。在医学上,粪肠球菌被人为地接种于人和动物肠道,预防和治疗人畜肠道疾病和改善动物生长。肠球菌也被用作生产饲料添加剂中的益生菌,以防止腹泻或促进动物生长。粪肠球菌在某些条件下可形成酸性的厌氧环境,在抑制致病菌的同时促进其他益生乳酸菌的存活和生长[16]。
国内对于粪肠球菌在阴道中的益生性研究很少,对于粪肠球菌与乳杆菌共培养的研究更是罕见,且尚未见到粪肠球菌与乳杆菌共同对BV相关微生物影响的研究。一些人认为,益生菌的混合物不仅相互作用或竞争,而且影响彼此的有益效果。表明单独使用某种细菌可产生结果,但将它们放在一起效果可能较差,甚至根本没有效果[16]。本研究发现,乳杆菌与粪肠球菌最适合比例为2∶1,且随着时间增加,乳杆菌与粪肠球菌共培养后成膜能力较单独培养时强,但乳杆菌与粪肠球菌共培养后产酸能力未增强,在营养充足的条件下生长能力也并没有增加。表明乳杆菌与粪肠球菌在成膜能力方面可能存在协同作用,而益生菌生物膜可更稳定地使其成为阴道环境中的优势地位。
3.2 乳杆菌与粪肠球菌对治疗BV是否具有协同作用 BV是一种由阴道微生态菌群失调所导致的疾病,该疾病的特征是乳杆菌减少和厌氧菌过度生长,主要是阴道加德纳菌,其他与BV有关的厌氧菌包括阿托菌、移动菌、普氏杆菌、类杆菌、厌氧球菌、消化链球菌、斯奈西亚菌、瘦体菌和梭菌属等[17-18]。目前,BV的病因尚不完全清楚,但阴道黏膜上厌氧菌生物膜的形成在BV的发病及复发机制中起着重要作用[19-20]。阴道加德纳菌被认为是BV中主要的定殖菌,其生物膜的形成也最强[21]。阴道加德纳菌是一种革兰阴性兼性厌氧的小多形杆菌。阴道加德纳菌具有几种毒力因子,包括生物膜形成、产生细菌素、阴道溶血素、唾液酸酶和蛋白酶[18],其中唾液酸酶和阴道溶血素是研究最广泛的因子。唾液酸酶A基因与BV的发生和生物膜的形成有关。阴道溶血素是一种能形成毛孔的有毒化合物,属于胆固醇依赖细胞溶血素家族,有助于靶细胞的裂解,如阴道上皮细胞[21-22]。与浮游细胞相比,阴道加德纳菌生物膜对两种常见健康阴道分泌物,即乳酸和过氧化氢的耐受性更高,这可能使得阴道加德纳菌和其他与BV相关的微生物免受不利环境的影响[19]。生物膜的形成可降低对抗菌剂的敏感性,促进耐药性发生。已知的生物膜耐药性机制包括抗菌剂的缓慢或不完全渗透,生物膜微环境的生理变化,生物膜细胞的表型变化(类似于孢子形成),生物膜微生物之间的细胞间信号传递,能去除抗菌剂的溶质泵的表达[20,24]。因此,生物膜的形成可能是BV复发的关键,而成功的治疗可能需破坏生物膜。本研究用乳杆菌与粪肠球菌分别传代培养后离心的上清液按2∶1混合来抑制阴道加德纳菌的生物膜形成。结果显示,含有乳杆菌与粪肠球菌代谢产物的混合上清液、单乳杆菌上清液及单粪肠球菌上清液对阴道加德纳菌生物膜形成都有明显抑制作用,差异有统计学意义(P<0.05),且含有乳杆菌与粪肠球菌代谢产物的混合上清液对阴道加德纳菌生物膜的抑制作用比单乳杆菌上清液或单粪肠球菌上清液强,进一步表明乳杆菌与粪肠球菌共培养后对阴道加德纳菌的抑制有协同作用。
本研究中,用乳杆菌与粪肠球菌共培养代替单菌,来模拟正常阴道中的微生态环境,同时探究乳杆菌与粪肠球菌共培养后对BV相关微生物的抑制有无协同作用。本研究是体外实验,还需进行体内实验进一步研究益生菌对BV的治疗作用。

