低级别子宫内膜间质肉瘤的诊治进展
马亚云,张三元 ,倪 妍
(山西医科大学第一医院 山西医科大学附属第九临床医学院 ,太原 030000)
子宫内膜间质肉瘤(endometrial stromal sarcoma,ESS)是来自于子宫内膜结缔组织成分的一种恶性肿瘤。本病最初是在1966年由Nourris和Taylor在Cancer杂志上提出,2020年世界卫生组织(World Health Organization,WHO)根据病理组织学类型将其分为低级别子宫内膜间质肉瘤(low-grade endometrial stromal sarcoma,LG-ESS)和高级别子宫内膜间质肉瘤(high-grade endometrial stromal sarcoma,HG-ESS)。LG-ESS占所有原发性子宫恶性肿瘤的1%[1]。研究显示,雌激素的长期刺激和LG-ESS发生有关,使用雌激素类药物、肥胖、糖尿病、初潮早、绝经迟会增加LG-ESS的发病率。分子遗传学改变也逐渐被发现,最突出的分子遗传改变是染色体重排引起的基因融合,最常见的JAZF1-SUZ12融合,其次是PHF1和JAZF1、EPC1、EPC2和MEAF6的融合,亦有MBTD1-PHF1、EPC1-SUZ12和EPC1-BCOR基因融合,融合基因对于了解癌症机制和开发有用的临床生物标志物和抗癌疗法非常重要[2]。LG-ESS临床表现症状无特异性,具有惰性、激素治疗敏感性等特点,术前误诊率较高,确诊需术后病理及免疫组化甚至分子诊断。本文就LG-ESS最新的研究进展进行综述。
1 分子遗传学改变
1.1 JAZF1-SUZ12 多梳抑制复合体2( polycomb Repressive Complex 2,PRC2)是重要的表观修饰酶,核心亚基包括SUZ12、EED和EZH2。组蛋白H3第27位赖氨酸三甲基化( trimethylated histone H3 at lysine 27,H3K27me3)是最常见的组蛋白甲基化修饰之一,由PRC2产生,PRC2组成部分改变会出现H3K27me3表达失衡,使细胞增殖分化失控,从而引起肿瘤的发生[2]。JAZF1参与LG-ESS、前列腺癌、胃癌和肝细胞癌的进展。Piunti等[3]发现JAZF1是H4复合物核小体乙酰转移酶( H4 complex nucleosome acetyltransferase,NuA4)的新亚基,在LG-ESS中,PRC2亚基SUZ12常与NuA4亚基JAZF1融合,JAZF1-SUZ12融合基因保留了NuA4和PRC2相互作用的能力,但破坏了PRC2成分的稳定性,对PRC2组成、基因组占有率、组蛋白修饰、基因表达和细胞分化具有调控作用,降低了H3K27me3水平。所有发现都支持JAZF1-SUZ12融合基因通过改变PRC2功能引起肿瘤发生,目前没有研究探讨JAZF1-SUZ12融合基因是否改变NuA4复合物功能,但是JAZF1-SUZ12保留与NuA4相互作用的能力,组蛋白乙酰转移酶( histone acetyltransferase,HAT)也是基因表达染色质结构的关键调节因子,NuA4 HAT复合物对转录调控至关重要,因此,NuA4 HAT复合物与LG-ESS发生有无相关性还需进一步研究。
1.2 PHF1 LG-ESS中第二常见的遗传改变涉及染色体带6p21,PHF1基因位于其中,能和JAZF1、EPC1、EPC2和MEAF6多个基因发生融合,PHF1基因编码一个多克隆群蛋白,该蛋白是组蛋白H3-赖氨酸-27( Histone h3-lysine-27,H3K27)特异性甲基转移酶复合物的组成部分之一,PHF1能解读组蛋白翻译后修饰的信息并参与到基因转录调控过程,具有一个TUDOR结构域、两个PHD锌指结构域以及一个扩展的同源性结构域,这些识别结构域使其在表观遗传调控和维持基因组稳定性中发挥重要的作用[4]。PHF1与PRC2之间相互结合,能影响EZH2的甲基转移酶活性,对组蛋白H3K27的甲基化水平和HOX基因的转录抑制产生影响。此外,PHF1通过TUDOR结构域能识别H3K36me3和H3tK27me,N端的PHD锌指结构域识别PRMT5-WDR77所催化的对称性二甲基化H4R3位点,C端PHD结构域能结合DDB1蛋白( H2AK119ub1的催化酶复合物CRL4B的重要组成部分)。PHF1在体内和体外都能促进肿瘤细胞的增殖和转移,发现其表达水平在多种人类肿瘤组织中明显上调。
现在认为融合基因驱动LG-ESS中的肿瘤发生,虽然确切的机制尚不清楚,但特定位点的异常乙酰化过程和(或)甲基化过程被认为是关键因素。LG-ESS中失调的基因中超过50%是SUZ12的直接靶标。这些结果表明LG-ESS的不同重排之间存在共同的致病机制[5]。
2 诊 断
2.1 病理学诊断 LG-ESS肿瘤大小不等,多数直径5~10cm,典型切面为黄褐色(偶因含有大量纤维间质而呈灰白色),鱼肉样,常见出血、坏死和囊变区。可位于黏膜下或肌壁间,位于黏膜下时可见宫腔内息肉样肿块;位于肌壁间时表现为不规则结节,肌壁浸润明显,肌壁内或子宫旁静脉表现为“舌状”肌层浸润或血管内“蠕虫样”瘤栓。显微镜下肿瘤细胞片状生长,胞质稀少,核一致,细胞异型性小,核分裂象少(一般<5个核分裂象/10高倍视野下(high power field,HPF)。Moore等[6]指出一些子宫内膜间质肿瘤在子宫内膜间质结节和LG-ESS之间表现出“混合”特征,该肿物的肌层浸润程度小于LG-ESS,但大于ESN(浸润灶最大直径距离肿瘤边界<3mm,且浸润灶应≤3个),应将这些肿瘤归为LG-ESS。LG-ESS还可表现为广泛的形态学分化,最常见的为LG-ESS伴平滑肌样分化,需注意病理学鉴别。
2.2 组织学诊断 LG-ESS中CD10、雌激素受体( estrogen receptor,ER)以及孕激素受体( progesterone receptor,PR)常呈弥漫性阳性,最新发现的子宫内膜间质标记IFITM1也有表达,Cyclin D1和desmin一般阴性或仅为局灶阳性,而SMA、h-caldesmon一般阴性。ER和PR表达率分别为76%、81.2%[7],CD10在LG-ESS的诊断中较为敏感但特异性不高;当LG-ESS伴平滑肌分化时可表达SMA、Desmin、Caldesmon,LG-ESS中若SMA、Desmin、Caldesmon其中一种阳性率大于30%就可诊断为LG-ESS伴平滑肌分化;当LG-ESS伴性索样分化区可表达Inhibin、Calretinin、Melan-A和CD99。因此相关鉴别中应采用一组而不是单个免疫组化标记。
2.3 分子检测 LG-ESS的分子遗传学逐渐被发现,与病理学和免疫组化相辅相成。对于少数病理学和免疫组化检测难以鉴别确诊者,可通过荧光原位杂交技术( fluorescence in situ hybridization,FISH)或靶向RNA测序检测相关的融合基因。最常见的JAZF1-SUZ12基因融合,其次是PHF1和JAZF1、EPC1、EPC2和MEAF6的融合。MBTD1-PHF1、EPC1-SUZ12和EPC1-BCOR基因融合亦可见。Bai等[8]发现105例LG-ESS患者,其中63例中检测到JAZF1基因改变,总体阳性率为60.6%(63/104)。Brahmi等[9]在一项42例ESS的病例中,35.7%可见JAZF1重排。分子检测虽然对鉴别诊断具有较高价值,但由于费用问题,不推荐所有患者实施,仅推荐某些通过病理学及免疫组化难以明确诊断疑似LG-ESS患者。
3 分期
LG-ESS目前广泛采用2009 年国际妇产科联盟( International Federation of Gynecology and Obstetrics,FIGO)[10]依据肿瘤组织起源、生物学行为及转移情况等特点制定的分期标准。见表1。
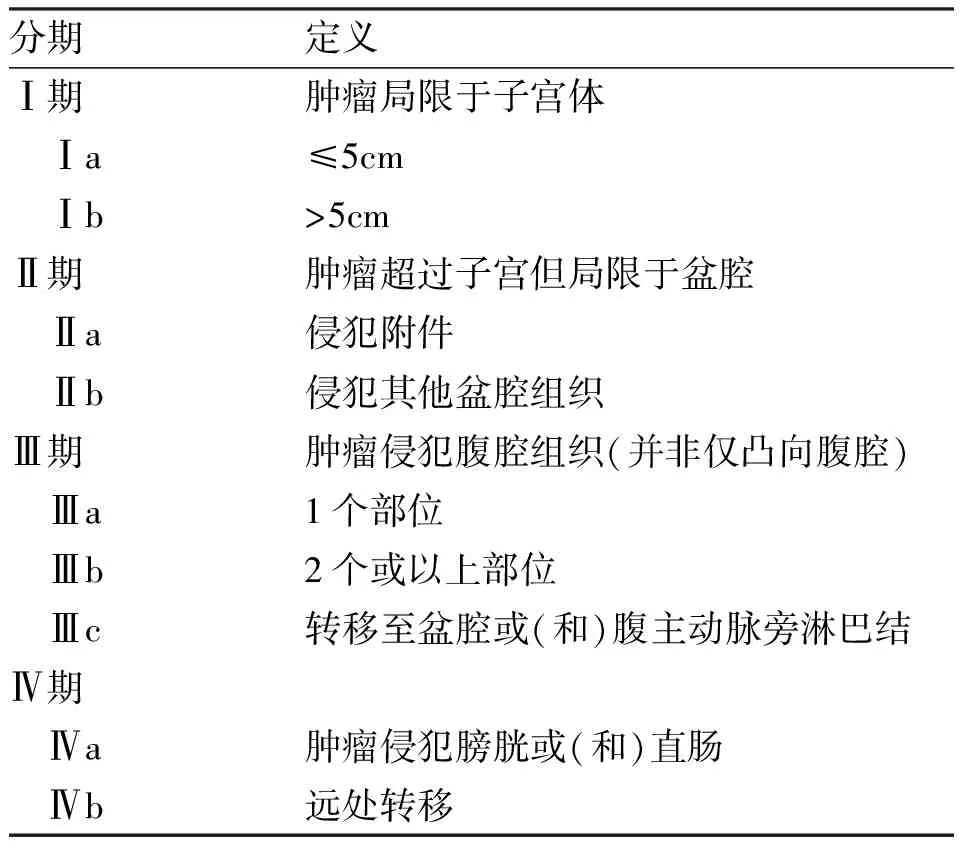
表1 2009年子宫内膜间质肉瘤FIGO分期
4 治疗
4.1 手术治疗
4.1.1 保留生育功能的手术 目前LG-ESS的主要手术方式是全子宫+双侧附件切除术,对于年轻有生育要求的患者,是否可行保留生育能力的手术目前仍存较大争议,《2022NCCN子宫肿瘤临床实践指南》[11]建议对确诊的患者行全子宫±双附件切除术。Dai等[12]报道1例保留生育能力手术的患者术后经多次复发,最后受孕失败。但也有部分患者术后成功受孕,陈明明[13]报道了7例LG-ESS患者,3例有妊娠意愿,均成功受孕,且全部新生儿出生后均未见畸形及发育异常;2例患者分别于产后3月、4月出现复发后,行子宫+双附件切除术;1例行剖宫产术后患者无病生存,并成功妊娠2次,因无生育计划2次均行人工流产术。目前此类报道较少,对于早期、强烈要求保留生育能力的患者应在充分评估疾病、告知患者及家属术后复发风险、受孕率下降等情况下可行保留生育能力手术治疗,初始手术应行边缘清晰完整的肿瘤切除,术后密切随访,一旦出现复发,应立即行全子宫+双侧附件切除术。
4.1.2 保留卵巢 LG-ESS广泛表达ER和PR,双侧卵巢切除术可去除卵巢转移风险,同时消除可能刺激肿瘤生长的内源性激素的产生。《2022NCCN子宫肿瘤临床实践指南》[11]建议ER/PR阳性者需切除双附件。Bai 等[14]报道,保留卵巢患者复发率极高,切除与保留卵巢的复发率分别为15.6% 和72.7%,但总生存率未见明显差异。Nasioudis 等[15]一项meta分析研究681例LG-ESS患者,其中接受双侧输卵管卵巢切除术的490例患者和未接受双侧输卵管卵巢切除术的191例患者的5年总生存率分别为96.2%和97.1%,未见明显差异。因此,保留卵巢会增加LG-ESS患者的术后复发率,但对于总生存期目前无明显差异,对于早期、ER/PR阴性、强烈要求保留卵巢患者可考虑保留卵巢,术后需密切随访。
4.1.3 LG-ESS淋巴清扫 LG-ESS盆腔和腹主动脉旁淋巴结切除术仍存争议,对于Ⅰ期LG-ESS患者,系统淋巴结切除没有足够指征。Zhou等[16]报道,除影像学发现淋巴结异常外,对所有Ⅰ期LG-ESS患者没有必要行淋巴结清扫。在Ⅱ期及以上LG-ESS病例中,盆腔和腹主动脉旁淋巴结转移的风险不可忽略,《2009年FIGO子宫肉瘤诊治指南》[10]将有淋巴结转移的LG-ESS患者分级为Ⅲc期,这提示淋巴结状况对患者预后有显著的不利影响,行淋巴结切除术可提高患者无病生存期。对早期LG-ESS患者没有必要行淋巴结清扫,对晚期、有可疑淋巴结肿大的患者建议术中探查必要时行淋巴结清扫。
4.2 内分泌治疗 LG-ESS是激素敏感性低度恶性肿瘤,对于Ⅰ期患者,术后可随访观察;对于Ⅱ~Ⅳ期患者,术后推荐内分泌治疗[17]。(1)芳香化酶抑制剂:《2022NCCN子宫肿瘤临床实践指南》[11]推荐芳香化酶抑制剂(aromataseinhibitors,AIs)作为LG-ESS的首选内分泌治疗方案。Als(如来曲唑或阿那曲唑等):芳香化酶可催化雄激素转化为雌激素,Als可通过抑制或灭活芳香化酶来降低体内雌激素水平,但Als用药时限尚无定论。德国及奥地利妇产科学会2019版子宫肉瘤指南[18]推荐Als(来曲唑2.5mg/d或阿那曲唑1mg/d),但是否需要使用5年目前尚存在争议。(2)高效孕激素:孕激素与PR结合,抗雌激素活性减少基质子宫内膜增殖。德国及奥地利妇产科学会2019版子宫肉瘤指南推荐醋酸甲羟孕酮(MPA)剂量为200mg/d或250mg/d,醋酸甲地孕酮(MA)剂量为160mg/d,用药时限尚无具体定论。Comert 等[19]研究显示孕激素治疗与复发率低显著相关。地诺孕素可增强p27表达从而抑制细胞周期,但长期大剂量孕激素治疗不仅引起体重增加,也可导致患者出现严重的抑郁症及血栓栓塞[20]。(3)GnRH-a:《2022NCCN子宫肿瘤临床实践指南》[11]将 GnRH-a作为本病术后辅助治疗的其他类推荐。其在绝经前妇女中抑制垂体卵巢轴,目前有少量GnRH-a联合孕激素或Als的报道。由于缺乏大样本研究,暂无明确用药时间推荐。(4)选择性雌激素受体拮抗剂(selective estrogen receptor degraders,SERDs):激素治疗的LG-ESS复发时病灶中可能存在高级别转化。研究显示[21],编码ER的ESR1基因突变导致ER表达减少,从而引起对激素治疗耐药的发生,当对AIs等耐药后,改用选择性雌激素受体拮抗剂(selective estrogen receptor degraders,SERDs)治疗(如氟维司琼)也可达到长期的疾病控制。
4.3 化疗 目前评估化疗在LG-ESS中作用的研究较少,不推荐作为术后的常规辅助治疗,主要用于不能耐受手术的晚期及复发患者的姑息治疗,化疗方案包括吉西他滨/多西紫杉醇、多柔比星/异环磷酰胺、多柔比星/达卡巴嗪等,无最佳化疗方案推荐。Seagle等[22]回顾分析了2414例患有LG-ESS的女性,其中115例LG-ESS(115/2414,4.8%)接受了术后辅助化疗,结果显示辅助化疗对LG-ESS患者预后无明显改善。
4.4 放疗 放疗在LG-ESS中的作用尚有争议,Zhou等[23]回顾分析了114例LG-ESS患者,其中36例患者接受了放射治疗,结果显示辅助放疗对患者DFS无明显影响,辅助放疗在LG-ESS中的临床价值似乎有限。Sampath等[24]分析了国家癌症数据库中351例ESS患者,发现对于接受辅助放疗的患者,5年的局部区域RFS明显高于未接受辅助放疗的患者(P<0.05),但是这些报告没有区分高级和低级ESS。Wang等[25]共纳入152例Ⅰ~Ⅱ期切除LG-ESS患者。40例患者接受辅助放疗,RT剂量小于45Gy,112例患者未接受辅助放疗,结果显示辅助放疗DFS和PFFS有显著改善,未观察到放疗诱导的4~5级毒性,不良反应可耐受。《2022NCCN子宫肿瘤临床实践指南》[11]推荐对于Ⅱ~Ⅳa 期,外照射放疗为2B级证据;对于Ⅳb期,放疗为姑息性治疗。由于目前研究较少,建议权衡利弊,进行个体化治疗,对于Ⅱ~Ⅳ期激素治疗效果欠佳可耐受者,可给予放射治疗。
4.5 靶向治疗
4.5.1 Wnt 信号通路 JAZF1-SUZ12融合是LG-ESS肿瘤中最常见的融合,LG-ESS的基因表达谱显示LG-ESS中失调的基因中有50%是SUZ12的直接靶标,并且多个基因的激活与Wnt信号传导有关。经典的Wnt途径是Wnt/β-catenin途径,即Wnt信号以β-catenin为关键节点调控下游通路,与正常子宫内膜增生组织相比,Wnt/β-catenin信号转导通路在LG-ESS中被激活,该信号转导通路可能参与了LG-ESS的发生和进展[26]。LG-ESS失调基因中还可见SFRP4和SFRP1, SFRP4和SFRP1是Wnt信号通路的调节者。与正常子宫内膜组织相比,SFRP4和SFRP1在LG-ESS中表达下降,提示Wnt信号通路在肿瘤组织中激活[27]。现有证据表明,靶向调控Wnt通路和下游效应子,可能对LG-ESS患者有益。
4.5.2 靶向蛋白质降解 靶向蛋白质降解(targeted protein degradation,TPD) 是一种利用细胞内的泛素-蛋白酶体系统以定向方式降解特定靶蛋白的技术。TPD主要包括蛋白降解靶向嵌合体(proteolysis targeting chimeras,PROTACs)和分子胶两种类型。本综述主要讲述PROTACs,但许多相同的原理同样适用于分子胶。PROTACs是一种异双功能的小分子或多肽化合物,通过连接基团将靶蛋白结合配体与E3泛素连接酶配体利用化学键连接而成,将E3连接酶“募集”到靶蛋白附近,并利用细胞内的泛素-蛋白酶体系统,实现靶蛋白的泛素化标记和蛋白降解。PROTACs具有显著优势,与靶标的结合不需要很高的结合能力、较低的毒性、对靶标更好的选择性等。研究最多的靶标是ER、AR、BTK、ALK、BCR-ABL和BRD4,PROTACs占总数的近30%。 其中有两个靶标(ER和AR)的PROTACs已进入了Ⅱ期临床试验,分别是ARV-110和ARV-471。已经证明PROTACs能有效地降解融合蛋白,如间变性淋巴瘤激酶融合蛋白,并抑制由这些融合蛋白驱动的癌细胞的增殖[28]。最近有研究表明,靶向EED的 PROTACs 是表观遗传调控PRC2的核心亚基,不仅会降解EED,还会降解PRC2复合物的EZH2和SUZ12成分,从而抑制PRC2依赖性癌细胞的增殖[29]。异常融合基因会产生异常融合蛋白,融合蛋白是LG-ESS发展的驱动因素,因此,致病融合蛋白的降解和消除可成为一种有效的治疗策略。
4.5.3 RNA相关药物 既往有文献报道,前列腺细胞中RNA驱动的TMPRSS2-ERG融合,其中嵌合RNA表达以序列依赖性方式诱导基因融合,Gupta等[30]报道子宫内膜细胞类似于前列腺细胞,其中RNA可驱动JAZF1-SUZ12基因融合,细胞内RNA(包含很多lncRNA)与PRC2结合,这些RNA-PRC2对PRC2有调控作用,尽管RNA驱动的机制可能不是导致基因融合的唯一机制,但明确RNA调控PRC2的机制有助于研发RNA相关药物,在基因治疗中具有发展前景,为LG-ESS提供了新的治疗方法。
5 预后和随访
LG-ESS总体预后良好。FIGO分期是主要的预后因素,Ⅰ~Ⅱ期患者5年总生存率超过90%,Ⅲ~Ⅳ期患者5年生存率仅40%~50%,但FIGO分期具有局限性。Ayhan 等[17]报道淋巴脉管受累、肌层侵犯深度、手术切缘阳性及绝经后状态可能对预后有影响,但证据不足,需要专门针对LG-ESS患者的个性化预测模型。Wu等[31]构建了一种Nomogram预后预测模型,但其临床应用价值有待进一步验证。Ki-67是一种增殖生物标志物,其指数高与LG-ESS的复发显著相关。Meng等[32]发现Ki-67指数是其独立预后因素,预测LG-ESS复发的最佳临界值为35%。LG-ESS有晚期复发风险,复发大多数发生于初治后10~20年,建议长期随访。对于Ki-67指数较高的患者,可考虑增加随访频次或适当的辅助治疗。
6 结论与前景
LG-ESS最突出的分子遗传学改变是染色体重排引起的基因融合,融合基因对于了解癌症机制和开发有效的抗癌疗法非常重要,分子诊断可用于某些通过病理学及免疫组化难以明确诊断的疑诊患者。目前分期普遍采用2009年FIGO分期,标准手术治疗方式是全子宫+双侧附件切除术,对于早期、有强烈生育要求的患者,在充分评估疾病、告知患者及家属术后复发风险、受孕率下降等情况下,可行保留生育能力手术治疗,Ⅱ~Ⅳ期患者术后推荐激素治疗,放化疗在LG-ESS患者中效果欠佳,仅作为晚期及复发患者的姑息治疗。基于LG-ESS患者的分子特征,发现了一些潜在的可操作靶点,有助于研发一些新的治疗策略,但仍需进一步深入研究。目前针对LG-ESS 患者的一些个体化预后预测模型已建立,但临床应用价值有待进一步验证。

