O-RADS分类结合CA125、HE4及ROMA在附件肿块中的诊断效能及影响因素*
陈真云,李晓红,李 虹,段传菊,牛洪朋,胡潇莹,李秀敏
(临沂市肿瘤医院妇科,临沂 276000)
恶性附件区肿瘤是常见女性生殖系统恶性肿瘤之一,临床发病率在乳腺癌和宫颈癌之后,但死亡率居首位[1]。附件区肿瘤通常早期没有症状,且缺乏早期筛查方法,很难诊断出临床期别较早的患者。卵巢癌患者5年生存率徘徊在40%左右,近年来,随着手术质量的提高、化疗及靶向治疗的规范应用,5年生存率可提高到50%左右[2-3]。2020年美国放射学会(Amerian College of Radiology,ACR)公布卵巢-附件影像报告和数据系统(ovarian-Adnexal Reporting and Data System,O-RADS)的超声风险分层与管理的专家共识指南,根据病灶结构形态及动态增强曲线,将附件超声所见风险从正常到高度恶性风险的范围分为6类(O-RADS 0~5)[4]。血清学指标糖类抗原125(carbohydrate antigen 125,CA125)、人附睾蛋白4(human epididymis protein 4,HE4)、卵巢风险评估模型(risk of ovarian malignancy algorithm,ROMA)在恶性附件区上皮性癌诊断中是重要参考依据,并在疗效监测中占有重要位置[5]。本研究应用O-RADS分类结合HE4、CA125、ROMA对良恶性附件区肿块进行检查,评价其临床应用价值和诊断效能,以期为临床诊断提供参考,精准指导治疗。
1 资料与方法
1.1 研究对象 选择2020年10月至2022年5月临沂市肿瘤医院院收治的338例附件区肿块患者。患者均进行了O-RADS分类和CA125、HE4检测并计算ROMA指数,行手术治疗并有病理结果。患者年龄7~85岁,平均(48.59±16.40)岁,中位年龄49.50岁。纳入标准:(1)符合该实验设计的统一检测程序;(2)超声分析肿块性质的诊断预测,并报告O-RADS分类;(3)患者均进行CA125、HE4检测并计算ROMA指数;(4)患者均有手术病理结果及免疫组化分析。排除标准:(1)化疗药物干扰;(2)患有其他系统性疾病或原发恶性肿瘤。
1.2 超声检查 患者仰卧位,用彩色多普勒超声诊断仪(美国GELOGIQE8、E9)腹部凸阵探头,频率调整到1~6MHz,并将图像调整到最佳状态,观察附件区肿块的位置、形态、大小、肿块有无包膜及分隔、分隔的厚薄、内部回声、肿块有无乳头状突起及血流信号,观察有无盆腔积液及网膜、腹膜转移灶。转换腔内探头,暴露会阴部,将频率调整至5~9MHz,观察内容同上。
1.3 评价标准 由2名从事妇科肿瘤超声诊断并且经验丰富的高年资主治以上医师对338例附件区肿瘤进行O-RADS分类;附件区病变≥2个并病灶图像特征表现不同时,根据病灶不同特征、不同分类级别,首先分析超声表现较复杂病灶,然后逐级分析其他病灶图像特征,以级别高的作为同一例患者的统计数据;病灶声像图特征表现相似,为同一类别病灶时,则对较大病灶图像特征进行分析。术后病理结果报告证实为低度恶性及交界性时,归为恶性肿瘤统计范畴。
O-RADS分类标准[4,6]:0类,受外界或患者自身因素影响,无法完成检查,不能进行评价;1类(恶性风险0),正常绝经前卵巢,直径≤30mm的卵泡或黄体;2类(恶性风险<1%),几乎可以肯定的良性病变,包括出血性囊肿、子宫内膜异位囊肿(卵巢部位)、系膜囊肿(输卵管部位)和囊壁光滑的非单纯性囊肿等;3类(恶性风险1%~10%),包括O-RADS 2类中囊肿直径≥100mm,任意大小、不规则内壁厚度<3mm的单房囊肿,内壁光滑多房囊肿,直径<100mm,CS(color score)评分1~3分,实性、光滑、任意大小,CS评分1分的病灶;4类(恶性风险10%~50%),肿块直径≥100mm、CS 1~3分或任意大小多房囊肿CS为4分;5类(恶性风险≥50%),高度恶性风险,包括不规则实性病变、CS 3~4级的多房囊实性肿物、乳头状突起≥4个的单房囊肿、腹腔积液和(或)腹膜结节。将O-RADS≤3类判断为良性(阴性),4、5类判断为恶性(阳性)。
1.4 血清学指标检测 清晨空腹采取静脉血约5mL,3500r/min低温离心10min,离心力2390g,分离血清2h内行HE4、CA125检测,并计算ROMA指数。使用仪器型号为CobasE601(罗氏)的电化学发光法(ECLIA)严格按操作规程进行检测。HE4正常参考区间0~140pmol/L,CA125为0~35U/mL,检测结果采用中位数形式进行统计,高于参考值判为恶性。ROMA指数计算[7]:未绝经:PI=-12.0+2.38×LN[HE4]+0.0626×LN[CA125];绝经后:PI=-8.09+1.04×LN[HE4]+0.732×LN[CA125];ROMA值(%)=ePI/[1+ePI]×100%(PI:预测指数,LN:自然对数,e:自然对数底数),计算机自动生成并界定未绝经≥11.4%和绝经≥29.9%为恶性。
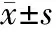
2 结 果
2.1 超声检查及病理结果 338例患者的病灶直径为10~450mm,平均(91.17±55.96)mm,195例病理证实为良性肿块,143例为恶性肿块。O-RADS分类:5类肿块112例,其中102例证实为恶性;4类肿块48例,恶性28例;3类肿块155例,恶性13例;2类肿块23例,均为良性,见表1。
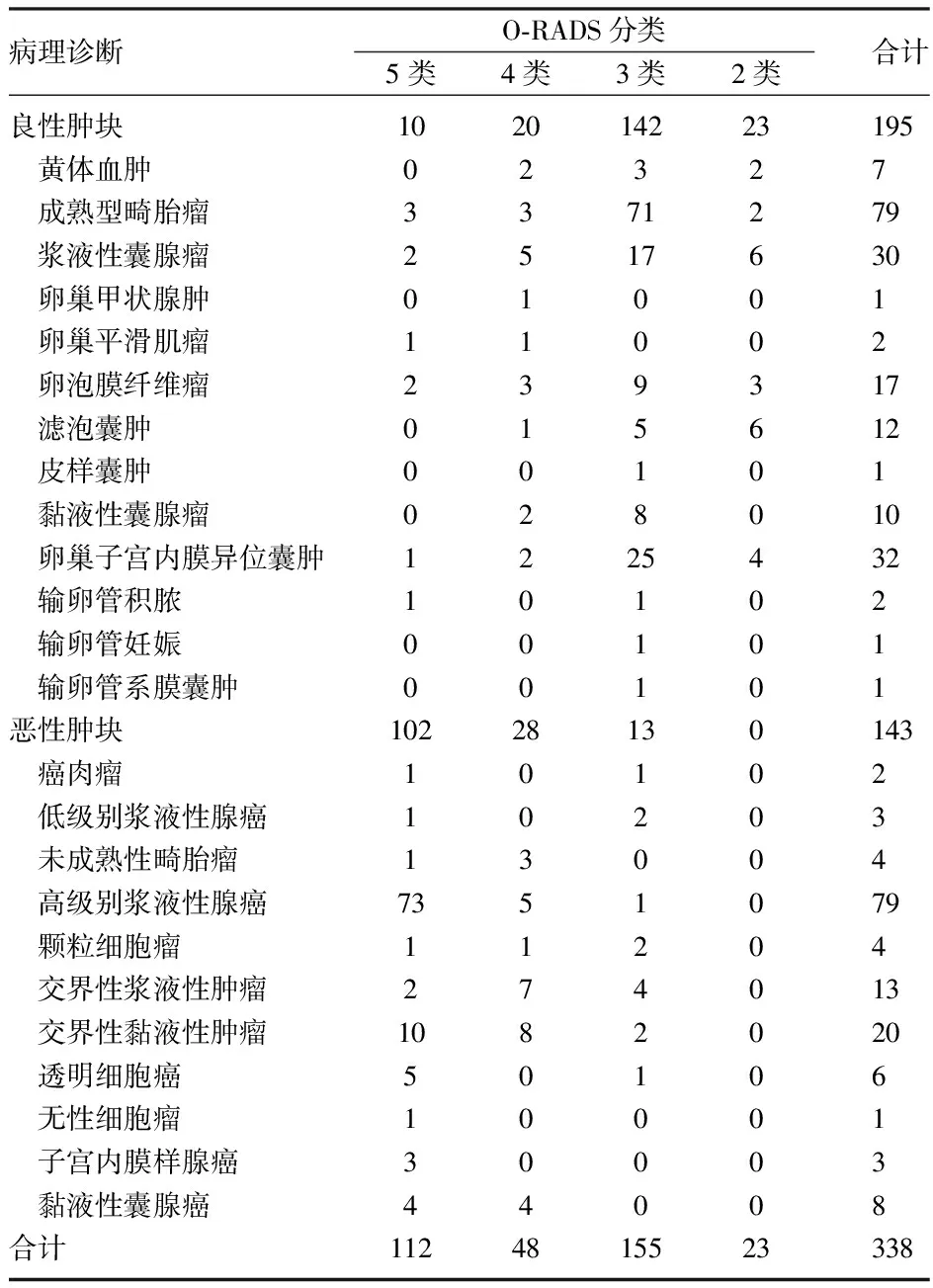
表1 O-RADS分类与病理的对应关系
2.2 超声O-RADS在恶性附件肿块中的检出率 O-RADS 2、3、4、5类恶性肿瘤检出率分别为0.00%(0/0)、8.39%(13/155)、58.33%(28/48)、91.07%(102/112),O-RADS的分类越高其恶性检出率就越高,差异有统计学意义(P<0.001),见表2。
2.3 CA125、HE4、ROMA水平在各附件肿块患者恶性肿瘤检出率 CA125≤35U/mL组恶性附件肿块检出率显著低于CA125>35U/mL组(18.47% vs 74.83%,P<0.001)。HE4≤140pmol/L组的恶性检出率低于HE4>140pmol/L组,两组比较差异有统计学意义(23.81% vs 96.51%,P<0.001)。ROMA指数阴性患者的恶性检出率低于ROMA指数阳性患者,两组比较差异有统计学意义(18.52% vs 84.43%,P<0.001),见表2。
2.4 判断良恶性附件肿块的相关因素 单因素分析显示,患者年龄、O-RADS分类、CA125、HE4检测及ROMA指数对判断附件肿块良恶性有明显相关性(P<0.001),而肿块直径大小对判断附件区肿块良恶性无明显相关性(P>0.05)。见表2。将单因素分析有相关性的因素纳入多因素分析,结果显示,年龄、O-RADS分类、CA125、HE4是影响附件区肿块良恶性判断的独立因素(P均<0.05),超声O-RADS分类具有更高的诊断价值,见表3。
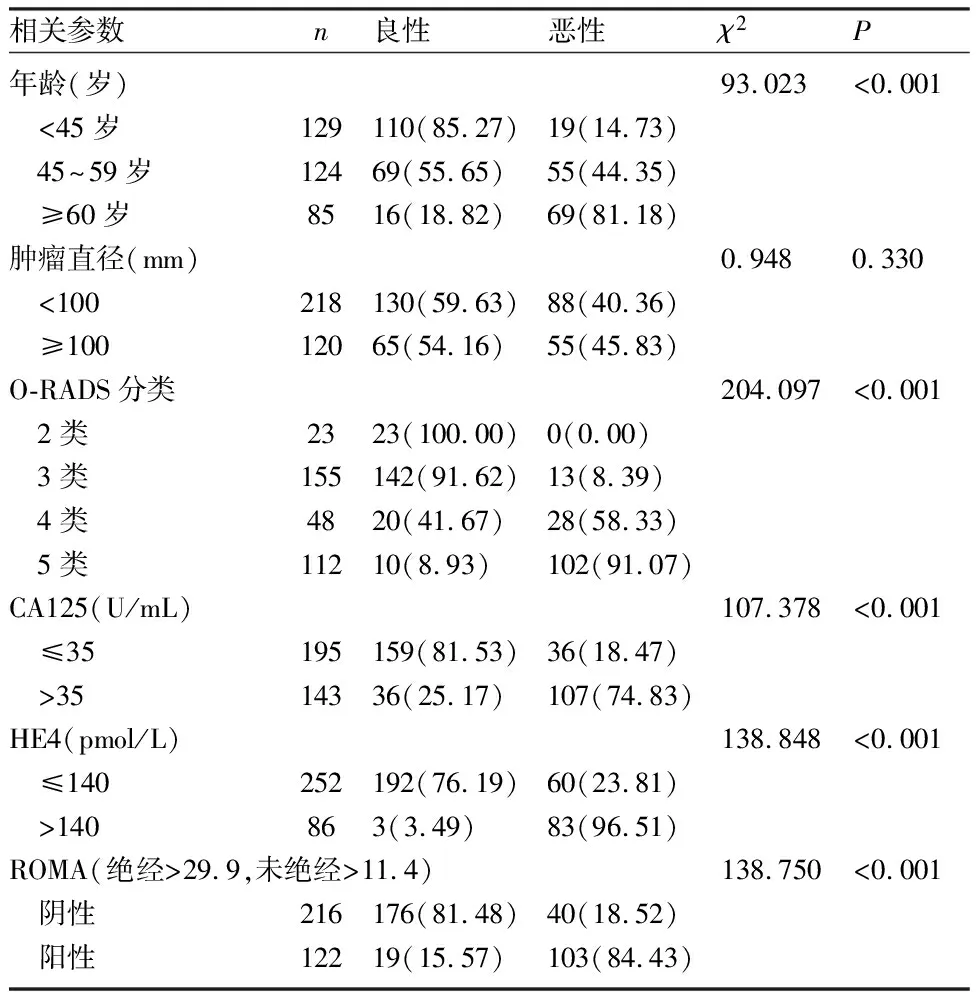
表2 影响338例附件区肿块良恶性诊断的单因素分析结果
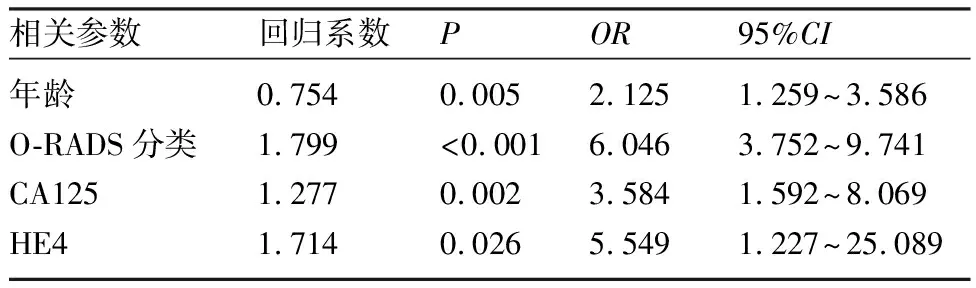
表3 影响338例附件区肿块良恶性诊断的多因素分析结果
2.5 不同组别女性O-RADS分类、血清HE4、CA125水平及ROMA指数在卵巢癌诊断中的效能对比 O-RADS分类、血清CA125、HE4水平、ROMA指数及4项指标的联合检测在恶性附件区肿块组的阳性率明显增高,差异有统计学意义(P<0.001),见表4。
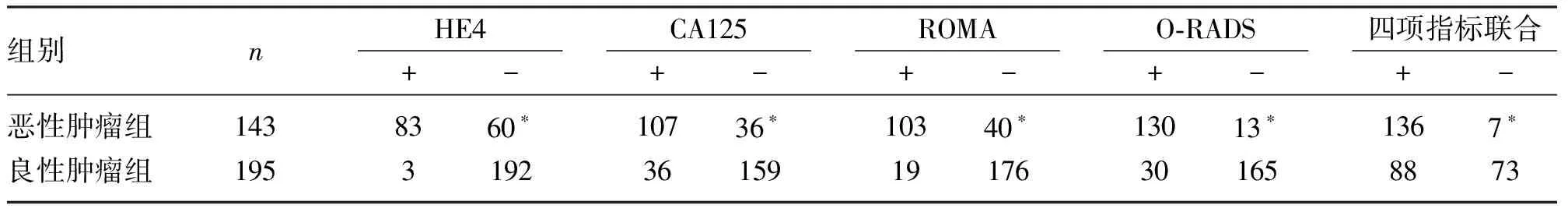
表4 恶性附件区肿块组与良性附件区肿块组女性的检测结果对比(n)
2.6 超声O-RADS分类、CA125、HE4及ROMA指数及四者联合鉴别附件肿块良恶性的ROC曲线 以手术后病理结果为诊断依据,按超声O-RADS分类、CA125、HE4、ROMA指数及4者联合评价附件区肿块的良恶性,绘制ROC曲线,计算曲线下面积分别为0.915(95%CI为0.882~0.947)、0.782(95%CI为0.730~0.834)、0.783(95%CI为0.728~0.837)、0.811(95%CI为0.761~0.862)、0.945(95%CI为0.919~0.970)。提示O-RADS分类、CA125、HE4、ROMA指数及4者联合均能较好地区分附件区肿块的良恶性,但四者联合能更好地判断良恶性,对卵巢附件肿块性质有很好的鉴别诊断作用,见图1。
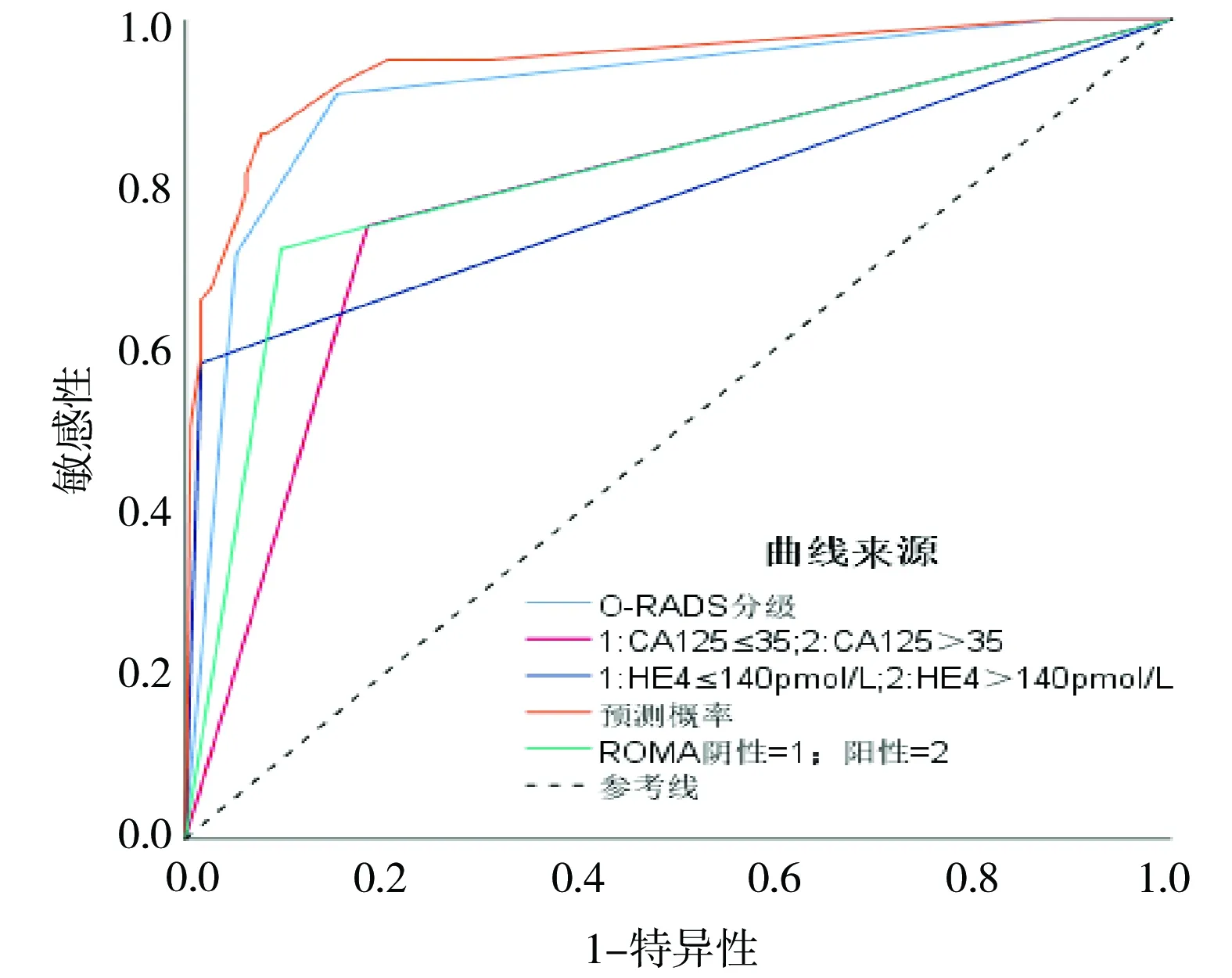
图1 超声O-RADS分类、CA125、HE4、ROMA指数及4者联合鉴别良恶性附件区肿块的ROC曲线
3 讨 论
附件区肿瘤是女性常见恶性生殖器肿瘤之一,晚期恶性附件区肿瘤的死亡率高,附件区癌的高死亡率与其发病位置隐匿有关,一旦发现通常临床期别较晚[8]。据2021年全球癌症数据报告,2020年中国新发卵巢癌55342例,死亡37519例,70%的患者发现时已为晚期[9-10]。因此,重视对附件区肿块的早期筛查和诊断,对提高恶性附件肿块生存率有重要的临床意义。
女性附件区恶性肿瘤筛查是实现早发现、早诊断、早治疗的一项策略,Edward[11]报道了英国附件区肿块筛查合作试验,应用超声和CA125筛查能较早发现卵巢附件区癌,并显著降低死亡率。Kobayashi等[12]报道,对日本无症状绝经后妇女按1∶1随机分为筛查组(TVS联合CA125组)和对照组(未做干预),平均随访9.2年。随访结束后续筛查,筛查组诊断卵巢附件区癌Ⅰ期患者占63%,对照组仅占38%,两组比较差异有统计学意义。附件区肿块首选影像学检查为超声检查,可对附件区肿块做出准确判断,不仅可指导手术时机,减少手术创伤,还可作为术后长期随访的检查方法[13-14]。2008年Timmerman等[15]提出了IOTA简单规则、2009年Amor等[16]提出的妇科影像学报告和数据系统(gynecologic imaging reporting and data system,GI-RADS)等不同附件区肿块的超声分类方法,由于诊断标准不统一、方法各异,均没有统一规范应用于附件肿块分类的诊断。2018年,ACR以白皮书形式在超声征象术语词典的基础提出了O-RADS,O-RADS作为一种新的卵巢附件肿块分类方法,占有非常重要的意义。邱春花等[17]对271例附件区肿块进行O-RADS分级判断,O-RADS 3、4、5分级的恶性肿瘤的检出率分别为1.6%(2/126)、28.7%(27/94)、70.6%(36/51)。
本研究中心分析了338例附件区肿块患者的O-RADS 2、3、4、5类的恶性肿块检出率分别为0.00%(0/0)、8.39%(13/155)、58.33%(28/48)、91.07%(102/112),结果提示与ACR定义的O-RADS 2、3、5分类的恶性风险相符,4类为58.33%,较ACR定义的10%~50%偏高,分析原因和颗粒细胞瘤及交界性肿瘤纳入恶性肿块组相关。对良、恶性附件区肿块患者O-RADS 2、3、4、5类恶性肿块检出率进行比较,恶性组明显增高(χ2=204.097,P<0.001),O-RADS的分类越高其恶性检出率就越高。因此,O-RADS分类是判断附件肿块性质的重要诊断措施,有很高的诊断效能。进一步将O-RADS分类≤3界定为良性,4、5类为恶性,以病理检查结果作为金标准,共有30个良性病灶误判为恶性,其中4类病灶20个,5类病灶10个,可能是由于附件肿块的图像比较复杂,部分特殊类型恶性附件区肿块缺乏特征性超声征象,不易与良性肿块区分[18]。O-RADS的分类对判断附件区肿块的恶变率跨度较大,单纯依靠超声检查存在一定的漏诊和误诊,为了提高卵巢附件区恶性肿瘤的诊断率,减少不必要的手术,联合肿瘤标志物检查明确病灶性质非常有必要。
CA125作为一种高分子量的糖蛋白,可以提示癌细胞DNA扩散的风险,并且其癌细胞内肿瘤信号通路蛋白激酶B和促分裂素原活化蛋白激酶异常表达,通常出现在卵巢上皮性肿瘤中,早期阶段(Ⅰ期)附件区恶性肿瘤50%会升高,晚期卵巢附件区恶性肿瘤高达90%。但子宫内膜异位症、盆腔炎等良性病变患者的血清CA125也高于正常值,单独使用CA125检测会存在假阳性和阴性结果,假阳性结果会导致不必要的手术措施[19]。本研究组单独应用CA125检测,其假阳性率高达25.17%(36/143)。基因组学和蛋白质组学的研究近几年在医学领域中得到飞速发展,HE4作为一种小分子分泌型糖蛋白,是目前较新的生物标记物,在附件区恶性肿瘤患者血清中表达较高[20],本研究组恶性肿块组的假阳性率为3.49%(3/86)。ROMA根据患者月经情况并依据血清CA125和HE4水平,对卵巢癌发生进行有较好的预测功能,本研究组恶性肿块组的假阳性率为15.57%(19/122)。由于肿瘤细胞存在生物学特征的多样性及复杂性,单一肿瘤标志物的准确性比较低,联合检测可以提高诊断的敏感性。邱春花等[21]利用CA125、HE4对O-RADS 4类肿块良恶性进行鉴别,血清CA125、HE4有助于超声O-RADS 4类肿块良恶性的鉴别诊断。本研究组对附件肿块患者进行CA125和HE4检测并计算ROMA指数,恶性组的CA125、HE4及ROMA指数均高于良性组,差异均有统计学意义(P<0.001)。
本研究单因素分析结果显示,年龄、O-RADS分类、CA125、HE4检测及ROMA对判断附件肿块良恶性明显相关(P<0.001),而肿块直径大小对判断附件区肿块良恶性无明显相关性(P>0.05)。多因素分析结果显示,年龄(P=0.005)、O-RADS分类(P<0.001)、CA125(P=0.002)、HE4(P=0.026)是影响附件区肿块良恶性判断的独立因素,O-RADS分类具有更高的诊断价值。
对良恶性肿块的O-RADS分类、血清HE4、CA125水平及ROMA指数及4项指标联合检测的诊断效能进行对比,恶性附件肿块组阳性率明显增高,差异均有统计学意义(P<0.001)。按超声O-RADS分类、CA125、HE4、ROMA指数及4者联合绘制ROC曲线,计算曲线下面积分别为0.915(95%CI为0.882~0.947)、0.782(95%CI为0.730~0.834)、0.783(95%CI为0.728~0.837)、0.811(95%CI为0.761~0.862)、0.945(95%CI为0.919~0.970)。提示O-RADS分类、CA125、HE4、ROMA指数及四者联合均能较好地区分附件区肿块的良恶性,但四者联合能更好地判断良恶性,对附件肿块性质有很好的鉴别诊断作用。
总之,超声O-RADS分类结合HE4、CA125及ROMA检测是附件肿块良恶性判断的重要诊断依据,有较高的临床应用价值及预测效能,可降低漏、误诊率,避免不必要的创伤性治疗,精准指导治疗,值得在临床上推广应用。

