卵巢子宫内膜样腺癌手术后生存时间预测模型建立
张 丽,董冰莹,袁小丽,陈小斌
(1.西安交通大学医学部附属三二〇一医院妇科,汉中 723000;2.浙江大学医学院附属妇产科医院妇科,杭州 310000)
卵巢子宫内膜样腺癌(ovarian endometrioid adenocarcinoma,OEA)是上皮性卵巢癌的一种类型,约占上皮性卵巢癌的16%~25%[1-2]。OEA患者的早期临床表现主要为下腹部包块、下腹痛、腹胀、绝经后出血等,缺乏特异性临床表现及诊断方法[3-4],因此确诊时往往已发展到晚期,且预后不良。目前,临床上缺乏对OEA患者手术后可视化预后模型的建立。列线图模型,也称Nomogram模型,可将多个定量、定性变量综合起来,通过绘图法预测特定事件发生概率的模型,能直观地对个体患者进行风险预后评估,近些年广泛运用于临床。本研究选取美国国立癌症研究所监测、流行病学和结果(The Surveillance,Epidemiology,and End Results,SEER)数据库中的OEA患者,采用Cox回归分析得出独立危险因素,构建OEA患者手术后生存预后Nomogram模型,为其临床预后分析提供有力的证据。
1 资料与方法
1.1 资料来源 SEER数据库收集了美国部分州县百万余例恶性肿瘤患者的信息,包括发病情况、治疗情况、预后及死亡等。采用SEER*Stat软件回顾分析2468例OEA患者。纳入标准:2010年至2015年行手术治疗的原发性卵巢肿瘤;病理组织ICD-O-3分型为8380-3(子宫内膜样腺癌)。排除标准:1个月内手术死亡;原位癌;随访信息及分期信息不完整。
1.2 研究方法 选取OEA手术后患者的结局因素,包括生存时间和生存状态,纳入相应影响因素,包括年龄、种族、组织学分级、T分期、N分期、M分期。组织分级包括:高分化(G1)、中分化(G2)、低分化(G3)、未分化(G4)。TNM分期采用美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第7版。采用Cox比例风险回归模型进行多因素分析,得出影响OEA患者术后预后生存的独立因素。将2468例OEA患者分成测试组和训练组进行内部验证,测试组与训练组例数比值为3∶2。选取独立危险因素构建Nomogram模型以预测3年和5年生存率,并采用受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)评估该Nomogram模型的预测能力;校准曲线评估该Nomogram模型预测值与实际值之间的一致性。
1.3 统计学处理 使用R语言统计软件,构建Cox比例风险回归模型,采用R语言中“foreign包、survival包、caret包”将总例数分成测试组及训练组进行验证,绘制Nomogram模型,并采用ROC曲线检验其预测能力、校准曲线检验其校准度。P<0.05为差异有统计学意义。
2 结 果
2.1 Cox比例风险回归模型结果 年龄、组织学分级、T分期、M分期(M1)是OEA患者手术后预后的独立危险因素,通过测试组(1484例)和训练组(984例)进行内部验证,得出的独立危险因素与总体例数相符,因此可用于Nomogram模型的建立。种族及N分期不是预后的独立因素;其中年龄≥80岁的HR值达到3以上;组织学分级中未分化HR值达到3以上;T分期中T3的HR值达到3以上(表1)。
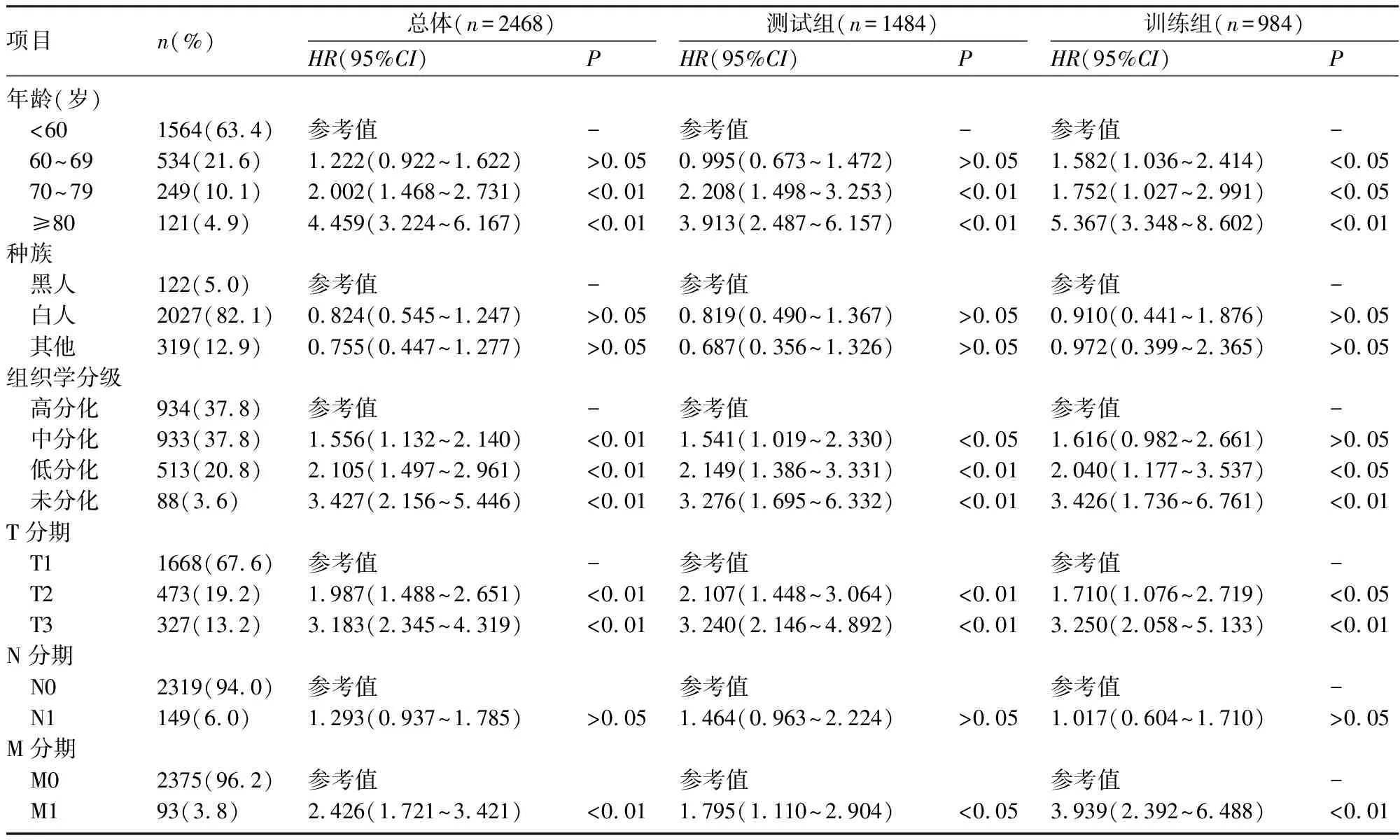
表1 OEA术后生存时间Cox回归结果
2.2 预测3年和5年生存率Nomogram模型构建 对上述纳入影响因素进行赋值,其中变化最大因素(年龄)赋值为100分,再利用R语言软件绘制Nomogram模型,得到每个研究对象单项指标所对应的分数。将每项指标分数求和,得到总分值,进而找到对应患者预后3年和5年的生存率(图1)。在Nomogram模型中,发现随着年龄增加,其赋值分数越高;组织学分级中,低分化赋值分数最高;T分期中,T3赋值分数最高;M分期中,M1赋值分数最高。如OEA患者手术后信息:年龄65岁(15分),亚洲人(0分),病理组织学分级提示为未分化(83分),T分期为T2(47分),N分期为N1期(0分),M分期为M0(0分),得到总分值为145分,则该患者预后3年生存率为70%~80%,5年生存率为60%~70%(图1)。
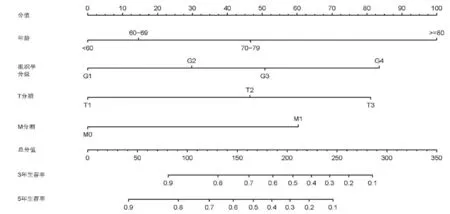
图1 3年和5年术后生存率预测模型的Nomogram图
2.3 预测3年和5年生存率Nomogram模型的验证 采用R语言建立ROC曲线,3年生存率的Nomogram模型曲线下面积(area under the curve,AUC)为0.801>0.70,5年生存率的Nomogram模型AUC为0.780>0.70,表明该模型的区分度较好(图2)。采用R语言构建校准图,发现3年和5年生存率的Nomogram模型曲线图中的预测值与实际值一致,两预测模型具有较好的校准能力(图3)。
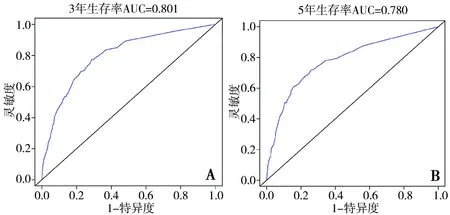
图2 3年和5年生存率Nomogram模型的ROC曲线

图3 3年和5年生存率Nomogram模型校准曲线
3 讨 论
OEA目前是仅次于浆液性和黏液性类型的第三种最常见恶性卵巢上皮肿瘤[5]。目前发病机制尚存争议,有研究表明,30%~40%的EMs患者与OEA存在着一定的关联性,仅0.7%~1% EMs患者恶性转化为OEA[5-7]。研究表明,卵巢蛋白基因异常表达及信号通路异常导致OEA发生[8-10],但具体机制仍不明确。临床上,手术治疗是OEA首选治疗方式[11-12]。晚期OEA患者化疗的耐药性较强,效果不明显,预后差[13],尽早手术治疗是改善预后的主要治疗方式。临床上缺乏有效的可视化模型了解其手术后的生存预后情况。本文通过回顾分析SEER数据库中OEA患者的高危预后影响因素,构建预测模型,为临床手术治疗预后提供有效的指导。
本研究结果显示,年龄、组织学分级、T分期、M分期是影响OEA患者生存预后的独立危险因素。随着年龄增加,OEA患者不良生存预后风险增加,尤其年龄在80岁以上。但有个例报道年轻患者合并EMs时易发生OEA[7,14]。不同人种的生存预后未见明显差异。组织学分级中,OEA患者组织学分级越差,其预后越差。研究表明,卵巢上皮性肿瘤的临床分期越晚,生存率越差[15]。本研究结果显示,OEA患者癌细胞转移至淋巴结与其预后生存无明显差异。而淋巴转移是子宫内膜癌影响其生存预后的独立危险因素[16]。OEA癌细胞转移至盆腔和(或)盆腔外腹膜转移,其不良预后风险增加。OEA患者合并有远处转移,如胸水有癌细胞、肝实质有癌细胞转移时,其生存预后越差。通过测试组和训练组进行内部验证,进一步确定年龄、组织学分级、T分期、M分期是影响其生存预后的独立危险因素。
目前Nomogram模型广泛应用于临床患者风险预后的评估,如胰腺癌、结直肠癌、乳腺癌等研究[17-19],具有个体化指导价值。本研究将以上独立危险因素,建立Nomogram模型,可得到预测OEA患者手术后的3年和5年生存率。在Nomogram模型中,通过总分值可个体化显示患者术后的3年和5年生存率,具有重要临床参考价值。采用ROC曲线及校准图评估两模型的实用性,发现预测模型构建满意,可用于临床手术患者生存预后的初步评估,具有更重要的临床意义。
综上所述,建立有效的OEA患者预测模型可为临床手术决策提供可视化依据,有利于医患沟通及临床诊治。但本研究仍有不足之处,未纳入OEA患者的化疗信息进行分析,同时未纳入国内数据进行外部验证,可能造成结果误差。因此,还需大样本临床病例进行前瞻性研究,为临床手术治疗后生存预后评估提供更多的依据。

