基于CRISPR/Cas9技术构建SIRT6基因敲除的A549肺腺癌细胞系
吴龙俊云,赵立峰,兰翼君,赵雯莉,杨波,李也鹏
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院,广西 百色 533000;3. 右江民族医学院,广西 百色 533000)
肺癌的发病率和死亡率在恶性肿瘤中高居首位,并有继续上升的趋势[1]。其中非小细胞肺癌在肺癌中占有很大的比重,达到80%~85%,而作为非小细胞肺癌最常见的病理类型,肺腺癌近年来发病率持续上升,早期即可出现远处转移,大部分患者在就诊时已是中晚期,预后很差[2-3]。因此,探索肺腺癌新的分子靶点,为肺腺癌患者制定新的治疗策略至关重要。作为人肺腺癌上皮细胞系的一员,A549细胞与Ⅱ型肺泡细胞非常相似,包括形态、结构和代谢产物组成。因此,A549 细胞被广泛应用于模拟Ⅱ型肺泡细胞反应的研究[4-6]。Sirtuin家族是烟酰胺腺嘌呤二核苷酸依赖性酶家族。已有研究表明,Sirtuin家族成员具有去乙酰化修饰多种蛋白的功能,因此其能够调控基因转录,参与细胞基因组稳定性、分化、衰老、凋亡、新陈代谢等多种重要的病理、生理过程,进而影响多种肿瘤的形成和发展过程[7-8]。Sirtuin 6(SIRT6)是Sirtuin家族成员之一,具有调控基因转录、新陈代谢、端粒的完整性和维护基因组稳定性的作用,在糖尿病、肥胖、心脏病、衰老和肿瘤的发生发展过程中扮演十分重要的角色[9]。CRISPR/Cas9是一种精准高效的新型编辑技术,Cas9可以对靶基因组进行剪切,形成 DNA 的双链断裂,DNA修复过程中实现造成移码突变,使靶标基因失去功能,从而实现基因敲除[10]。本实验通过CRISPR/Cas9系统,借助慢病毒载体构建SIRT6基因敲除的人肺腺癌A549细胞株,将为更深入探索SIRT6在肺腺癌的功能机制提供基础条件。
1 材料与方法
1.1生物材料 人肺腺癌细胞A549,1640培养基(biosharp)、DMEM 培养基(biosharp)、慢病毒(上海吉凯基因医学科技股份有限公司)、Polybrene(上海吉凯基因医学科技股份有限公司)、Primer(上海吉凯基因医学科技股份有限公司)、Oligo引物(上海吉凯基因医学科技股份有限公司)。
1.2主要试剂 胎牛血清(biocell)、嘌呤霉素、胰酶、SIRT6抗体、DNA试剂盒、PDVF膜、lip3000。
1.3主要仪器 低速离心机(安徽中科中佳科学仪器有限公司)、化学发光成像系统(杭州申花科技有限公司)、37 ℃恒温培养箱(Thermo)、转膜系统(Bio-rad)、电泳仪(Bio-rad)、倒置显微镜(Leica 公司)、PCR仪器(Biometra)、酶标仪(SpectraMax/iD5)。
1.4实验方法
1.4.1设计靶点的sgRNA序列 利用CRISPR-Cas9靶点制作原理,设计3种不同并符合实验要求的sgRNA-SIRT6序列(sgRNA-SIRT6-27、sgRNA-SIRT6-28、sgRNA-SIRT6-29),见表1。以设计的sgRNA序列为模板,在模板链的5′端添加碱基CACCg,互补链的3′端补加碱基C,5′端添加碱基aaac,确保3种sgRNA-SIRT6都能与BbsⅠ酶切后的SIRT6质粒形成的黏性末端互补,设计的寡核苷酸链合成序列,见表2 。SIRT6单链DNA Oligo由上海吉凯基因医学科技股份有限公司设计及合成。
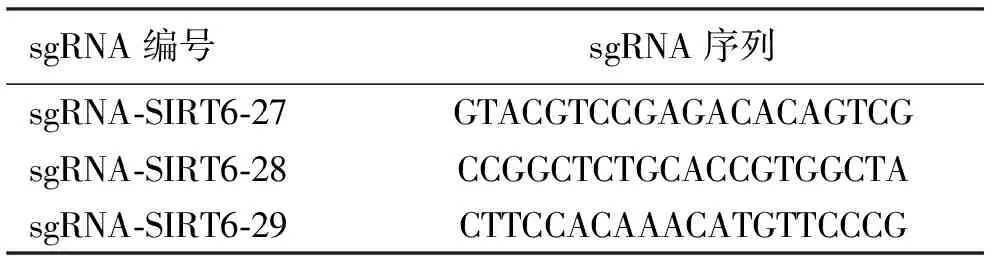
表1 sgRNA序列
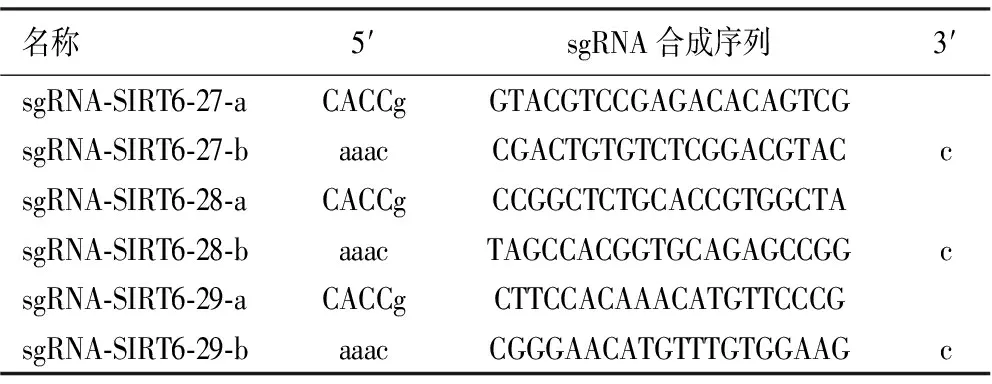
表2 sgRNA oligo序列
1.4.2重组质粒的构建与鉴定 利用合成的sgRNA-SIRT6 Oligo经梯度降温PCR退火形成双链sgRNA。95 ℃水浴15 min,然后冷却至室温,经梯度降温PCR退火形成带黏性末端的双链sgRNA,将退火产物稀释200倍使用。由限制性内切酶BsmBI酶切载体质粒,取Vector plasmid 1 μL,10X Buffer Tango 2 μL,DTT (20 mM)1 μL,BsmBI 1 μL,加ddH2O补至20 μL,经过37 ℃酶切3 h得到线性化载体DNA,通过琼脂糖凝胶电泳回收。取线性化的载体DNA 50 ng/μL,退火的双链 DNA 0.5 μL,10×T4 Buffer 1 μL,EG4000 1 μL,T4 DNA Ligase 1 μL,加ddH2O补至10 μL,16 ℃连接3 h获得酶切连接产物。将酶切连接产物转至大肠杆菌TOP10感受态菌体内,将其均匀地涂布在含氨苄西林(Amp)的固态培养基上,24 h后挑取单菌落进行PCR鉴定,得到阳性克隆后测序,得到序列正确的表达sgRNA的过表达慢病毒质粒。扩增序列正确的克隆菌液,用中小量质粒提取试剂盒[天根生化科技(北京)有限公司]提取质粒,送检测序。
1.4.3sgRNA-SIRT6慢病毒包装 用胰蛋白酶消化对数生长期的293T细胞,以含10%胎牛血清的DMEM培养基调整细胞密度约5.0×106细胞/15 mL,接种于10 cm细胞培养皿,37 ℃、5% CO2培养箱内培养24 h,待细胞密度达70%~80%时,取SIRT6-sgRNA重组质粒DNA溶液16 μg和25 μL Lenti-Easy Packaging Mix与相应体积的Opti-MEM混合均匀,总体积为1.5 mL,室温下温育15 min,将混合液滴加入至293T细胞培养液中,于37 ℃、5%CO2培养箱内培养,孵育6 h后弃去含有转染混和物的培养基,缓慢加入含10%胎牛血清的DMEM细胞培养基 20 mL,于 37 ℃、含5% CO2培养箱内继续培养48~72 h。收集转染后48 h的293T细胞上清液;离心,加入病毒保存液,轻轻反复吹打重悬;离心后取上清液获得病毒溶液,行滴度测试。
1.4.4sgRNA-SIRT6慢病毒感染细胞及稳转株筛选 将A549种于6孔板中,细胞量为105。24 h后更换培养基并加入慢病毒进行感染,设置阴性对照,6孔板终体积为2 mL,继续培养48 h。加入嘌呤霉素筛选细胞,待阴性对照细胞死完,转移细胞到6 cm皿继续筛选。取上述少量细胞,DNA提取试剂盒提取DNA并测序,测序引物见表3。细胞正常胰酶消化,吹打成单细胞,移入96,24/6孔板继续培养,并收取蛋白。
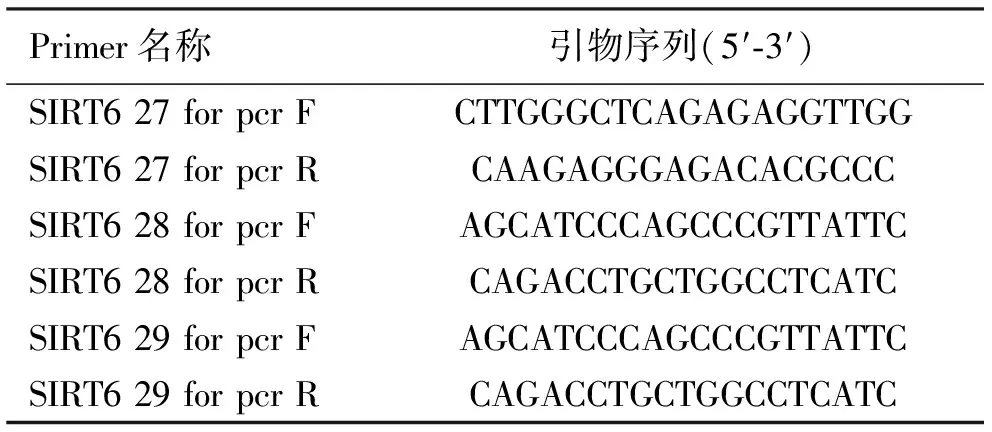
表3 Real-time PCR引物列表
1.4.5单克隆细胞培养 细胞正常胰酶消化,200×g离心5 min后,吹打成单细胞,计数50个细胞,并将细胞加入到10 mL培养基中,吹打均匀,96孔板每孔加入100 μL细胞悬液,使每孔细胞0.5个左右。24 h后观察细胞贴壁情况及形态,在单克隆孔中补加100 μL培养基。细胞长满96孔板按此程序:经传代到24孔板,6孔板到扩大培养,并收取蛋白样品做WB,冻存细胞。
1.4.6Western Blot检测细胞SIRT6蛋白表达 选取对照A549细胞与过表达的A549细胞,培养24 h后,PBS清洗后用RIPA裂解液提取细胞总蛋白并用BCA法进行蛋白定量,每个样各取50 μg总蛋白进行SDS-PAGE 电泳,电泳后转至 PVDF 膜,湿转120 min,5%BSA 摇床封闭1 h。一抗、二抗孵育,加入曝光底物进行曝光。以GAPDH为内参,检测SIRT6蛋白的表达水平。
2 结果
2.1基因敲除表达载体的鉴定 重组质粒基因测序结果显示在酶切位点之间插入的片段位置、方向及序列分别与3个sgRNA(sgRNA-SIRT6-27、sgRNA-SIRT6-28、sgRNA-SIRT6-29)序列一致,靶向 SIRT6基因的sgRNA序列成功插入载体 ,证明过表达重组质粒构建成功。见图1。
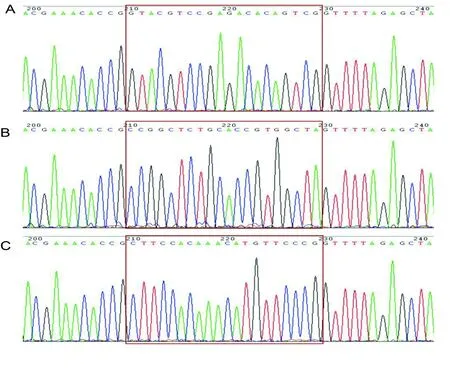
注:A.质粒sgRNA-SIRT6-27;B.质粒sgRNA-SIRT6-28;C.质粒sgRNA-SIRT6-29。
2.2SIRT6敲除的人肺腺癌A549细胞DNA测序鉴定 嘌呤霉素筛选慢病毒感染后细胞,进行单克隆培养,提取细胞基因组DNA,并对3个单克隆(SIRT6-27、SIRT6-28、SIRT6-29)进行PCR和测序验证。测序结果表明3个单克隆扩增的PCR片段大小约为400 bp左右,SIRT6-27和SIRT6-29扩增的PCR片段与原始序列相比,未见碱基改变,而SIRT6-28的PCR片段有明显的碱基突变,而且峰图显示突变点处出现套峰。见图2。
2.3SIRT6基因敲除后A549细胞内SIRT6蛋白表达 将成功敲除SIRT6基因的A549细胞进行单克隆培养,收取蛋白进行Western Blot检测SIRT6蛋白表达,以未感染的A549细胞系作为对照,Western Blot显示经SIRT6基因敲除后的A549细胞内SIRT6蛋白不表达,说明 SIRT6基因敲除成功,见图3。
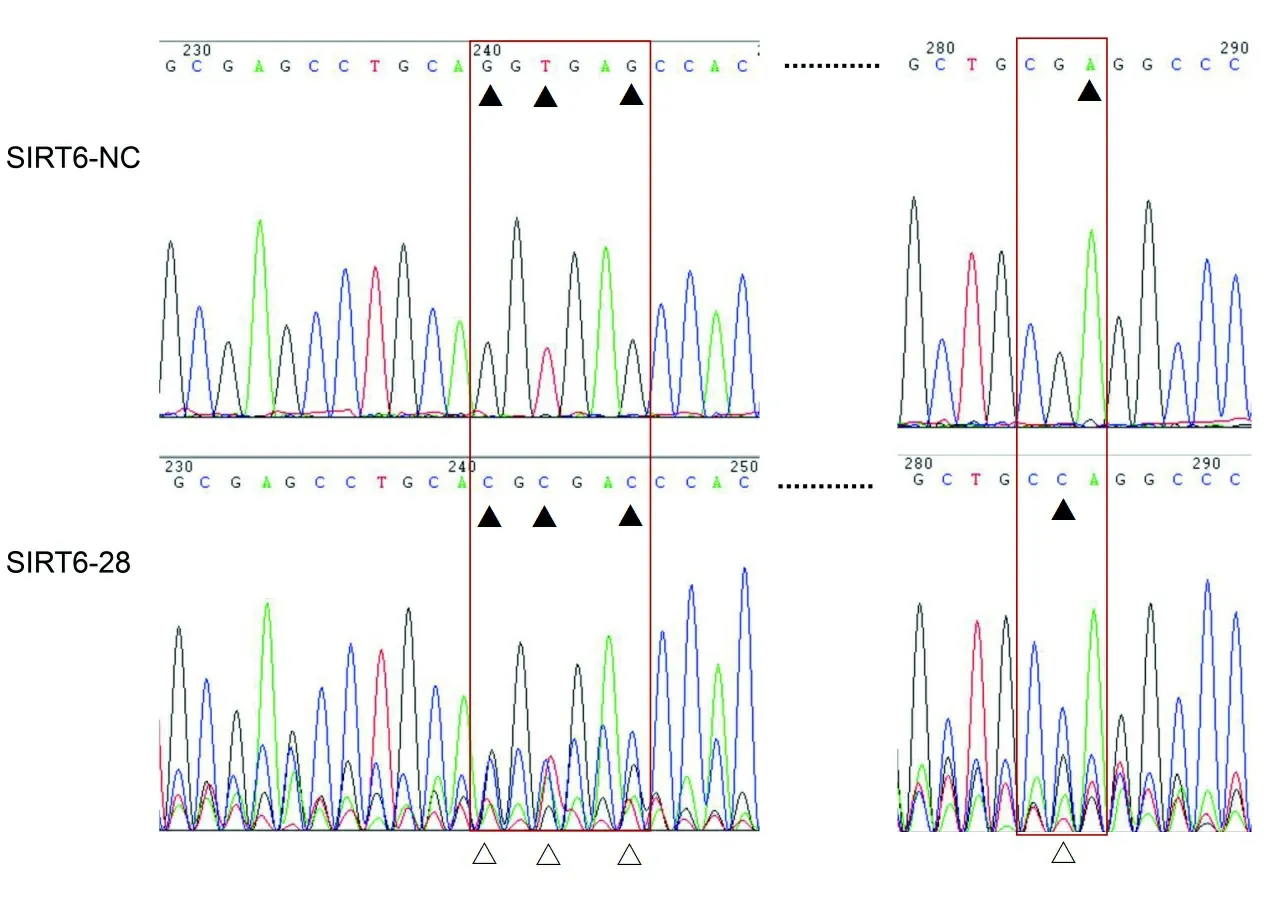
注:SIRT6-28测序结果与原基因序列比对分析,“▲”表示突变的碱基;“△”表示峰图出现套峰。
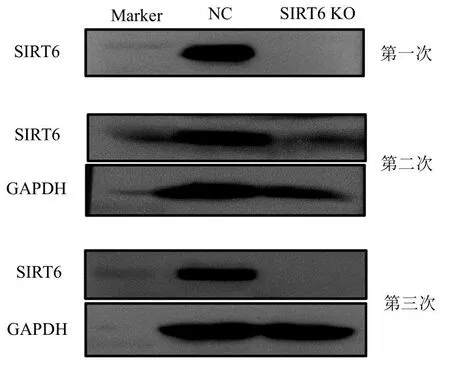
注:蛋白在第一次和第二次背景杂带多,第三次WB结果正常。
3 讨论
SIRT6是一种同时具有单ADP核糖基转移酶、脱脂酰化酶和去乙酰化酶的多功能蛋白质,这三种酶促特性构成了SIRT6调节各种生理和病理过程的能力的基础[11]。SIRT6可以通过调控人体诸多病理、生理过程,从而影响肿瘤的发生和发展[10]。一些研究认为,SIRT6是一种抑癌基因。一项在膀胱癌的研究发现,T4分期与T2相比,SIRT6的表达明显降低,低SIRT6表达增加H3K9的乙酰化以及Glut1和PDK1的水平,增强糖酵解,并增加肿瘤细胞的增殖能力[12]。在鼻咽癌中,SIRT6过表达导致抗凋亡蛋白Bcl-2的水平降低,但增加裂解的半胱天冬酶-3和促凋亡蛋白Bax的水平。高水平的SIRT6抑制NF-κB信号传导并促进鼻咽癌细胞的凋亡[13],而SIRT6在人胶质瘤中也被认为是一种抗癌基因[14]。然而,在某些恶性肿瘤中,SIRT6被证实是一种促癌基因。在骨肉瘤中,SIRT6表达上调增加了肿瘤的复发风险和死亡风险,是骨肉瘤患者预后不良因素[15]。而在甲状腺癌的研究也显示,SIRT6上调与甲状腺癌患者的无复发生存期差以及体外PTC细胞迁移和侵袭增强有关[16]。且SIRT6除了在不同肿瘤中发挥不同的作用以外,还可以在同一种肿瘤中发挥双重作用。有研究表明,在结肠癌、肝癌、乳腺癌、胰腺癌、黑色素瘤、卵巢癌、前列腺癌、肺癌和血液肿瘤中,SIRT6在肿瘤的不同发育阶段或不同细胞系中发挥着相反的作用[11]。目前,SIRT6在非小细胞肺癌的研究比较广泛,但在肺腺癌的研究比较少见。WANG J等[17]的研究表明,放疗可促进SIRT6蛋白介导的RBBP8脱乙酰化的发生,进而提高吉非替尼的疗效。由此可见,SIRT6在肺腺癌中可能是一种抑癌基因,但是,SIRT6在肺腺癌的作用机制仍未明确。此外,SIRT6在诸多肿瘤中的研究显示出相互矛盾的结果。因此,构建SIRT6基因敲除的A549细胞系,对于进一步探索SIRT6在肺腺癌的作用机制具有十分重要的意义。
CRISPR/Cas9是一种稳定、高效、简单且广泛使用的新型基因编辑技术。CRISPR/Cas9在2013年被成功应用于真核生物和细胞之后[18-19],该技术得到了突飞猛进的发展,目前已被广泛用于农业[20]、生物材料[21]、医学[22]等诸多领域。CRISPR/Cas9作为新兴的基因编辑工具,具有操作简便、编辑高效、通用性广等优势,因而被广泛应用于临床医学研究领域。有研究表明,CRISPR/Cas9 技术在恶性肿瘤[23]、心血管系统疾病[24]、免疫系统疾病[25]、遗传性疾病[26]以及神经系统疾病[27]等临床医学研究领域中取得快速的发展。尤其在肿瘤诊断和治疗方面,CRISPR/Cas9 可以进行肿瘤模型构建、肿瘤演化机制研究、分子诊断、生物治疗以及分子靶向药物的研发与筛选,为肿瘤的基础研究和临床应用提供新的技术保障[28]。毫无疑问,CRISPR/Cas9被证明是一种革命性的工具,在诸多领域的研究显示出显著的效果,但其也有自身的局限性。在本实验中,根据CRISPR/Cas9技术靶点设计原则,选择了3个sgRNA进行研究,但最终只有SIRT6-28符合后续的研究,因此该技术的基因编辑效率有待提高。而其他较为突出的问题是脱靶效应、脱氧核糖核酸损伤毒性和免疫毒性[29],相信随着科学技术的发展和自身不断的完善,CRISPR/Cas9技术的缺陷终将得到改进。
本研究通过CRISPR/Cas9技术,设计并筛选了针对SIRT6敲除的sgRNA,然后将sgRNA-SIRT6序列与载体链接,成功构建重组质粒并包装,将重组质粒转染入A549细胞中,筛选单克隆细胞进行鉴定。目前鉴定细胞系基因成功敲除的主要方法有3种:①DNA测序结果是否存在基因突变;②Western Blot检测蛋白是否表达;③实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测细胞mRNA是否表达。部分学者采用单一方法进行验证基因敲除模型构建是否成功[30],而更多学者选择其中多种方法进行联合鉴定[31-32]。本研究使用了DNA测序和Western Blot检测蛋白两种方法联合鉴定。测序结果表明PCR片段有明显的基因突变,而Western Blot结果显示敲除后的A549细胞内无SIRT6蛋白表达,证明敲除SIRT6基因的A549 稳定细胞系构建成功。
综上所述,本研究成功构建了sgRNA-SIRT6重组质粒,同时成功敲除了人肺腺癌A549细胞系中的SIRT6基因,为深入研究SIRT6在肺腺癌的作用机制奠定了基础。

