定量光导荧光技术评价CPP-ACP联合多乐氟对釉质抗酸性影响的实验研究
韦方圆,刘锦,张然,韦宇,粱介技,陶雪娇,黎淑芳,3
(1. 右江民族医学院口腔医学院,广西 百色 533000;2. 右江民族医学院研究生学院,广西 百色 533000;3. 右江民族医学院附属医院口腔科,广西 百色 533000)
早期龋[1-2]指的是釉质因致龋微生物形成牙菌斑代谢产酸而脱矿,且脱矿发生在釉质表层下而未形成龋洞的部分龋损,常表现为牙釉质的白垩色斑块。传统的修复方法是手术治疗,然而在近几年里,随着人们对龋病认知的不断深化,局部用药靶向抑制致龋菌菌斑生物膜活性及促进已脱矿釉质再矿化,从而探索简便、高效、无创、安全的防治手段成为可能。定量光导荧光(quantitative light-induced fluorescence,QLF)[3]是一种检测早期龋病病变和监测预防性干预措施的潜在工具,QLF的工作原理是牙釉质自身荧光、检测和检测定量与脱矿相关的荧光损失在时光散射的增加使病变在亮绿色背景上出现暗点,荧光图像的损失可以量化与相邻的健康组织。对牙齿的荧光图像进行记录、数字化和定量分析。QLF在体内的可靠性似乎非常适合定量光滑表面的初步龋变。本研究应用QLF方法,比较去离子水组、CPP-ACP组、多乐氟组及联合组对光滑面早期龋损的抑制效果,同时评价QLF方法用于纵向病变跟踪监测和评价不同龋病干预措施效果的可能性。
1 材料与方法
1.1研究对象及纳入和样本制备
1.1.1研究对象 收集在右江民族医学院附属医院口腔科就诊的因正畸减数拔牙的新鲜前磨牙34颗,本研究经右江民族医学院附属医院伦理委员会批准,所有参与实验的患牙其家属术前均签署知情同意书。纳入标准:在显微镜下观察,要求牙齿根尖孔发育完全;冠根均无龋、无四环素牙、无釉质发育不全或矿化不全;牙冠形态正常,无隐裂;无牙体缺损及充填体,无明显色素沉着。
1.1.2样本制备 将34颗前磨牙依次用600目、800目碳化硅水砂纸在流水下对颊侧面釉质进行抛光。从中随机选取2个牙齿标本放入生理盐水,不作任何处理,作为电镜检查对照。剩余32颗前磨牙于颊侧面中央建立大小4 mm×4 mm正方形开窗区,其余牙体表面用透明抗酸指甲油覆盖,随机分为4组,每组8颗牙,并为每组各个标本制作硅橡胶底座。
1.1.3主要实验仪器 定量光导荧光系统(Inspektor Research Systems BV)、CPP-ACP糊剂(GC公司 日本)、多乐氟(高露洁棕榄有限公司 美国)、乙酸(上海生工生物有限公司)、氢氧化钠(上海生工生物有限公司)、去离子水(右江民族医学院实验室提供)、抗酸指甲油(美宝莲有限公司)、实验室PH计(上海梅特勒-托利多公司)、37 ℃电热水浴恒温箱(北京利康达圣科技发展有限公司)、4 ℃冰箱(中国海尔公司)、电热恒温鼓风干燥箱(广州市星烁仪器有限公司)、场发射扫描电子显微镜(日本高新技术公司/英国牛津公司)。
1.2方法 术前使用定量光导荧光系统检测各组基线处的△F、Area、△Q值,然后对各组开窗区分别进行以下处理:①去离子水组:气枪吹干牙面,去离子水冲洗;②CPP-ACP组:气枪吹干牙面,小棉棒均匀涂布CPP-ACP,完全覆盖开窗区,10 min后去离子水冲洗,按照使用说明每天早晚各涂布1次;③多乐氟组:气枪吹干牙面,小棉棒均匀涂布多乐氟,完全覆盖开窗区,10 min后去离子水冲洗;④联合组:CPP-ACP每天早晚各涂布1次,而多乐氟只在第1天涂布,涂布方法同上,10 min后去离子水冲洗。将处理完毕的标本浸泡在人工脱矿液中,置入37 ℃电热恒温水浴箱中进行PH循环实验,每天更换脱矿液,72 h后取出,所有标本用生理盐水冲洗干净并用气枪吹干,利用定量光导荧光系统拍摄每组标本的荧光图像。
1.3QLF图像摄取及分析 所有牙釉质标本均于抗酸实验处理前(基线)和处理后第3天由同一操作员在无环境光的暗房中使用定量光导荧光系统拍摄QLF图像。在每次拍摄QLF图像之前,将标本的釉质表面用气枪吹干5 s。由系统自带的软件Q-Ray v1.42保存并分析荧光图像,见图1。界定病损范围,由系统的分析软件测量每个标本的荧光损失百分比(△F,%),相应的脱矿面积(Area,px2),病变体积(△Q,%px2),以确定病变严重程度,设置△F值变化-5%为病损阈值。
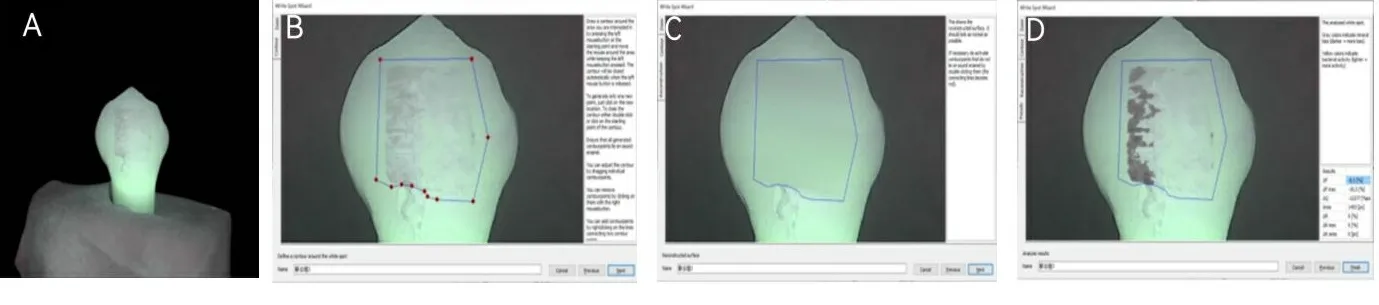
注:A.原始QLF图像;B.人工描绘病损区域;C.自动生成参考的图像;D.在原始图像上显示所选区域中每个像素的荧光损失。
1.4扫描电镜观察釉质表面形貌 抗酸实验结束后,每组随机选取2个实验标本以及在生理盐水中备份保存的2个原样标本,用高速涡轮手机将这10颗离体牙切割成包含实验开窗区在内的约为4 mm×4 mm×2 mm大小的釉质块,见图2。清洁开窗区表面,鼓风干燥箱中干燥72 h,离子溅射喷金,抽真空,放大倍数20 000倍,扫描电镜观察抗酸实验后开窗区釉质表面形貌。

图2 4 mm×4 mm×2 mm大小釉质块
2 结果
2.1抗酸实验前各组人工釉质龋标本的QLF均值 见表1。
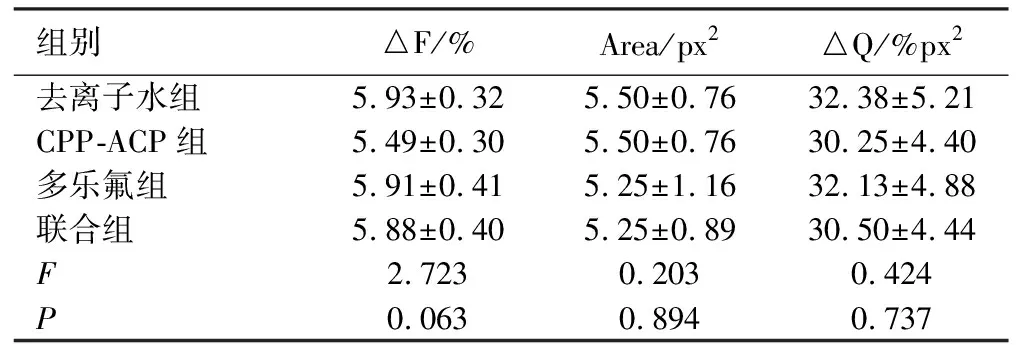
表1 实验前各组的QLF值比较
2.2脱矿后各组人工釉质龋标本的QLF荧光图片结果 在QLF荧光图片中显示为亮度减弱的荧光损失暗区,4个不同处理组形成病损的严重程度不一。从图片中可以看出,联合组颊侧面形成的脱矿面积最少,荧光损失最轻。见图3。

注:A.去离子水组;B.CPP-ACP组;C.多乐氟组;D.联合组图。
2.3脱矿后各组人工釉质龋标本QLF均值比较 在脱矿液中连续浸泡3 d后,4组标本的颊侧面开窗区均形成了不同程度的脱矿病损。与去离子水组比较,CPP-ACP组、多乐氟组以及联合组的早期龋病损较轻,其中联合组△F、Area、△Q最少。各组脱矿后△F、Area、△Q比较差异具有统计学意义(P<0.001);因此进一步进行组间两两比较,各组组间△F、Area、△Q差异均具有统计学意义(P<0.05),见表2。
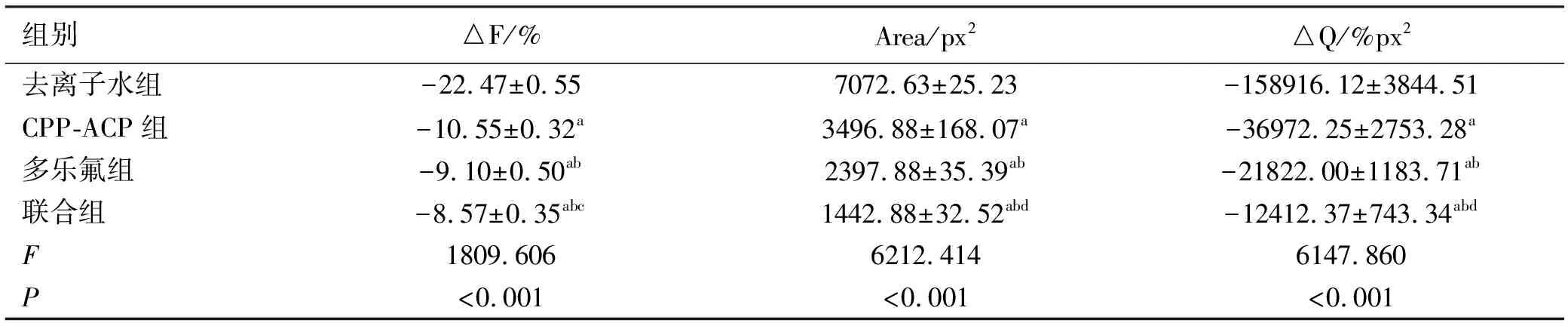
表2 实验后各组的 QLF 检测比较
2.4扫描电镜观察结果 扫描电镜下观察原样标本釉质表面平整,质地致密光滑,未见有釉柱晶体溶解及孔隙结构,见图4A;去离子水组可见明显的酸蚀样外观,釉柱晶体大量溶解,质地疏松,表面明显粗糙不平,大量散在的孔隙及裂缝状结构存在,见图4B;CPP-ACP组可见釉质表面有少量微观颗粒或小球,伴有少量大块状杂质吸附,孔隙结构较少,见图4C;多乐氟组可见釉质表面层叠状矿物质连接成片,伴有小颗粒结晶沉积在孔隙,孔隙结构较少,见图4D;联合组可见釉质表面少许裂隙及磨痕,几乎无孔隙,质地致密光滑,有不同程度的高密度矿物质覆盖,见图4E。

注:A.原样釉质;B.去离子水组;C.CPP-ACP组;D.多乐氟组;E.联合组。
3 讨论
目前,针对检测龋病的方法通常有国际龋病检测评估系统、扫描电子显微镜观察、显微硬度测试、激光荧光检测(DIAGNOdent)、显微放射照相、定量光导荧光技术、光学相干断层扫描术等[4-7]。QLF是荷兰Inspektor Research Systems BV公司在1994 年开发出来的一种基于牙齿的自体荧光而发展起来的光学诊断技术。本实验使用的第二代新型设备QLF-D Bilu-minator TM 由安装在装有60 mm微距镜头的单反相机上的双面发光器组成,以波长波谱范围为385~425 nm激光束作为光源。该技术可以用于检测和量化龋白斑病变,以及监测早期光滑面病损脱矿和再矿化的动态变化过程,准确性和可重复性较高。使用QLF技术可在整个操作期间由一位操作员执行,减少误差和标准一致性检验的工作。邢向辉等[8]利用QLF技术纵向监测含氟涂膜对离体牛牙釉质再矿化过程的动态变化,结果显示QLF技术适用于观察光滑面人工龋损中矿物质含量改变的动态过程。沈红等[9]应用QLF技术评价114名幼儿的201颗乳磨牙牙合面窝沟封闭半年效果,结果显示窝沟封闭后6个月内封闭区域的红色荧光比封闭前明显减少,显示窝沟封闭剂具有阻挡菌斑及软垢在牙面附着的能力,得出结论:QLF适用于在临床中评价窝沟封闭效果,可作为跟踪患者预防性治疗效果的支持方法之一。定量光导荧光技术拍摄简单,且准确性高,因此本实验采用了定量光导荧光技术对牙釉质标本矿物质含量变化进行量化分析。
非矿化治疗早期龋病变已被证实在临床实践中具有显著的优势[10]。用氟化物治疗已被证明可以提高再矿化率,并已被广泛用于增加早期龋病的再矿化。酪蛋白磷酸肽(CPP)具有稳定无定形磷酸钙(ACP)的能力,CPP-ACP复合物具有缓冲pH,防止脱矿到增强再矿化的作用。CPP-ACP作为氟化物的辅助治疗已经显示出了良好的结果[11]。在本研究中,在QLF荧光图像中表现为联合组形成的病损明显较去离子水组、CPP-ACP组、多乐氟组形成的病损轻微,联合组△F、Area、△Q最少。各组脱矿后△F、Area、△Q差异比较具有统计学意义。实验表明CPP-ACP与多乐氟联合运用可以有效抑制牙釉质光滑面早期龋损形成的作用,两者联合运用能提高釉质的抗酸性,起协同效应,与THIMMAIAH C等[12]学者的研究结果一致。CPP-ACP对治疗咬合牙表面的早期龋齿病变有良好的疗效。当病变位于光滑表面时,氟化物和CPP-ACP联合治疗可达到与氟化物单药治疗相同的效果。对于咬合病变,CPP-ACP和氟化物联合治疗甚至可能比氟化物单药治疗提高疗效。然而,未来还需要更多的大样本严格的研究来证实CPP-ACP在治疗早期龋病方面的优势。
本研究扫描电镜结果显示,原样釉质标本表面平整,符合正常釉质扫描电镜下地貌,说明本次实验选取的标本釉质矿化程度及发育状态良好,无矿化不良现象。去离子水处理的釉质标本经过脱矿液浸泡后,表面呈现明显的酸蚀样地貌,釉柱晶体大量溶解析出,质地疏松,表面明显粗糙不平,大量散在的孔隙及裂缝状结构存在,与釉质早期龋损病变相似,可能是釉质与酸直接接触一定时间后,釉柱晶体间的间隙被打开,并一直呈开放状态,为酸持续向釉质内侵蚀提供通路,晶体溶解析出,最终形成“空洞”样的微孔结构,说明去离子水不能阻碍酸对釉质的侵蚀,不能增加釉质抗酸蚀的能力。CPP-ACP处理的釉质标本经脱矿液浸泡后,表面呈现少量不规则微观颗粒或小球,伴有少量大块状杂质吸附,孔隙结构较少,可能是CPP-ACP作为钙磷等物质的储存库,在酸性环境中,释放出高浓度的钙、磷酸根离子向釉质内部转运,减少釉质矿物质流失,阻挡釉质脱矿,图示的不规则白色颗粒或小球状微观晶体或许就是储存部位的体现,并且说明CPP-ACP可以保护釉质不被脱矿,增强抗酸能力。但是CPP-ACP 为何能提高釉质的抗酸性,其中的机制现在还不是很清楚。有些学者推测这其中的原理可能与CPP-ACP 的再矿化能力有关[13]。多乐氟处理的釉质标本经脱矿液浸泡后,表面显示为叠状矿物质连接成片,伴有小颗粒结晶沉积在孔隙,孔隙结构较少,可能是多乐氟与牙釉质表面接触后形成氟化钙,氟化钙在在酸性环境中溶解释放出氟离子,再次与羟基磷灰石形成氟磷灰石矿物质沉积于釉质表面及孔隙中,提示多乐氟具有增强釉质抗酸性,抑制脱矿的作用。其中,经CPP-ACP与多乐氟联合处理的釉质表面几乎无孔隙,质地致密光滑,有不同程度的高密度矿物质覆盖,脱矿程度最轻,说明CPP-ACP与多乐氟联合运用的抗酸蚀能力最强,起协同作用。然而两者联合运用时,有研究表明[14]先使用 CPP-ACP 后使用氟化物产生的再矿化作用更早且再矿化程度更高。研究发现可能的原因是先使用氟化 物可能会导致氟磷灰石在釉质表面沉积,导致龋白斑表面孔隙孔径减小、数量减少,进而影响 CPP-ACP 向病变深部渗透发挥作用。同时有临床试验也得出了相同的结果[15]。因此上述结果提示在实验设计时,联合使用氟化物尤其是氟化物浓度较高时,应谨慎考虑使用顺序可能对结果造成的影响。

