不同强度白噪声建立噪声性耳鸣动物模型效果比较及对听皮层生长相关蛋白-43表达的影响
唐薇,凌赛泳,向澎,胡玉琳,路雪妍,林世童,刘津
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院儿童保健康复科,广西 百色 533000;3. 右江民族医学院附属医院耳鼻咽喉头颈外科,广西 百色 533000)
耳鸣是指患者在无外界声学刺激的前提下,在耳内或者颅内感受的异常声音。据研究表明,全球有7.4亿成年人被耳鸣影响,且患病率随年龄增加正逐年上升[1]。耳鸣患者伴或者不伴听力下降,注意力不集中等不良心理反应,并存在明显睡眠障碍,同时增加对压力源的敏感度,从而对个人生活和情绪造成严重影响[2]。耳鸣发病机制复杂多样,虽有众多学说,可目前尚未被完全定论,因而治疗效果往往不尽如人意。
近年来通过水杨酸等药物诱导结合“饮水抑制”等行为学检测方法构建的耳鸣动物模型被广泛应用,虽有利于开展耳鸣致病机制研究,但结合临床患者就诊原因分析,暂未发现经由水杨酸等药物导致的耳鸣症状[3],并且“饮水抑制”这类行为学方法用以判断耳鸣行为过于主观且成本高、效率低、缺乏敏感性[4]。而噪声已然是世界公认七大危害之一,可对听觉系统、大脑边缘系统等多系统造成损伤,进而影响听觉、记忆等多方面能力[5],因此从实践角度出发,噪声诱导耳鸣动物模型更具有临床探究意义,再结合听觉惊跳反射间隔前刺激抑制实验(gap prepulse inhibition of acoustic startle,GPIAS)这一无损害的检测方法,可更客观、灵敏反应动物是否存在耳鸣行为。
生长相关蛋白-43(growth associated protein,GAP-43)作为一种与神经发育、突触可塑性等高度相关的特异性蛋白,主要分布于大小脑、脊髓等自主神经系统的神经元内,可认为是研究神经可塑性变化的重要标志物之一[6]。部分结果表明听觉中枢功能重塑化与耳鸣的发生发展可能密切相关[7],而听皮层作为听觉传导通路中的关键部分,其产生的变化对于中枢机制的探究至关重要。但目前在噪音诱导的耳鸣动物模型中,对听皮层内GAP-43表达变化的报道仍然较少,因此为进一步探究耳鸣时中枢的病理生理变化,噪音暴露后听皮层是否产生功能重塑化的改变进行观察,并探究相关临床意义。
本研究通过不同强度宽频带白噪声诱导动物产生耳鸣,并结合GPIAS实验判断动物是否出现耳鸣行为,同时观察听皮层内GAP-43的表达变化,一方面可分析比较得出优质、稳定的耳鸣动物模型,另一方面可进一步验证听觉中枢功能重塑化与耳鸣发生发展的关系。
1 材料与方法
1.1实验材料
1.1.1实验动物 54只SPF级C57BL/6J雄性小鼠,年龄为6~8周。体重约18~20 g。排除中耳及内耳疾病后纳为本次实验对象,动物购自北京维通利华实验动物技术有限公司。许可证号为:SCXK(粤)2022-0063。本实验由右江民族医学院实验动物伦理审查委员会批准开展。
1.1.2试剂与仪器 惊跳反射实验系统(Med Associates),声级计(北京声望声电技术有限公司),信号发生器(北京声望声电技术有限公司),音响(HARMAN International)。
1.2方法
1.2.1动物分组 将54只C57小鼠从1~54编号,从随机数字表中任一行任一列开始,依次读取3位数作为随机数录于编号下,再将全部随机数从小到大进行排序号,规定序号1~18号为对照组(未噪音暴露,Control),19~36号为BBN-90dB 组、37~54号为BBN-100dB 组, 每组各18只小鼠。三组小鼠使用不同强度宽频带白噪声进行噪声暴露后于暴露后3 d(P3组)、7 d(P7组)、14 d(P14组)的不同时间节点分别进行GPIAS检测,每组6只小鼠 ,如图1所示。
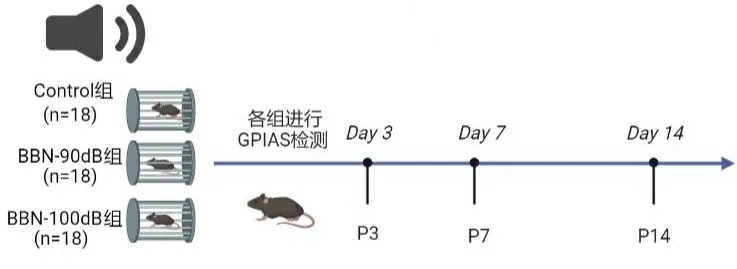
图1 动物分组情况
1.2.2噪音暴露 首先将BBN-90dB组中C57小鼠置于标准隔音室内采用90dB SPL的宽频带白噪声(broad-band white noise,BBN)进行噪声单次暴露2 h,在暴露时将C57小鼠分别单只放置在一个由4.5 cm×4.5 cm×8 cm大小制成的铁丝笼内,该笼可在不影响声音传播的基础上使小鼠保有一定程度的自由活动,以避免暴露期间实验动物相互影响入耳声强,同时防止小鼠相互的撕咬。音响置于笼子的前方,噪声暴露前使用已通过广西壮族自治区计量检测研究院校准和检测合格的声级计对暴露的声音强度进行校准,校准时声级计的探头须在笼子周边各处进行测量,以便确认达到实验所需的声强。然后将BBN-100dB组的C57小鼠使用同样的方式以100dB SPL的宽频带白噪声进行单次噪声暴露2 h,最后将对照组中C57小鼠同样单只置于自制笼内于标准隔音室放置2 h,在此过程中音响处于关闭状态,暴露结束后将所有小鼠送至实验动物中心分笼饲养至各时间节点后进行检测。
1.2.3耳鸣行为学检测 通过以GPIAS实验对本次实验中的小鼠进行耳鸣行为学检测。该检测在标准隔音室内的一个隔音箱内进行,首先在检测时将小鼠单只置于一个有多个孔洞的树脂玻璃动物固定装置内限制其活动。在检测开始前小鼠在黑暗无声环境下于动物固定装置里适应约5 min,随后开始正式检测。该设备可通过固定装置下方灵敏的压电传感器,如图2A所示,将小鼠在检测时受到惊跳反射刺激后的肌肉动作幅度转化成为相应的波形并自动计算出波幅。GPIAS实验由30个有前间隔刺激实验(gap)和30个无前间隔刺激(nogap)实验组成,两者被随机引入,如图2B所示。耳鸣的行为学检测以GPIAS抑制率作为检测指标,即GPIAS抑制率(GPIAS%)=(AvgTnogap-AvgTgap)/AvgTnogap×100%。其中AvgTnogap为无前间隔刺激时诱发的惊跳反射波幅,AvgTgap为有前间隔刺激时诱发的惊跳反射波幅。
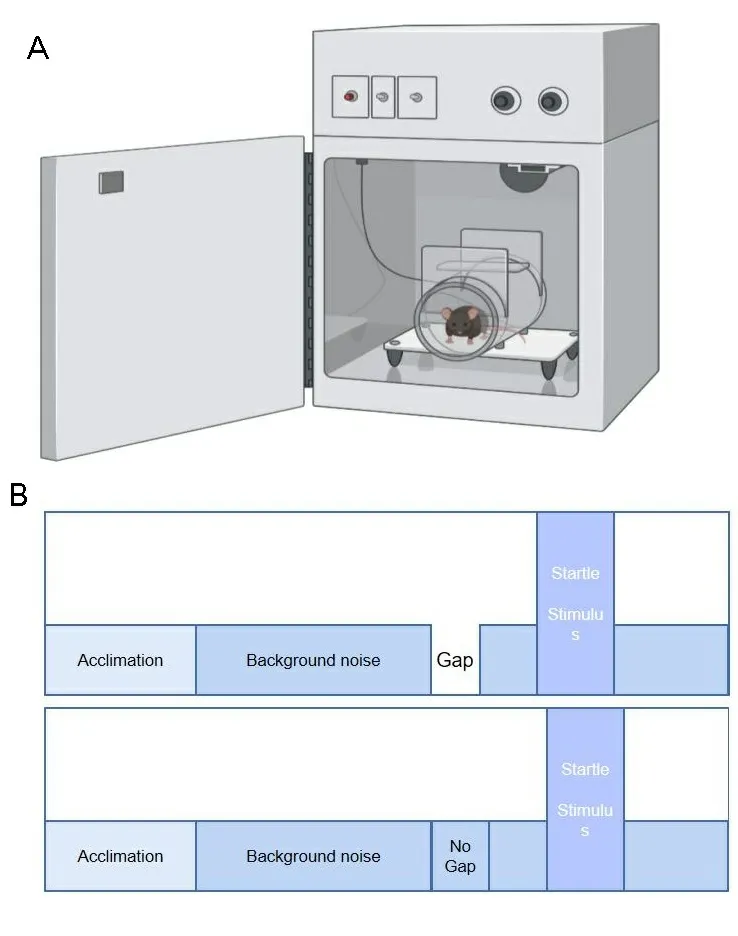
注:A.惊跳反射系统仪器;B.GPIAS实验具体过程。
1.2.4Western Blot 在耳鸣行为学检测结束后,按照分组的时间节点,分离小鼠听皮层组织,放置于冻存管中,用液氮急速冷冻,随后用研钵磨碎听皮层组织,蛋白提取试剂盒提取总蛋白,BCA法测定总蛋白浓度,随后进行10%SDS-PAGE电泳分离分子量不同的蛋白,再转印至PVDF膜上,用快速封闭液封闭,4 ℃件下一抗孵育过夜,之后用TBST洗膜3遍,再在室温条件下孵育二抗1 h,最后用TBST洗膜3遍,采用ECL法发光显影,保存图片后再用ImageJ软件分析数据。
2 结果
2.1耳鸣行为学检测 与对照组相比,在90dB SPL宽频带白噪声的条件下,C57小鼠的GPIAS%值在噪声暴露后3 d、7 d、14 d均降低(P<0.05)。但100dB SPL宽频带白噪声使C57小鼠的GPIAS%值较前者下降更为显著(P<0.01)。见表1。
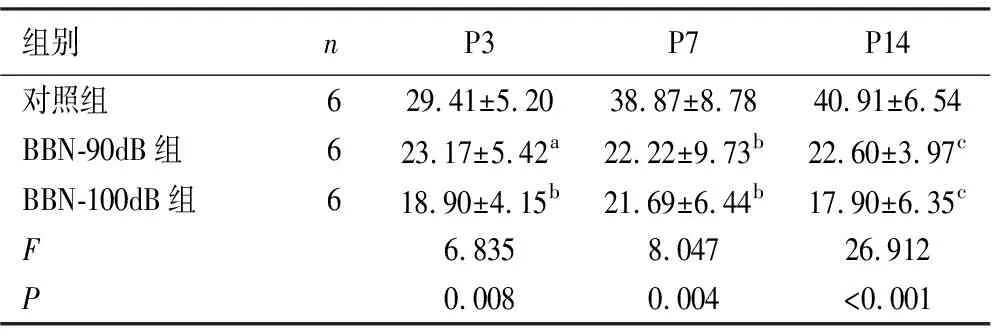
表1 各组小鼠噪声暴露2 h后不同时间节点中GPIAS%值
2.2各组GAP-43蛋白表达比较结果 在噪音暴露后3 d,与对照组相比,BBN-90dB组和BBN-100dB组的GAP-43表达都有升高趋势,且差异均存在统计学意义(P<0.05);而在噪音暴露后7 d,与对照组相比, BBN-100dB组GAP-43表达明显升高且差异存在统计学意义(P<0.01),但BBN-90dB组GAP-43表达差异不存在统计学意义(P>0.05);在噪音暴露后14 d,BBN-100dB GAP-43表达较对照组升高且差异存在统计学意义(P<0.05),而BBN-90dB组GAP-43表达与对照组相比差异不具有统计学意义(P>0.05)。见表2和图3。
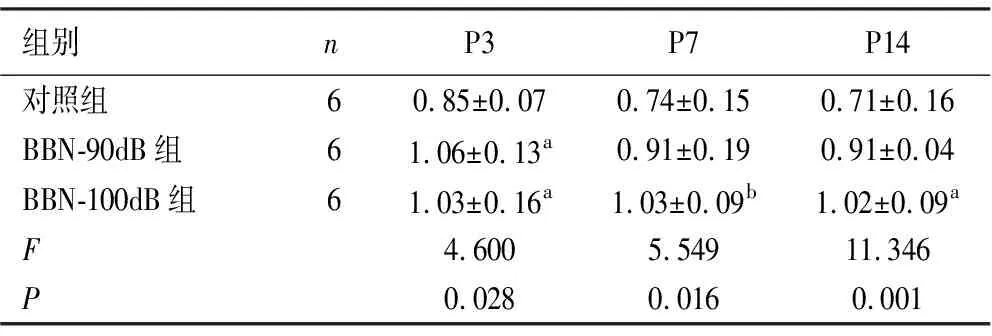
表2 各组小鼠听皮层中GAP-43表达水平对比

注:1.对照组;2.BBN-90dB组;3.BBN-100dB组。
3 讨论
耳鸣是一种多种因素共同作用的常见疾病,其治疗效果常面临着“高患病率、低治愈率”的局面,这对于患者的心理健康和生活质量造成严重影响。如今噪声已然是青少年和大学生群体出现耳鸣症状的常见诱发因素[8],在多种噪声类型中,于现实生活中更常接触宽频白噪声,同时这类噪声可将所有频率以相同能量较为均匀的进行播放,而非将能量多集中于部分频率里,所以利用此类噪声诱导的耳鸣动物模型更能有效模拟人类耳鸣发生情况,更具有临床实践意义。再结合GPIAS检测方式,通过动物的防御性反射,可有效降低训练动物形成条件反射的时间成本,同时对动物本身并无刺激、损害,能相对可靠地反应动物是否出现耳鸣行为[9]。
在本次实验中,90dB SPL白噪声环境中单次暴露2 h后,发现小鼠虽在暴露后多个时间节点中GPIAS%抑制率呈下降趋势,差异有统计学意义,提示造模成功,但是在暴露后14 d其耳鸣行为进一步稳定出现。而在100dB SPL白噪声环境中,小鼠从噪声暴露后3 d至观察结束时,都表现出持久、有效的耳鸣行为。这表明一方面适度噪声可有效诱导小鼠产生耳鸣行为,另一方面声音通过振动内耳淋巴液使毛细胞纤毛束来回摆动,从而开放机械电通道,将声音机械能转化成电信号,最终将信号上传至听觉中枢。但这类毛细胞由于具有机械敏感性,易被响亮声音破坏,从而导致外周输入信号减弱,听觉中枢神经元发生可塑性变化,促进耳鸣发生发展。100dB SPL宽频噪声在传导过程中,对毛细胞和听觉中枢改变更为明显,诱发的耳鸣行为也更为显著,因此GPIAS%抑制率下降明显,从造模角度而言这有效证明这类噪声更利于构建稳定、便捷的耳鸣动物模型,并且更能有效平衡时间成本和经济成本之间的关系。同时如窦玉玉等[10]研究类似, 采用以小鼠造模后不同时间点进行观察的方法,可以全面反映动物耳鸣行为的变化过程,探索出动物表现稳定耳鸣行为的最佳条件。
目前耳鸣的机制尚未定论,听皮层作为听觉传导通路中最高级中枢,其在噪声暴露后的改变对耳鸣发生发展极为重要。在部分耳鸣患者的静息态功能磁共振检查结果中发现,位于颞中回的听皮层,其局部一致性和分数低频波动振幅值同时增加,且局部一致性值与耳鸣致残量表评分正相关[11],提示患者的听觉相关皮层可能发生局部神经功能改变。
GAP-43是一种与神经细胞生长、发育、轴突再生、突触可塑性密切相关的胞膜磷酸化蛋白,当神经损伤或轴突再生时,该蛋白表达随着神经元突起生长而增加,并会通过轴突运输移动到轴突再生处的边缘,并最终集中在轴突生长锥[12]。所以,GAP-43常被用来作为轴突再生、突触可塑性情况的标记。本次研究结果显示,在噪声暴露后小鼠听皮层中,GAP-43表达整体呈升高趋势,且差异具有明显统计学意义,与GPIAS%抑制率变化相同。说明噪声诱导小鼠出现耳鸣行为时,其听皮层内的神经元受到损伤,使GAP-43合成增加,促进神经元修复。同时不同强度噪声导致听皮层内神经元损伤程度不一致,在噪声诱导7 d后,BBN-90dB组中GAP-43表达较同期对照组增加仅为23.00%,BBN-100dB组则增加至45.10%,在其他时间点中也观察到这类趋势,提示相对较强的噪声对听皮层造成的损伤更为严重,使GAP-43合成更多,神经元修复和轴突再生更为显著。但随着时间的推移,GAP-43表达逐渐下降。在BBN-90dB组中,噪声诱导3 d后,GAP-43表达升高,为同期对照组的1.24倍,但14 d后,GAP-43表达仅为3 d时的85.80%,BBN-100dB组中同样观察到此类变化,提示GAP-43作为参与听觉中枢重建的重要因子,一旦重建完成,GAP-43表达逐渐减少。由此推测,当噪声影响后,听皮层内神经元受损,使GAP-43受到刺激大量表达,从而使受损神经元发生轴突再生及突触大量生长,最终导致听皮层内神经元产生新的连接和突触效率的变化,促进耳鸣的病理生理过程。
综上所述,100dB SPL噪声作为诱导因素可有效、快捷构建稳定的耳鸣动物模型,为耳鸣发病机制等研究贡献良好的模型基础。GAP-43与听皮层的突触可塑性高度相关,在噪声干预两组中GAP-43表达升高,与小鼠出现耳鸣行为一致,这说明听觉中枢重塑化改变可能参与耳鸣的发生发展,为进一步探索药物阻断、保护新靶点奠定基础。

