基于转录组测序探究TGF-β对成纤维细胞作用的机制研究
王想,方波,袁昊,米俊豪,谢毓丽,莫泳锋,杨日荣
(1. 广西医科大学基因组与个体化医学研究中心,广西 南宁 530021;2. 广西医科大学基础医学院,广西 南宁 530021;3. 广西医科大学再生医学与医用生物资源开发应用协同创新中心,广西 南宁 530021;4. 广西医科大学第二附属医院,广西 南宁 530007)
转化生长因子β(transforming growth factor-beta,TGF-β)家族是调节细胞生长和分化的蛋白质家族。TGF-β信号紊乱不仅是炎症性疾病的基础,还可以转化正常的成纤维细胞表型,促进肿瘤的发生[1]。在肿瘤微环境(tumor microenvironment,TME)中,大量的基质细胞、肿瘤细胞、免疫细胞以及这些细胞分泌的细胞因子和趋化因子嵌入其中[2]。有研究报道,在胰腺癌、乳腺癌、结直肠癌中,TGF-β可以促进正常成纤维细胞向肿瘤相关成纤维细胞(cancer association fibroblast,CAF)的转化,与预后不良相关[3-5]。CAFs作为TME中基质的主要成分,分泌多种生长因子、炎性因子、基质金属蛋白酶和细胞外基质蛋白,促结缔组织再生反应,导致不良预后[6-7]。由于CAFs主要来源于成纤维细胞、肌成纤维细胞和内皮细胞,并且肺中有丰富的成纤维细胞,癌细胞常倾向于扩散到肺[8]。因此,本课题组评价了TGF-β因子刺激下的人成纤维细胞MRC-5的形态变化、差异基因的表达以及参与的主要通路过程。
本次研究采用细胞培养、转录组 RNA 测序技术和生物信息学分析方法,筛选出差异表达基因(differentially expressed genes,DEGs),对DEGs的功能和富集的相关通路进行分析,同时构建DEGs的蛋白相互作用网络图谱,筛选出受TGF-β调控的关键基因在膀胱癌和正常组织中的差异表达以及生存预后相关性,有望作为膀胱癌患者的预后标志物。
1 材料与方法
1.1材料 人成纤维细胞MRC-5购自上海盈湾生物科技有限公司;MEM培养基和胎牛血清均购自美国Gibco公司;人TGF-β1重组蛋白购自美国PeproTech公司;逆转录酶、建库试剂盒均购于瑞士罗氏生物公司。
1.2方法
1.2.1细胞刺激实验 常规细胞培养后,取对数生长期细胞按照每孔5×104个细胞种于48孔培养板中,分别设置Mock培养基组、20 ng/mL TGF-β刺激组进行24 h药物反应,拍照记录,收取同批细胞沉淀,放入-80 ℃冰箱冻存。实验重复3次后进行全转录组检测。
1.2.2转录组RNA测序 细胞经裂解后使用包含细胞条形码片段(barcode)和唯一分子识别符(UMI)序列的25个核苷酸核苷引物Oligo(dT)进行逆转录。在第一链cDNA合成后,经过PCR扩增,得到互补链DNA。将新合成的双链DNA退火到索引引物,致3′末端的DNA生物素化。然后,用超声波将合成的DNA片段切成300 bp的片段,并用链霉亲和素C1磁珠孵育连接3′端,随后将终产物进行Qubit浓度检测,并利用Agilent 2100进行进一步质量检测。所有测序数据在Illumina HiSeq 4000平台上使用150个碱基对的末端测序产生。
1.2.3差异表达基因分析 利用R软件(v4.0.2)进行生物信息学分析。利用limma(v3.44.3)分析两组间差异基因表达情况,当差异倍数(flod change)大于2,即|log2FC|>1 且矫正P<0.05 时被认为是差异显著的基因。
1.2.4功能富集分析与蛋白质相互作用网络 利用cluster Profiler(v3.16.1)软件进行生物学过程的注释(gene ontology,GO)和京都基因和基因组通路富集分析(kyoto encyclopedia of genes and genomes,KEGG),并通过蛋白相互作用网络(protein-protein interaction,PPI)筛选出关键基因(https://string-db.org/,v11.5,2023-2-17)。将PPI导出图通过cystoscape(v3.9.0)软件对结果进行美化和分析,按节点的互作分数设置色阶度进行排序,设置为不同的表现颜色。
1.2.5组织表达量差异和预后生存分析 在GEPIA2在线数据库中分析其中5个差异基因在膀胱癌组织与正常组织间RNA表达量的差异,并对膀胱癌中的3个基因和基因集的表达进行总体生存(overall survival,OS)分析,P<0.05视为具有统计学差异(http://gepia2.cancer-pku.cn/)。
1.3统计学方法 采用R(v4.0.2)软件进行统计分析和作图;采用非参数检验或t检验分析两组间差异,以矫正P或P<0.05为差异具有统计学意义。
2 结果
2.1正常成纤维细胞经TGF-β的刺激情况 光镜下观察体外培养的人成纤维细胞MRC-5为梭形,其形态尚可依细胞的功能变化和物理性状不同而发生改变。经过24 h培养后,TGF-β处理组细胞较Mock组形态细长,生长速度快,但贴壁情况差异不明显(见图1)。随后,我们收集3次重复实验的两组细胞沉淀进行转录组测序。
2.2转录组文库的成功构建 Qubit检测样本cDNA浓度为23.8 ng/μL,Agilent 2100检测样本文库,主峰为354 bp,同时在900~2000 bp;1000~5000 bp 占比大于15%;300 bp以下片段占比小于40%。质量合格,进行上机检测(见图2)。
2.3DEGs分析 通过对两组细胞的转录组测序数据分析,以差异倍数≥2且矫正P<0.05绘制火山图和层次聚类图,共筛选出161个差异基因,包括39个上调基因和122个下调基因(见图3)。

注:图中比例尺为100 μm
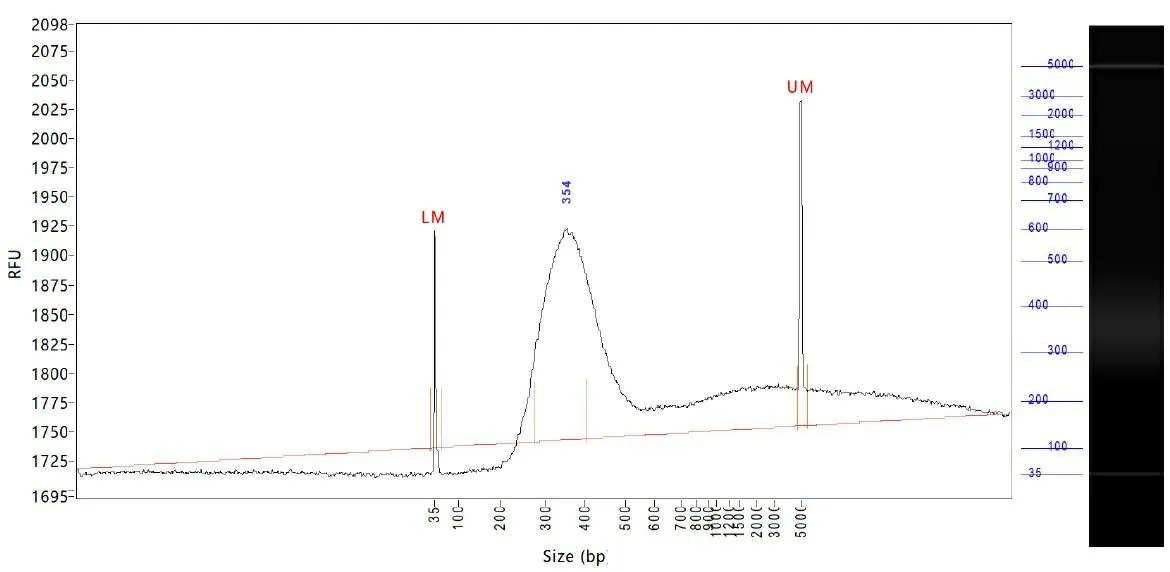
图2 构建细胞文库质检图谱

注:A.差异基因火山图(绿色表示下调,红色表示上调),图中基因均为矫正P有意义的基因;B.差异表达
2.4GO功能富集分析 通过GO富集分析结果发现,在GO生物学过程(biological process,BP)中TGF-β主要影响的是神经元凋亡、坏死过程,核苷磷酸生物合成过程,嘌呤核糖核苷磷酸代谢过程,核糖核苷磷酸生物合成过程和核糖核苷磷酸代谢过程。富集基因数量相对较多的细胞成分(cellular component,CC)主要包括内质网、线粒体、核糖体、甲基转移酶复合体、过氧化体基质和酶体、微体管腔以及细胞器、线粒体大核糖体亚基。生物学功能(molecular function,MF)主要是结合信号序列(见图4A)。
2.5KEGG通路富集分析 对DEGs进行KEGG通路富集,发现这些信号主要涉及核苷酸生物合成,核苷磷酸代谢,神经元凋亡、坏死和肽基-赖氨酸修饰等过程(见图4B)。
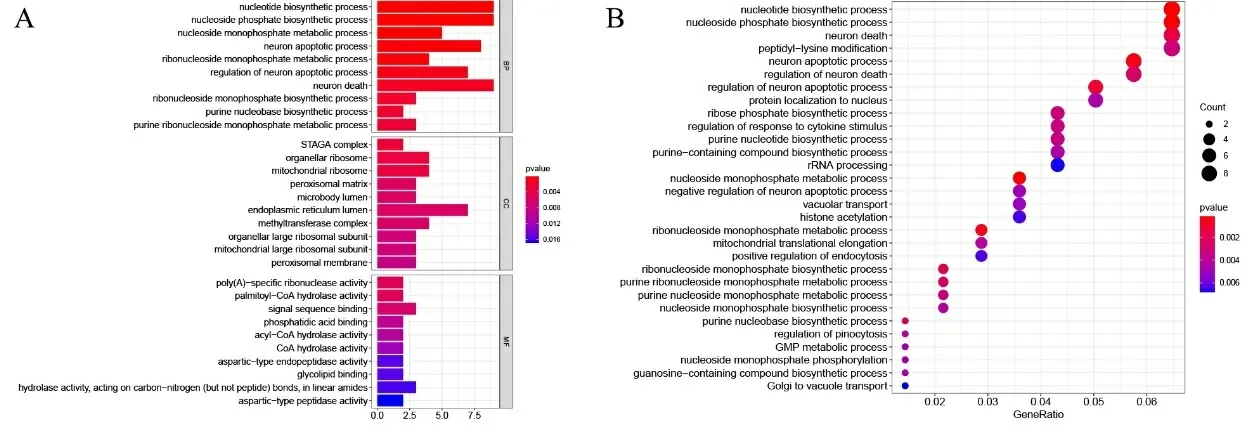
注:A.差异基因 GO 生物学过程富集分析排名前10位的注释情况;B.差异基因KEGG 通路富集分析
2.6蛋白质相互作用网络分析 通过在线数据库STRING 中的Multiple Protein构建蛋白相互作用网络,以P<0.05 为筛选条件时,154个 DEGs 编码的蛋白能够形成复杂的PPI(见图5)。而根据相互作用网络中蛋白与蛋白之间连接的节点数,筛选出受TGF-β调控的6个潜在关键基因CAT、GFM1、MRPS18B、RRP12、RRS1、CASP3。
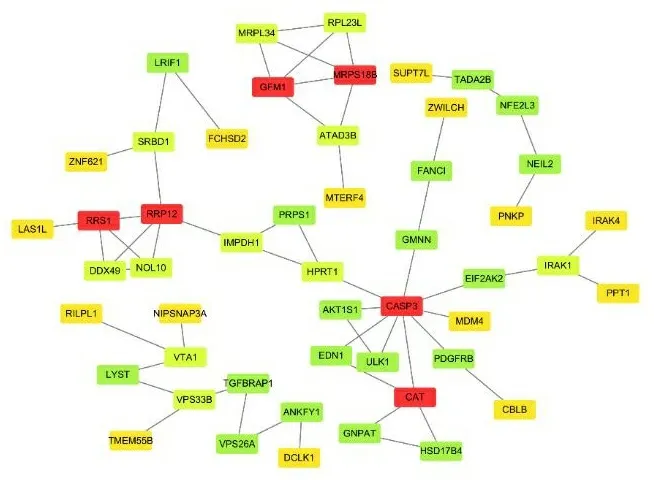
注:互作分数越高,颜色标记越红。
2.7TCGA数据库中差异基因表达和BLCA患者预后的关系 根据文献查询,DEGs中筛选出TGF-β调控的潜在关键基因TGFB1I1、HYOU1与膀胱癌的恶性程度和预后显著相关[9-10]。将差异表达分析和PPI筛选的潜在关键基因放入TCGA数据库进行膀胱癌组织和正常组织对比,发现TGFB1I1、COL16A1在BLCA组织表达量较低;HYOU1、ZWLCH基因在BLCA组织相对表达上调(见图6A;P<0.01)。其中,TGFB1I1和CAT高表达时,对BLCA患者生存有统计学意义(见图6B;P<0.05),并且当3个基因同时高表达时,BLCA患者的生存期较短(见图6C;P<0.05),潜在说明TGF-β刺激的成纤维细胞群与膀胱癌患者生存预后显著相关,可能是治疗的潜在靶点。
3 讨论
本研究通过对差异表达基因进行GO和KEGG的富集分析,发现DEGs主要富集在核苷酸合成、代谢的信号通路。由于核苷酸在人体内广泛分布,其主要生物学功能应当不容忽视,主要包括:①核苷酸是核酸的基本单位,可以储存能量,主要通过三磷酸核苷酸实现,特别是ATP,是给予细胞能量的主要形式。另外,一些活化的中间产物,如UDP-葡萄糖,亦含有核苷酸成分。②核苷酸可以参与生理和代谢调节:cAMP(或cGMP)是多种细胞膜激素受体的调节作用的第二信使,许多代谢过程也要受到体内ATP、ADP或AMP水平的调节。③核苷酸可以组成辅酶。如腺苷酸可作为NAD+、ANDP+、FMN、FAD及CoA等的组成成分[11]。此外,核苷酸还可在转录水平上受一系列主要转录因子的调控,亦在酶水平上受到变构调节和反馈抑制的调节,同时也参与细胞周期中的代谢和调节机制[12]。近年来,药物对肿瘤微环境的影响还尚不清楚,非肿瘤细胞在肿瘤免疫微环境中的代谢脆弱性被尤为关注[13]。因此,针对癌症核苷酸的合成与代谢的有关成纤维细胞的研究仍值得探索。
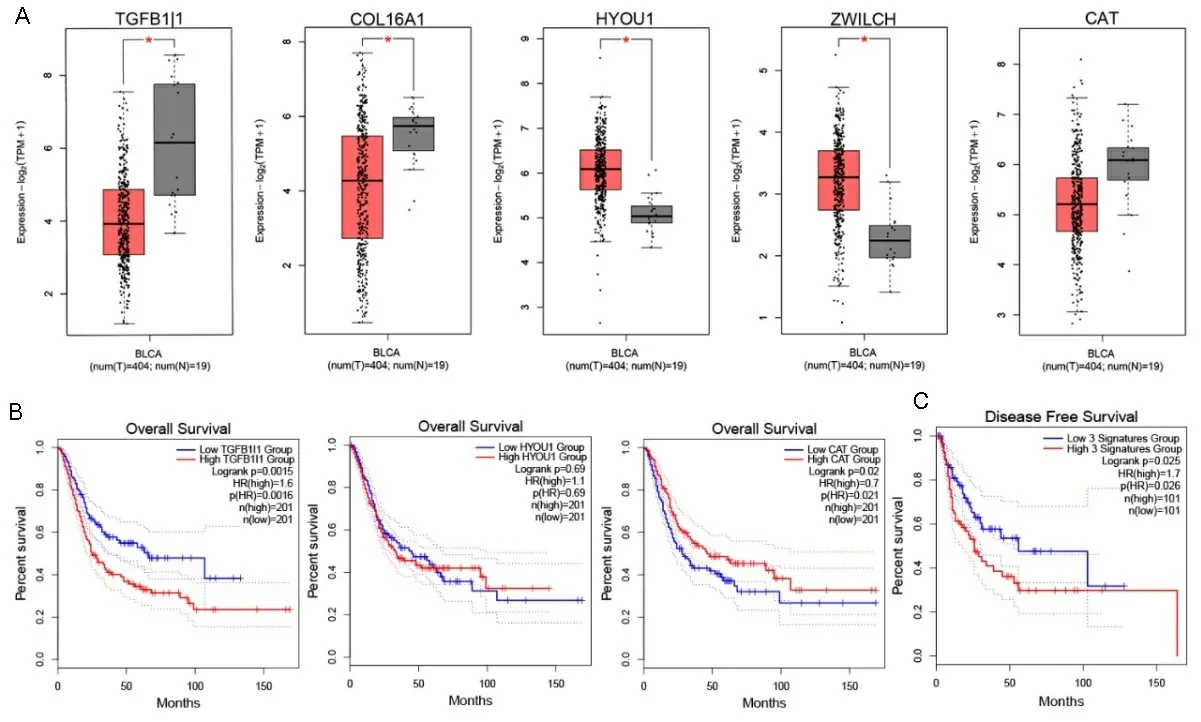
注:A.TCGA数据中TGFB1I1、COL16A1、HYOU1、ZWLCH、CAT 5个基因在膀胱癌与正常组织中的表达水平差异(红色表示膀胱癌,灰色表示正常);B.GEPIA2分析TGFB1I1、HYOU1、AT单基因高低表达对膀胱癌患者生存率的影响;C.TGFB1I1、HYOU1、CAT基因组合高低表达对膀胱癌患者生存率与生存分析关系。
本研究通过对PPI和生存预后的分析,还发现TGFB1I1、HYOU1和CAT等基因出现在多条富集的信号通路上,与多种生物学机制相关。TGFB1I1(也称为Hic-5)编码一种局部黏附支架蛋白,先前已被证明TGFB1I1与膀胱癌血管发育、细胞黏附及细胞外基质的形成有关,并与细胞外基质受体途径相关的基因有很强的相关性[10]。除此之外,TGFB1I1的表达还与巨噬细胞和NK细胞呈正相关。巨噬细胞在上调Ⅵ型胶原的合成和组装,诱导细胞外基质沉积等方面发挥着重要作用,研究者推测TGFB1I1还参与了浸润性免疫细胞和细胞外基质沉积之间的相互作用[14]。这可能与TGFB1I1在BLCA中都较正常组织更低表达,影响患者预后显著相关联;HYOU1是一种内质网伴侣蛋白,属于HSP70家族,在缺氧、缺糖、还原剂和衣霉素等应激条件下诱导表达[15]。HYOU1抗细胞凋亡作用主要包括:①抑制内质网应激相关的细胞凋亡通路;②HYOU1和ER应激感应器的结合可能使它们保持不活跃,从而抑制UPR;③激活Akt磷酸化作为生成磷脂酰肌醇3-激酶/Akt信号转导的一部分[16],膀胱癌中该基因的表达很可能也参与了以上的生物学过程;作为过氧化氢酶的CAT基因是人体内一种天然的、很重要的抗氧化酶,在活性氧的清除过程中作为超氧化物歧化酶的下游抗氧化蛋白,通过催化超氧阴离子自由基的自身氧化还原反应,有效清除自由基,维持体内自由基和氧化还原状态的动态平衡,来避免损伤机体的组织细胞[17]。同时,心血管危险因素常常导致由NADPH氧化酶、黄嘌呤氧化酶、线粒体电子传输链和功能障碍的内皮型一氧化氮合酶产生的活性氧物种的增加,超过抗氧化防御系统(如过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶、血红素加氧酶、对氧磷酶)的能力时,会导致氧化应激,从而促进动脉粥样硬化的形成,目前CAT也已成为心血管疾病研究的候选基因[18]。除此之外,过氧化氢酶C262T的变异与不同癌症之间的联系也被广泛报道,CAT C262T变异与总体癌症易感性有关,还可能与血液、骨髓、胃肠道、前列腺癌、皮肤癌和妇科癌症有关[19-20]。这些数据更加提示了差异基因TGFB1I1、HYOU1和CAT的表达可以调控肿瘤的发生发展,影响癌症患者预后,可能是BLCA一个潜在的肿瘤治疗靶点或预后监测指标,但还需多中心的临床数据进一步验证。

