不同剂量万古霉素对慢性心力衰竭大鼠心功能、肾功能及神经内分泌因子的影响及其血药浓度变化
丁小琼 王清传 王元标 张志敏
(新疆军区总医院1 派驻门诊部,2 干部保健科,3 心内科,新疆乌鲁木齐市 830000)
慢性心力衰竭(chronic heart failure,CHF)是心脏疾病发展至终末期的临床综合征,发病机制与心肌长期缺血导致心脏结构改变,心脏血流灌溉不足而无法维持组织代谢导致静脉系统淤血有关[1]。持续存在的心力衰竭状态可导致心肌重构,增加患者猝死的风险。CHF发生后心脏结构及功能改变会导致心室射血能力受损,主要表现为心室收缩能力减弱而不能满足机体代谢所需,因此提高心室收缩能力对于改善CHF患者的预后具有重要意义[2]。CHF的病理生理机制复杂,在对心脏功能产生影响的同时,还对肾脏、骨骼、内分泌及免疫系统产生影响[3]。CHF发生后,机体交感神经兴奋性增加,可导致循环系统中的血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)等因子表达异常,使心率加快、心肌耗氧量增加,促使心肌细胞凋亡与心脏重塑[4]。因此,明确CHF患者神经内分泌相关因子表达水平的变化情况可为CHF的治疗提供新方向。目前,CHF的发病人群以中老年人群为主,这类人群机体免疫力较低,更容易感染外界病原菌,进而出现病情加重,因此,给予抗感染药物治疗将有助于控制疾病进展[5]。有学者发现,采用万古霉素进行抗感染治疗可以改善CHF患者的临床疗效,但是长期使用不良反应较大,且随着万古霉素剂量的增加,其血药浓度升高,对患者肾脏损伤较大[6]。因此,本研究探讨不同剂量万古霉素对CHF模型大鼠的心功能、肾功能和神经内分泌因子水平的影响及其血药浓度变化,以期为临床用药选择提供参考。
1 材料与方法
1.1 实验动物 72只无特定病原体Wistar大鼠由基尔顿生物科技(上海)有限公司提供[动物许可证号:SYXK(上)2020-0006],雌雄各半,体重200~250 g,将大鼠饲养于动物房内,每5只分笼饲养,12 h光暗循环,无菌饮食喂养2周,按照《实验动物管理条例》规定进行实验。所有涉及动物的操作严格遵循实验动物伦理要求。
1.2 主要药物、试剂与仪器 青霉素(天津华津制药有限公司,批号:H12021257),盐酸万古霉素注射液[VIANEX S.A.(PLANTC)公司,批号:JX20130179],卡托普利(广州迈特兴华制药厂有限公司,批号:H44023128)。二喹啉甲酸蛋白浓度测定试剂盒(北京百奥莱博科技有限公司,批号:Y12851),GAPDH抗体(Abcam公司,批号:ab263962),苏木精-伊红试剂盒(北京索莱宝科技有限公司,批号:G1120),脲酶比色法试剂盒(BioVision公司,批号:K378-100),苦味酸比色法试剂盒、AngⅡ ELISA试剂盒、醛固酮ELISA试剂盒、心钠素ELISA试剂盒[齐一生物科技(上海)有限公司,批号:QYS-239313、QY-H5560、QY-H10272、QY-H10511],磺基水杨酸-硫酸钠比浊法试剂盒(北京百奥莱博科技有限公司,批号:GL1854)。低温高速离心机[河北慧采科技有限公司,型号:TGL-16A(B)]彩色多普勒超声诊断仪[大为医疗(江苏)有限公司,型号:S80],荧光显微镜(苏州景通仪器有限公司,型号:DFM-50C),全自动生化分析仪(Beckman Coulter Life Science Inc.,型号:AU5400),普通显微镜(OLYMPUS公司,型号:CKX53),蛋白电泳仪(北京六一生物科技有限公司,型号:DYCZ-MINI4),小动物呼吸机(北京金洋万达科技有限公司,型号:DW3000-B)。
1.3 CHF大鼠模型的建立 按随机数字表法选取60只大鼠,参考文献[7]建立CHF模型,建模前采用彩色多普勒超声诊断仪对大鼠心脏进行检查,确保心功能正常。通过腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉大鼠后将其仰卧位固定,连接小动物呼吸机,通气量为10 mL/kg,呼吸频率为80次/min,将大鼠四肢连接心电监护电极,于左前第4、5肋间开胸,皮肤切口长度为3 cm,钝性分离各层组织直至暴露心脏,于距离主动脉根部2 mm处采用6-0无创缝合丝线结扎冠状动脉左前降支,结扎后心室壁颜色变暗,心电图提示ST段抬高伴R波高尖,视为结扎成功。逐层缝合皮肤,待大鼠恢复自主呼吸后撤掉呼吸机。术后连续3 d使用青霉素(40万U)抗感染。4周后进行心脏彩超检查,以左心室射血分数(left ventricular ejection fraction,LVEF)<45%为建模成功。60只大鼠中,因感染导致死亡5只,其余55只大鼠建模成功。
1.4 分组及干预方法 将造模成功的55只大鼠按随机数字表法分为CHF组、低剂量万古霉素组、中剂量万古霉素组、高剂量万古霉素组、药物对照组,每组11只,剩余12只未造模的大鼠纳入假手术组(假手术组大鼠仅开胸暴露心脏,不结扎)。建模成功12 h后,分别给予低剂量万古霉素组、中剂量万古霉素组、高剂量万古霉素组大鼠尾部注射25 mg/kg、50 mg/kg、100 mg/kg盐酸万古霉素注射液,1次/d,连续干预14 d;药物对照组大鼠灌胃10 g/mL卡托普利,2 mL/次,1次/d,连续干预14 d;假手术组和CHF组灌胃等体积生理盐水,1次/d,连续干预14 d。
1.5 观察指标
1.5.1 心功能指标:干预14 d后,各组大鼠禁食12 h,不禁水。通过腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉大鼠后将其仰卧位固定,采用彩色多普勒超声诊断仪进行心功能检测,探头频率为11.4 MHz,图像深度为2.0~4.0 cm,探查深度为3.5 cm,检测左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、收缩末期内径(left ventricular end-systolic dimension,LVESD),依照文献[8]的方法计算LVEF和左室短轴缩短率(left ventricular fraction shortening,LVFS)。连续检测3次,取平均值。
1.5.2 肾功能指标:心功能指标检测结束后,采集大鼠眼眶静脉血1.5 mL,以3 000 r/min离心10 min后取上清液,采用脲酶比色法检查血清尿素氮水平,采用苦味酸比色法检测血清肌酐水平。在采血前24 h将大鼠分笼饲养收集尿液,采用磺基水杨酸-硫酸钠比浊法检测24 h尿蛋白(24-hour urinary protein,UP24)水平。上述检测方法均严格按照试剂盒说明书进行操作。
1.5.3 血清AngⅡ、醛固酮和心钠素水平:心功能指标检测结束后,采集大鼠空腹眼眶静脉血3 mL,以3 000 r/min离心10 min后取上清液,采用ELISA试剂盒检测血清AngⅡ、醛固酮及心钠素水平,操作方法严格按照试剂盒说明书进行。
1.5.4 组织病理学变化:完成上述指标检测后将大鼠麻醉处死,开胸取出心脏,分离心底大血管及右心室,生理盐水冲洗后用滤纸吸干,然后摘除肾脏,心脏及肾脏组织摘取过程中尽量减少机械损伤。心脏和肾脏组织经10%甲醛固定过夜,石蜡包埋后制成5 μm厚的切片,37 ℃复温15 min,二苯甲脱蜡后采用70%~100%乙醇梯度脱水,用蒸馏水冲洗5 min,切片先放入苏木精染色10 min后再用小流量自来水冲洗,1%盐酸乙醇褪色变红后停止操作,再用1%伊红复染30 s,蒸馏水冲洗30 s,85%-95%-95%乙醇脱水,二苯甲脱水透明,中性树胶封固,在光学显微镜下观察心肌组织及肾脏组织的形态及结构。
1.5.5 心肌组织AngⅡ、醛固酮和心钠素蛋白表达水平:取适量心肌组织样本,剪碎,加入预冷的PBS 1 mL,用组织匀浆器匀浆至无明显肉眼可见固体(或用液氮研磨),冰上静置5 min,4 000 r/min离心10 min后取上清液,采用二喹啉甲酸蛋白浓度测定试剂盒检测蛋白含量。将50 μg蛋白加入SDS凝胶加样缓冲液中,100 ℃加热处理5 min使蛋白变性。完成SDS-PAGE后进行转膜,结束后取下硝酸纤维素膜,在5%脱脂牛奶中4 ℃封闭1 h,然后分别加入10 μL AngⅡ抗体(深圳子科生物科技有限公司,货号:ZIKER-0587R;稀释比为1 ∶500)、10 μL醛固酮抗体(艾美捷科技有限公司,货号5331235-1;稀释比为1 ∶600)、10 μL心钠素抗体(上海恒远生化试剂有限公司,货号:A-01109;稀释比为1 ∶600),4 ℃孵育过夜,然后使用TBST洗膜3次,5 min/次,加入IgG辣根过氧化物酶标记二抗(北京博尔科技有限公司,货号:BHR201;稀释比为1 ∶1 000),温室孵育1 h,TBST洗膜3次,5 min/次。以GAPDH(稀释比为1 ∶2 000)为内参蛋白,用ECL工作液显影后,采用ProtParam 软件分析蛋白条带灰度值。实验重复3次。
1.6 吸波面积法检测万古霉素血药浓度
1.6.1 对照品储备液的配制:将5 mL盐酸万古霉素注射液置于25 mL容量瓶,加入适量甲醇,超声30 min,超声频率为42 kHz,再加甲醇定容至25 mL刻度线,摇匀,获得浓度为1.502 μg/mL的对照品储备液。
1.6.2 专属性试验:取0.4 mL大鼠空白血浆,加入3.6 mL甲醇,涡旋2 min后以3 500 r/min离心15 min。以甲醇作为参考,采用紫外可见分光光度法(北京中西华大科技有限公司生产的ZWKJ-SP-755型紫外可见分光光度计)在200~500 nm波长处进行全波长扫描,获得空白血浆的全波长扫描图。将浓度为1.502 μg/mL的对照品储备液1.2 mL加入空白血浆中,再次按上述方法进行全波长扫描,获得含对照品储备液的血浆样品的全波长扫描图。将两个全波长扫描图进行比较,得到空白血浆与含对照品储备液的血浆样品之间的吸光度值差值,以此去除空白血浆中内源性物质和其他成分的干扰。
1.6.3 标准曲线的建立:取0.4 mL大鼠空白血浆,加入适量对照品储备液,分别制成浓度为0.751 μg/mL、1.502 μg/mL、3.004 μg/mL的万古霉素样品溶液。采用紫外可见分光光度法在200~500 nm波长处进行全波长扫描,采用Origin 8.0软件计算吸光度-波长曲线下面积(area under the absorbance-wavelength curve,AUAWC)1。将加入甲醇的空白血浆作为对照(0.5 mL血浆+1.0 μL甲醇),再次按上述方法进行全波长扫描,获得AUAWC2,AUAWC1和AUAWC2的差值为△AUAWC。以药物浓度为横坐标,以AUAWC为纵坐标,绘制标准曲线,并计算得出药物吸波面积与药物浓度线性回归方程:△AUAWC=0.648×药物浓度+9.709(r=0.999),药物浓度在6.0~20.0 mg/L范围内则线性关系良好。
1.6.4 精密度检测:取0.4 mL大鼠空白血浆,加入适量对照品储备液,分别制成浓度为0.751 μg/mL、1.502 μg/mL、3.004 μg/mL的万古霉素样品溶液,在制成后的24 h内测定每个样品溶液的AUAWC,计算精密度,精密度(%)=标准偏差/实验值平均值×100%。0.751 μg/mL、1.502 μg/mL、3.004 μg/mL万古霉素样品溶液的精密度分别为5.5%、3.2%及1.2%,说明样品溶液的精密度良好,符合生物样品测定要求。
1.6.5 提取回收率的检测:取0.4 mL大鼠空白血浆,加入适量对照品储备液,分别制成浓度为0.751 μg/mL、1.502 μg/mL、3.004 μg/mL的万古霉素样品溶液,检测各样品溶液的AUAWC后,计算提取回收率,公式为K1=(A-B)/C×100%(A指加入标准物质的样品测得量,B指样品中该物质的测得量,C指加入的标准物质量)。0.751 μg/mL、1.502 μg/mL、3.004 μg/mL万古霉素样品溶液的提取回收率为99.52%、83.20%、79.86%,说明此方法的提取回收率良好,能满足样品溶液的测定要求。
1.6.6 不同剂量万古霉素组大鼠血药浓度的检测:取完成心功能检测后的低剂量万古霉素组、中剂量万古霉素组、高剂量万古霉素组大鼠的血浆(3 000 r/min离心15 min分离血浆),按照1.6.2的方法获取全波长扫描图,以大鼠空白血浆为对照,通过Origin 8.0软件计算万古霉素不同给药剂量不同时间段的AUAWC值,利用线性回归方程得到各时间段的药物浓度,以药物浓度为纵坐标,时间为横坐标,计绘制血药浓度-时间曲线。
1.7 统计学分析 采用GraphPad Prism 8软件进行统计学分析。计量资料以(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 6组大鼠心功能指标的比较 与假手术组相比,CHF组大鼠LVEDD、LVESD升高,LVEF、LVFS降低(均P<0.05);与CHF组相比,低剂量万古霉素组、中剂量万古霉素组、高剂量万古霉素组大鼠的LVEDD、LVESD均降低,LVEF、LVFS均升高(均P<0.05),且总体上呈剂量依赖性变化;高剂量万古霉素组与药物对照组的上述指标差异均无统计学意义(均P>0.05)。见表1。

表1 6组大鼠心功能指标的比较(x±s)
2.2 6组大鼠肾功能指标的比较 与假手术组相比,CHF组大鼠的血清肌酐、尿素氮水平和UP24水平均升高(均P<0.05);与CHF组相比,低剂量万古霉素组、中剂量万古霉素组、高剂量万古霉素组大鼠的血清肌酐、尿素氮水平和UP24水平均降低(均P<0.05)。与低剂量万古霉素组相比,中剂量万古霉素组大鼠的血清尿素氮、肌酐水平和UP24水平均降低(均P<0.05)。与中剂量万古霉素组相比,高剂量万古霉素组大鼠的血清肌酐水平和UP24水平均升高(均P<0.05)。与高剂量万古霉素组比较,药物对照组大鼠血清肌酐、尿素氮水平和UP24水平均降低(均P<0.05)。见表2。
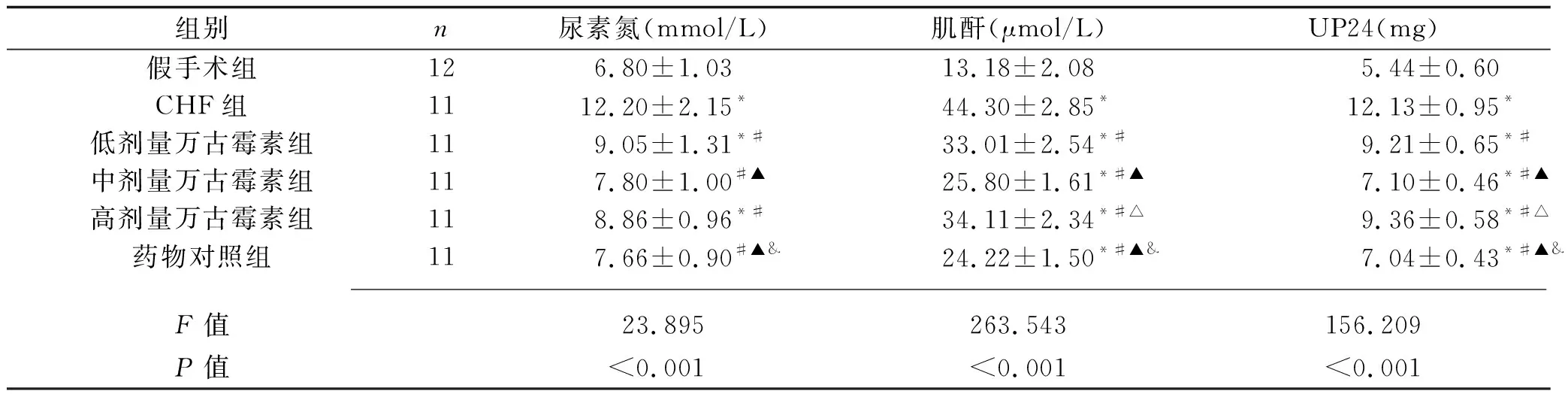
表2 6组大鼠血清肌酐、尿素氮水平和UP24水平的比较(x±s)
2.3 6组大鼠血清AngⅡ、醛固酮和心钠素水平的比较 与假手术组相比,CHF组大鼠的血清AngⅡ、醛固酮和心钠素水平均升高(均P<0.05);与CHF组相比,低剂量万古霉素组、中剂量万古霉素组、高剂量万古霉素组大鼠的血清AngⅡ、醛固酮和心钠素水平均降低(均P<0.05),且总体上呈剂量依赖性变化;高剂量万古霉素组与药物对照组大鼠上述指标差异均无统计学意义(均P>0.05)。见表3。
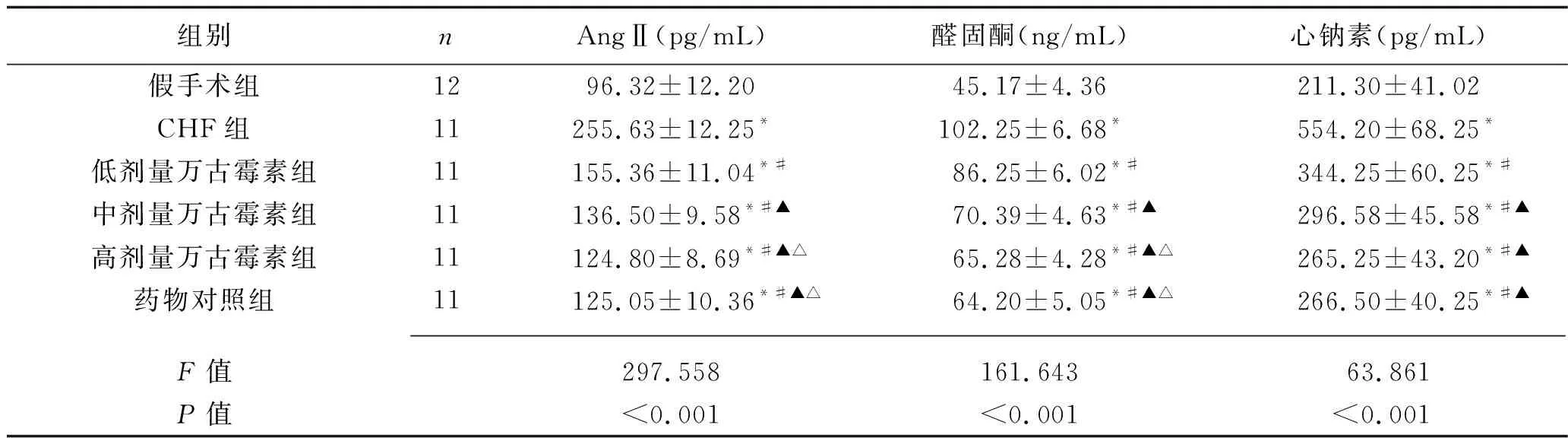
表3 6组大鼠血清AngⅡ、醛固酮和心钠素水平的比较(x±s)
2.4 6组大鼠心肌组织及肾脏组织病理形态 HE染色结果显示,假手术组大鼠心肌细胞轻微水肿,未见炎症细胞浸润和充血;CHF组大鼠心肌细胞水肿,细胞浆染色加深,细胞体积缩小,可见空泡;低剂量万古霉素组、中剂量万古霉素组大鼠心肌细胞结构较清晰,部分心肌细胞水肿,心肌细胞形态损伤较CHF组减轻,高剂量万古霉素组及药物对照组心肌细胞充血减少,心肌组织及细胞排列整齐,与假手术组相似。假手术组大鼠肾脏结构完好,肾小球形态规则,肾小管无水肿扩张;CHF组大鼠肾小球间质增加,肾小管上皮细胞排列紊乱、严重萎缩,肾间质增宽,炎症浸润严重;低剂量万古霉素组、高剂量万古霉素组大鼠肾间质宽度减小,炎症浸润降低,中剂量万古霉素组及药物对照组肾组织炎症浸润显著减轻,肾小球硬度降低,肾间质宽度与假手术组相似。见图1、图2。
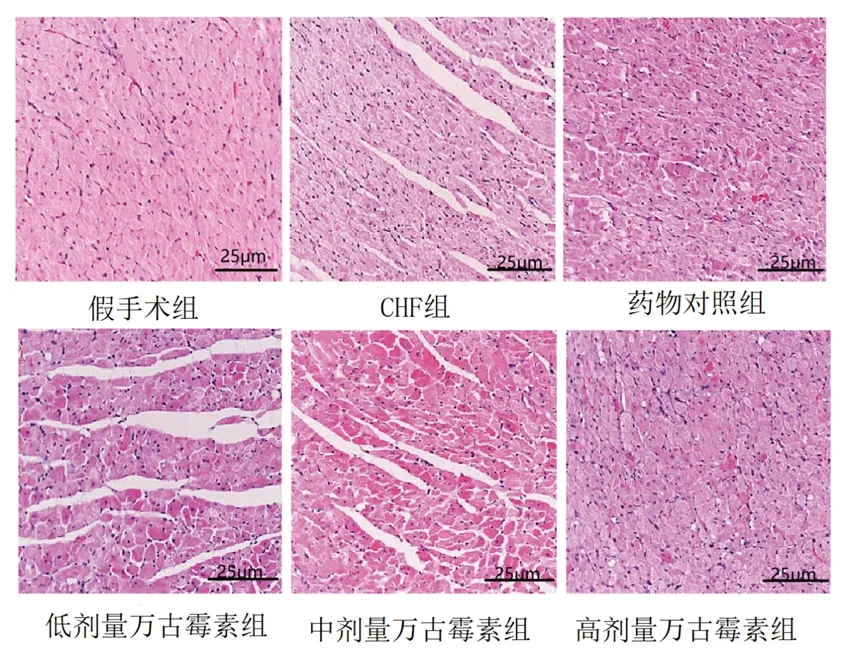
图1 6组大鼠心肌组织HE染色结果(×200)
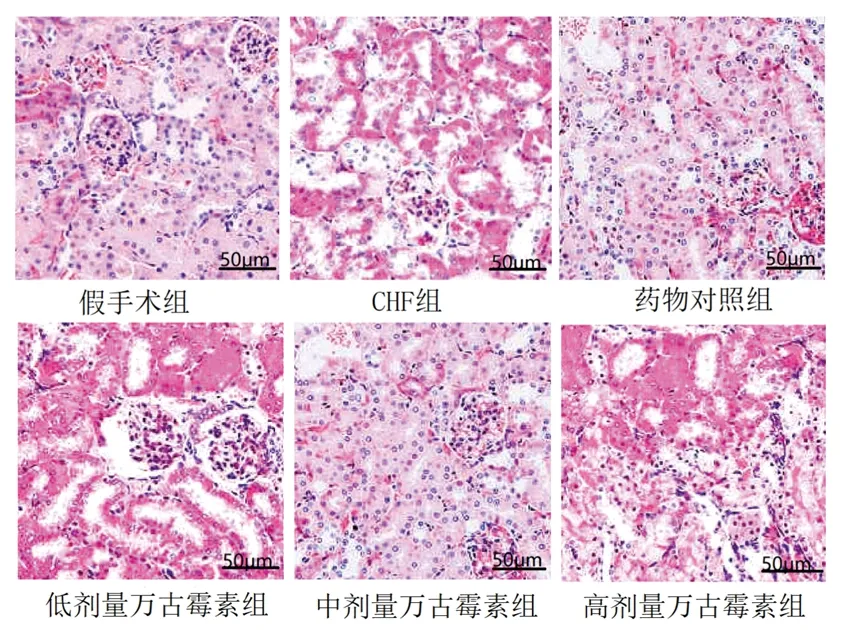
图2 6组大鼠肾脏组织HE染色结果(×400)
2.5 6组大鼠心肌组织AngⅡ、醛固酮和心钠素蛋白表达水平的比较 与假手术组相比,CHF组大鼠心肌组织AngⅡ、醛固酮和心钠素的蛋白表达水平均升高(均P<0.05);与CHF组相比,低剂量万古霉素组、中剂量万古霉素组、高剂量万古霉素组大鼠心肌组织AngⅡ、醛固酮和心钠素的蛋白表达水平均降低(均P<0.05),且总体上呈剂量依赖性变化;高剂量万古霉素组与药物对照组大鼠上述指标差异均无统计学意义(均P>0.05)。见表4、图3。

表4 6组大鼠心肌组织AngⅡ、醛固酮和心钠素蛋白相对表达水平的比较(x±s)

图3 蛋白电泳图
2.6 大鼠万古霉素血药浓度分析结果 低剂量万古霉素组血药浓度-时间曲线显示,血药浓度在用药后48 h时达到峰值为8.16 mg/L,此后血药浓度随着时间的延长而降低,在用药后96 h时血药浓度为0。中剂量万古霉素组血药浓度-时间曲线显示,血药浓度在用药后52 h时达到峰值,为12.63 mg/L,此后血药浓度随着时间延长而降低,在用药后144 h时血药浓度为0。高剂量万古霉素组血药浓度-时间曲线显示,血药浓度在用药后72 h时达到峰值,为16.30 mg/L,此后血药浓度随着时间延长而降低,在用药后96 h、122 h及148 h时血药浓度较稳定。见图4。

图4 不同浓度万古霉素血药浓度分析注:A为低剂量万古霉素组,B为中剂量万古霉素组,C为高剂量万古霉素组。
3 讨 论
CHF是多种病因诱发心脏功能或结构改变而导致机体循环瘀血等的病症。CHF是心脏疾病的终末阶段,病死率较高[8]。因此,了解其发病机制并进行针对性的干预治疗对控制疾病发展具有重要意义。CHF患者普遍存在心输出量减少、舒张末期容积增大、心室充盈压力增加,上述情况诱发心脏压力升高,导致LVEDD、LVESD升高,LVEF、LVFS降低[9]。CHF患者心肌组织存在不同程度的缺血,导致心室收缩不同步,LVEF及LVFS降低,从而影响心室收缩功能[10]。多数CHF患者合并肺部感染或肺水肿,压迫心脏,长期发展可加重病原菌对心肌组织的损伤。万古霉素为抗革兰阳性菌的首选药物,是临床上用于治疗发生感染的心脏疾病患者的主要抗菌药物[11]。万古霉素属于肽类抗菌药物,可破坏病原菌细胞壁结构,减少病原菌与细胞壁蛋白的合成,改变细胞膜通透性,阻碍细菌RNA的合成,从而发挥杀菌作用[12]。亓俊杰等[13]发现,万古霉素可通过抑制机体炎症因子水平,缓解CHF患者机体炎症反应,且在人体中血药浓度保持时间较长,可长时间发挥抗菌作用,从而缓解患者心脏负担,改善心功能,提高LVEF及LVFS,具有心肌保护作用。本研究结果显示,与假手术组相比,CHF组大鼠LVEDD、LVESD升高,LVEF、LVFS降低(均P<0.05),心肌组织病理损伤严重。此外,与CHF组相比,低剂量万古霉素组、中剂量万古霉素组、高剂量万古霉素组大鼠的LVEDD、LVESD均降低,LVEF、LVFS均升高(均P<0.05),且总体上呈剂量依赖性变化;HE染色结果显示低剂量万古霉素组、中剂量万古霉素组大鼠心肌细胞结构较清晰,部分心肌细胞水肿,心肌组织病理损伤减轻,高剂量万古霉素组心肌细胞充血减轻,心肌组织及细胞排列整齐。以上结果说明万古霉素可显著改善CHF大鼠的心功能及心肌组织病理损伤,而高浓度的万古霉素对心肌组织保护作用更显著。
肌酐、尿素氮及UP24均为评估肾功能的常用指标。肌酐水平能够较好反映肾小球功能损害情况;尿素氮主要反映肾小管重新吸收能力,其水平升高表示肾小管吸收能力减弱;UP24水平会随着肾损伤加重而升高,能够在一定程度上反映肾小球损伤情况。CHF患者心肌组织中的血管紧张素及醛固酮水平升高,可促进肾脏相关因子分泌,加重肾小球萎缩而降低肾功能[14]。万古霉素可直接减少病原菌遗传信息复制,进而有效抑制病原菌大量繁殖,从而减轻炎症损伤,在改善心肌损伤的同时,能降低血管紧张素及醛固酮的表达水平,减少肾损伤因子分泌,改善肾脏萎缩,但万古霉素主要经肾脏代谢,当万古霉素剂量增加时,血药浓度升高,可能会加重肾脏损伤[15]。李燕等[16]研究不同浓度万古霉素对患者急性肾损伤的影响,发现与使用浓度为10 mg/L万古霉素的患者相比,使用浓度为15 mg/L万古霉素干预的患者发生急性肾损伤的概率显著升高。本研究结果显示,与假手术组相比,CHF组大鼠的血清肌酐、尿素氮水平和UP24水平均升高(均P<0.05),大鼠肾小球间质增加,肾小管上皮细胞萎缩,提示CHF大鼠合并肾脏功能损伤。采用万古霉素干预后,各剂量万古霉素组大鼠的血清肌酐、尿素氮水平和UP24水平均降低,且肾组织病理损伤得到改善,其中中剂量万古霉素的效果优于高剂量万古霉素组,这可能与万古霉素经肾脏代谢,而高剂量的万古霉素会对肾脏造成损伤有关。
病理性的神经激素水平升高可以引发CHF症状,神经内分泌因子水平升高可导致心肌细胞肥大,促进心肌组织纤维化,且已有研究证实神经内分泌因子的过度激活是心力衰竭发生的原因之一[17]。心钠素、醛固酮及AngⅡ是与CHF关系密切的神经内分泌因子。心钠素水平升高可增加心肌细胞肥厚及间质纤维化;醛固酮激活可促进体内多种生物活性因子和激素异常活化,使机体产生代偿反应,进一步加重心力衰竭;AngⅡ水平升高可提高心肌组织胶原纤维的产生,从而促进心肌纤维化的发生与发展[18]。CHF发生后,机体循环系统功能障碍,万古霉素可通过抑制炎症细胞因子合成及炎症反应,改善神经内分泌系统的紊乱,从而改善CHF。神经内分泌因子及炎症因子存在双向调节作用,万古霉素可通过减少炎症因子来减轻心肌负荷和抑制心脏重塑,在一定程度上降低心钠素、醛固酮及AngⅡ的表达水平。本研究结果显示,与假手术组相比,CHF组大鼠血清和心肌组织中的心钠素、醛固酮及AngⅡ表达水平均升高(均P<0.05);与CHF组相比,低剂量万古霉素组、中剂量万古霉素组、高剂量万古霉素组大鼠血清和心肌组织中的心钠素、醛固酮及AngⅡ表达水平均降低(均P<0.05),且总体上呈剂量依赖性变化,说明万古霉素可调节CHF大鼠模型的神经内分泌因子表达水平,且以高剂量万古霉素的效果更显著。
本研究的万古霉素血药浓度分析结果显示,低剂量万古霉素组的血药浓度在用药后48 h时达到峰值(8.16 mg/L),在用药后96 h时血药浓度为0;中剂量万古霉素组的血药浓度在用药后52 h时达到峰值(12.63 mg/L),在用药后144 h时血药浓度为0;高剂量万古霉素组的血药浓度在用药后72 h达到峰值(16.30 mg/L),在用药后96 h、122 h及148 h时血药浓度较稳定。万古霉素属于大分子物质,在组织内的分布取决于细胞膜的通透性,长时间、高水平的血药浓度可有效增加药物转运,从而更好发挥药效[19]。师亚玲等[20]发现,万古霉素的药动学特点为具有浓度及时间依赖性,且存在较长的抗生素后效应,药物剂量越高,血药浓度越高,抗生素后效果持续时间越长。研究表明,万古霉素在大鼠体内均匀吸收、分布及排泄,不存在药物蓄积的风险,但是随着给药浓度的增加,血药浓度也不断升高,高浓度(200 mg/kg)万古霉素会加重肾毒性,因此需要针对性选择药物剂量,以减少不良反应[21]。
综上所述,不同剂量万古霉素干预均可改善CHF大鼠心功能与肾功能指标,其作用机制可能与万古霉素抑制神经内分泌因子AngⅡ、醛固酮和心钠素的表达水平有关;高剂量(100 mg/kg)万古霉素对CHF大鼠的心功能和心肌组织损伤的改善作用最佳,且血药浓度更为稳定,但会对肾脏造成一定损伤;中剂量(50 mg/kg)万古霉素对CHF大鼠的肾功能的改善作用最佳。

