维得利珠单抗治疗慢性复发型重度溃疡性结肠炎1例报告并文献复习▲
李绅绅 张 涛 卢 鑫 覃靖燊 周 旋
(1 广西中医药大学研究生院,广西南宁市 530001;2 广西中医药大学附属瑞康医院消化内科,广西南宁市 530011)
溃疡性结肠炎是一种反复发作的慢性非特异性肠道疾病,以腹痛、腹泻、黏液脓血便为主要症状,在全球范围内其发病率和患病率逐年上升[1]。溃疡性结肠炎的病因病机涉及遗传、环境、微生物群和黏膜免疫等诸多因素,目前尚未完全明确,并且仍缺乏诊断的金标准,容易导致误诊或漏诊,给患者造成过大的心理压力和沉重的经济负担[2]。由于溃疡性结肠炎的传统治疗药物如氨基水杨酸制剂、糖皮质激素、免疫抑制剂等存在耐药性、安全性等问题,因此新型治疗药物的探索和研究越来越受到关注。近年来,新型肠道专一靶向生物制剂维得利珠单抗(vedolizumab,VDZ)被用于治疗中重度溃疡性结肠炎。本文对1例接受VDZ治疗的慢性复发型重度溃疡性结肠炎患者的临床特点和诊疗过程进行总结,以期为生物制剂在溃疡性结肠炎中的临床应用提供参考。
1 病例资料
患者男性,61岁,因反复解脓血便伴腹痛13年余、再发加重4月余于2021年5月20日至广西中医药大学附属瑞康医院(简称我院)就诊。患者13年前无明显诱因出现解黏液脓血便,6~8次/d,伴腹胀痛,接受中药、西药治疗后症状可缓解,十几年来时有发病。4个月前患者上述症状再发,解黏液脓血便,5~6次/d,不规律服用美沙拉秦1.5 g/次(2次/d),症状偶有缓解。2个月前患者上述症状加重,患者解水样鲜红色血便,6~8次/d。于2021年3月12日至我院住院治疗,给予美沙拉嗪口服(4.0 g/次、1次/d)、美沙拉嗪泡沫灌肠液灌肠(4.0 g/次、每晚1次)及抗感染治疗,临床症状缓解,于3月31日出院。出院后规律服用美沙拉嗪(4.0 g、1次/d)并联合美沙拉嗪泡沫灌肠液灌肠(4.0 g、每晚1次),大便1~2次/d,无便血及黏液。1周前患者无明显诱因再次出现解黏液脓血便,6~8次/d,伴腹胀痛,遂于2021年5月20日再次至我院住院治疗。患者无饮酒及吸烟史。入院时体格检查:生命征平稳,下腹部轻压痛,无反跳痛,余查体无特殊。入院后,血常规检查提示白细胞计数15.94×109个/L,血红蛋白127 g/L,血小板计数409×109/L。C反应蛋白13.6 mg/L,血沉35 mm/h。肝功能检查提示白蛋白31 g/L,余无特殊。2021年5月21日、5月24日大便常规检查分别提示隐血(++++)、隐血(+);大便细菌培养(-),难辨梭状芽孢杆菌(-)。心肾功能、电解质、肿瘤标志物、HIV、HCV、梅毒螺旋体特异性抗体、免疫球蛋白、结核杆菌抗体、结核杆菌DNA、结核感染特异性T淋巴细胞、抗核抗体、巨细胞病毒DNA、巨细胞病毒免疫组化检查结果、EB病毒DNA、EB病毒免疫组化检查结果均未见异常。5月21日行肠镜检查,结果提示重度溃疡性结肠炎,镜下可见升结肠、横结肠、降结肠、乙状结肠、直肠黏膜表面粗糙、广泛弥漫性潮红、肿胀并存在连续性溃疡和糜烂灶,溃疡和糜烂灶质脆且接触易出血,升结肠见多发假息肉样黏膜隆起。肠镜下取组织行病理活检,结果提示符合溃疡性结肠炎的诊断特征:(1)升结肠息肉隆起组织呈活动性慢性肠炎表现,黏膜固有层存在弥漫性淋巴细胞、浆细胞、中性粒细胞及嗜酸性粒细胞浸润,可见隐窝变形、分支、扩张,抗酸染色(-);(2)升、横结肠黏膜组织呈活动性慢性肠炎表现,局灶黏膜糜烂,黏膜固有层存在弥漫性淋巴细胞、浆细胞、中性粒细胞及嗜酸性粒细胞浸润,可见隐窝变形、分支,抗酸染色(-);(3)降结肠、乙状结肠、直肠黏膜组织呈活动性慢性肠炎表现,局灶黏膜糜烂,黏膜固有层弥漫性淋巴细胞、浆细胞、中性粒细胞及嗜酸性粒细胞浸润,可见隐窝变形、分支、扩张,抗酸染色(-)。本病例的活检组织病理表现均为活动性慢性肠炎改变,病变以黏膜层为主,各部位损伤未见明显差异。见图1。
入院诊断为溃疡性结肠炎(E3型,慢性复发型,重度,活动期)。入院后给予美沙拉嗪口服(4.0 g/次,1次/d)联合美沙拉嗪泡沫灌肠液灌肠(4.0 g/次,每晚1次),以及双歧杆菌四联活菌片口服(1.5 g/次,3次/d)以调节肠道菌群,但治疗效果不佳,遂于5月27日起改用VDZ联合调节肠道菌群治疗。分别于第0周、第2周、第6周、给予VDZ(Takeda Pharmaceutical Company Ltd.,进口药品注册证号为S20200006)300 mg单次静脉输注, 先将药品用4.8 mL无菌注射用水充分复溶,然后加入250 mL的0.9%氯化钠溶液,静脉输注时间持续30 min以上。治疗2周后,患者大便次数逐渐减少,2~3次/d,无黏液脓血便,无明显腹痛。治疗6周后,患者大便1次/d,无黏液脓血便,无明显腹痛,炎症指标水平较前明显下降。2021年8月28日(第14周治疗前)行窗口期疗效评估。行无痛肠镜检查,镜下可见回盲部、升结肠、横结肠、降结肠肠腔形态正常,存在规则皱襞,黏膜表面粗糙;可见多发假息肉样黏膜隆起,但无异常分泌物、糜烂、溃疡及肿物;乙状结肠、直肠存在散在点片状糜烂,质脆,黏膜表面粗糙潮红。肠镜检查结果提示:(1)溃疡性结肠炎;(2)结肠多发假性息肉。病理检查结果提示:(1)乙状结肠组织呈慢性炎症表现;(2)直肠组织呈慢性炎症表现,局灶固有层淋巴组织增生。遂分别于2021年8月29日、10月22日、12月16日及2022年2月10日(即第14周、第22周、第30周、第38周)继续给予VDZ 300 mg静脉输注治疗。2022年2月10日(第38周治疗前)复查肠镜,结果提示:(1)溃疡性结肠炎治疗后改变;(2)结肠假性息肉形成。见图2。随后停用VDZ。出院3个月复查无痛肠镜、炎症指标、血常规、肝肾心功能、粪便常规等,此后每半年复查1次。电话随访截至2022年6月4日,患者无临床复发。
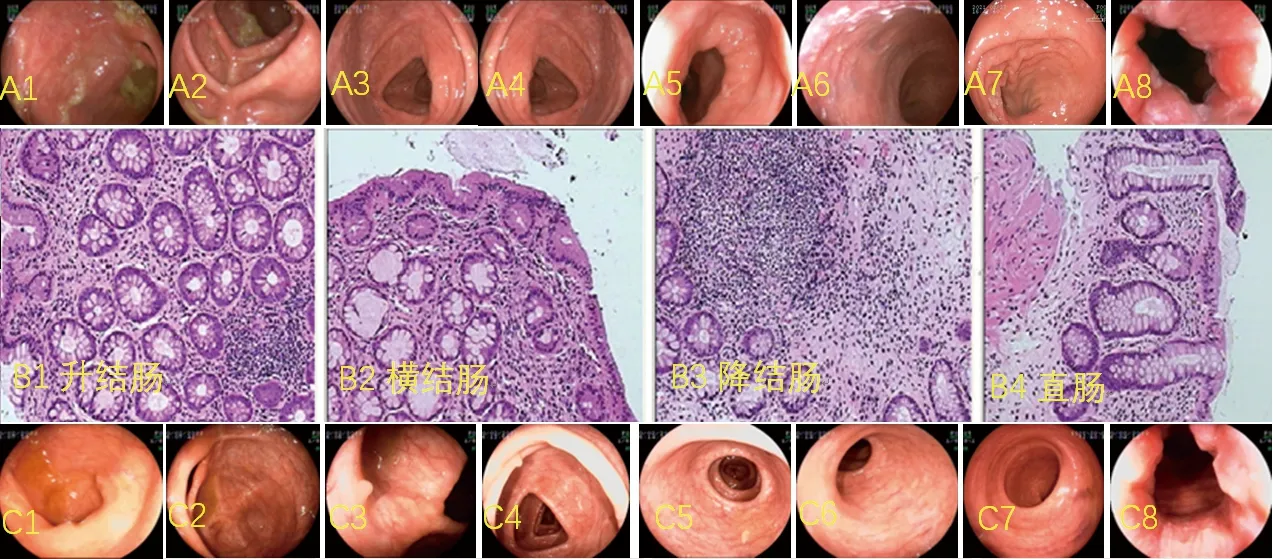
图2 VDZ治疗后患者的肠镜及病理检查结果注:A为VDZ治疗第14周肠镜检查结果;B为VDZ治疗第14周病理检查结果;C为VDZ治疗第38周肠镜检查结果。A1(C1)、A2(C2)、A3(C3)、A4(C4)、A5(C5)、A6(C6)、A7(C7)、A8(C8)对应回肠末端、回盲部、升结肠、横结肠、降结肠、乙状结肠、直肠、肛门内口的肠镜检查结果。
2 讨 论
溃疡性结肠炎治疗手段较多,目前主要有氨基水杨酸制剂、糖皮质激素、免疫抑制剂、生物制剂、微生物制剂、中药等药物治疗,以及粪菌移植、手术、饮食疗法等[3-4]。但传统治疗手段已经不能满足患者的需求,尤其是对于中重度溃疡性结肠炎患者,传统治疗药物面临诸多问题[5],特别是安全性、耐药性和应答性等方面的问题。因此,寻求一种新型、高效、安全的治疗手段逐渐成为研究的热点。VDZ是一种肠道专一靶向生物制剂药物[6],能特异性结合整合素α4β7,竞争性抑制炎症细胞归巢,减轻肠道炎症反应,从而发挥保护肠道的作用。在欧美国家VDZ早已被广泛应用于临床,主要用于对传统治疗不满意或肿瘤坏死因子α抑制剂应答不充分、失应答或不耐受的中重度活动性溃疡性结肠炎和克罗恩病的成年患者。然而,VDZ于2020年11月才在我国上市,且使用VDZ治疗中重度溃疡性结肠炎在我国鲜有报告,亦缺乏相应的诊疗经验。鉴于此,本文报告1例美沙拉嗪治疗失败后采用VDZ治疗的慢性复发型重度溃疡性结肠炎患者,并结合相关文献,总结治疗经验。
2.1 VDZ使用时机及用法 2020版《美国胃肠病协会炎症性肠病指南》建议,对于中重度溃疡性结肠炎患者应尽早使用生物制剂或联合使用免疫抑制剂,不推荐在5-氨基水杨酸治疗失败后再使用上述药物[7]。本例患者最后诊断为活动期E3型慢性复发型重度溃疡性结肠炎,对其采用VDZ治疗符合国内外临床指南、共识[8-11]及国家药品监督管理局发布的有关VDZ适应证的规定[12]。由于经济条件限制及医师诊治经验不足等,本病例患者未能在既往治疗过程中及时使用VDZ,加之患者治疗依从性差,导致前期治疗效果欠佳,病情反复。随着生物制剂的发展,可用于溃疡性结肠炎治疗的药物也逐渐增多。针对不同部位或分型的溃疡性结肠炎可选择最适宜的治疗药物方案进行精准治疗,这对于提升溃疡性结肠炎的治疗效果具有重要意义。值得注意的是,把握生物制剂的使用时机至关重要,对于中重度溃疡性结肠炎患者,尤其是存在疾病预后不良高危因素和安全性因素(如严重感染、恶性肿瘤史、老年等)的患者,应尽早使用生物制剂进行治疗,在合适的情况下,可以采取降阶梯治疗。此外,相较于经典一线生物制剂英夫利西单抗,VDZ可进行皮下注射,安全有效,更适用于中重度溃疡性结肠炎患者的长期维持治疗[13]。VDZ静脉注射剂型一般每次给药300 mg,分别在第0周、第2周、第6周及随后的每8周给药1次。本病例中在本院第2次住院时给予患者足量VDZ规律治疗,第14周窗口期评估结果提示患者症状明显改善,迅速实现了临床缓解和内镜缓解。
2.2 VDZ能够实现无激素临床缓解、内镜缓解及组织学愈合 传统激素疗法在中重度溃疡性结肠炎的治疗过程中具有药物难以减停、需要长期使用的缺点,从而极易造成心、脑、肝、肾、眼、皮肤、骨骼等多器官系统损害,增加并发症风险[14-15],因此如何实现无激素缓解显得尤为重要。短期治疗后肠道黏膜愈合与否对溃疡性结肠炎复发具有预测作用,因此黏膜愈合成为溃疡性结肠炎治疗的更高追求[16-18]。然而,有研究证实黏膜愈合和组织学愈合并不同步[19],部分患者即使同时达到临床缓解和内镜缓解,仍存在持续的组织学炎症,这使得复发风险、手术概率和癌变风险增加。近年来,有学者提出将组织学缓解作为溃疡性结肠炎的疗效指标[20]。Yoon等[21]开展的一项荟萃分析证实,达到组织学缓解的溃疡性结肠炎患者的临床复发风险明显降低,因此达到更严格的治疗目标即内镜缓解和组织学缓解尤为重要。目前生物制剂类型繁多,但VDZ具有其独特优势。一项研究显示,VDZ治疗中重度溃疡性结肠炎52周的临床缓解率、内镜缓解率和组织学缓解率均优于阿达木单抗[22]。Peyrin-Biroulet等[23]报告,在对肿瘤坏死因子α抑制剂应答不充分、失应答或不耐受的中重度活动性溃疡性结肠炎患者中,VDZ的疗效较阿达木单抗更佳,前者可获得更高的黏膜愈合率和组织学缓解率。上述研究均证实VDZ治疗中重度溃疡性结肠炎疗效显著。本病例患者在接受VDZ治疗2周后,临床症状明显缓解,大便次数逐渐减少,无黏液血便,无明显腹痛,血象、粪便常规等均恢复正常。第14周是VDZ治疗的重要时间点,也是免疫应答产生的关键时间点,此时复查评估,对于了解患者获益情况、决定下一步治疗方案至关重要。本病例中,第14周肠镜检查结果提示患者广泛性、连续性黏膜病变较前明显改善,只散在于乙状结肠和直肠,溃疡灶消失,病理检查提示大肠黏膜慢性炎,表明患者的内镜下表现和组织学表现均有改善。在治疗期间,本例患者未使用激素及免疫抑制剂等辅助治疗,实现无激素缓解和无激素维持治疗,这增加了治疗安全性,降低治疗费用,有助于提高患者治疗依从性。
2.3 VDZ临床安全性高 在溃疡性结肠炎的主要治疗药物中,VDZ的安全等级最高。多项研究证实,VDZ具有肠道专一性,感染风险、输注相关反应发生率、抗药抗体发生率、结核杆菌感染和肿瘤风险均低于同类生物制剂[24-26]。Singh等[27]比较了不同的一线和二线药物治疗中重度活动性溃疡性结肠炎的疗效和安全性,结果表明英夫利昔单抗和VDZ在诱导临床缓解和内镜改善方面的效果最佳,而VDZ的感染率最低,安全性最高。本例患者在接受VDZ治疗过程中,未出现过敏表现及治疗后感染、发热等并发症,安全可靠。但值得注意的是,合并肠道感染的溃疡性结肠炎患者应慎用VDZ。合并感染的患者接受VDZ治疗会有加重感染的风险,因此合并感染特别是活动性重度感染(如结核病、败血症、巨细胞病毒、李斯特菌)和机会性感染的患者不得使用VDZ,在感染控制后方可使用。对于治疗期间发生重度感染的患者,应暂停VDZ治疗。此外,对于慢性重度感染得到控制或有复发性重度感染病史的患者,应在治疗开始前、中、后,密切监测患者的感染情况。本病例患者入院时炎症指标水平升高,入院后经相关检查排除结核杆菌、巨细胞病毒、EB病毒及细菌等感染,给予VDZ治疗后,患者炎症指标水平下降,临床症状、内镜下表现、组织学表现均有好转。因此,该患者入院时炎症指标水平并非由肠道感染引起,考虑系溃疡性结肠炎自身炎症反应引起。
2.4 随访 定期随访有益于保证疗效和减少复发。高复发率是溃疡性结肠炎的重要特征,其最主要原因之一是患者治疗依从性差,尤其在缓解期这一问题更为突出。本例患者既往使用美沙拉嗪治疗时治疗依从性较差,效果不佳。因此本次患者出院后,我科多次电话随访,加强健康教育,以提高患者对疾病的认识水平,使其能积极参与治疗并保持良好的生活习惯。此外,黏膜愈合是溃疡性结肠炎治疗过程中必须考虑的问题,其不仅能够预测患者预后,还决定着治疗的策略和方向。因此,建议溃疡性结肠炎患者治疗3个月后复查1次肠镜,随后每半年复查1次。
3 小 结
VDZ是国际公认的治疗中重度溃疡性结肠炎患者的一线生物制剂,可以快速改善患者的核心症状,实现更高水平的治疗目标——黏膜愈合和组织学缓解。对于慢性复发型重度溃疡性结肠炎患者而言,应尽早使用VDZ,而非传统治疗手段无效后再使用。

