鲢幼鱼对氨氮胁迫的行为响应特征研究
计红 林育青 陈求稳 王骏 张元广 余世金 于道平

摘要:为了深入揭示城市水体中氨氮胁迫对鱼类生存和栖息地的影响,有必要针对特定鱼类对氨氮胁迫的行为响应进行探究。选择对氨氮较为敏感的重要经济鱼类鲢作为目标物种,通过氨氮急性毒性预实验确定氨氮浓度范围,设计“静水多室”实验装置, 开展鲢幼鱼对氨氮胁迫的行为响应实验。鲢幼鱼体长(5 ± 1)cm;实验条件为水温(25 ± 1)℃,pH 7.9 ± 0.1,溶解氧>9.0 mg/L,电导率约400 [μ]S/cm。结果表明,鲢幼鱼对氨氮的96 h半致死浓度为16.8 mg/L。鲢幼鱼行为响应实验中,氨氮浓度为0、0.5、1.0、5.0、10.0、20.0 mg/L单元中的鲢幼鱼平均分布率分别为44.4%、13.9%、4.9%、13.2%、13.2%和10.4%,相应的鲢幼鱼平均回避率分别为-58.0%、-48.1%、68.9%、20.8%、33.3%和37.5%。鲢幼鱼对氨氮胁迫的回避阈值小于1.0 mg/L(相对应的非离子氨浓度小于0.05 mg/L)。当氨氮浓度超过1.0 mg/L后,鲢幼鱼回避率呈现先下降再上升的变化趋势。鲢幼鱼能够探测到水体中的氨氮产生回避行为响应,其表现类型为“低浓度吸引、高浓度回避”。此外,氨氮浓度过高会导致鲢幼鱼的应激反应能力降低。研究结果可为进一步探讨氨氮胁迫对鲢幼鱼生存活动的影响提供依据。
关键词: 氨氮;鲢幼鱼;回避行为;回避实验
中图分类号:Q178.1 文献标志码:A 文章编号:1674-3075(2023)02-0120-08
随着工农业生产的高速发展和城镇人口的快速增长,大量污染物质进入城市水体,改变了水体的理化指标,引起水质恶化,影响用水安全。不仅如此,污染物质中一些半径较小的亲脂性分子容易穿透生物膜的疏水性微孔进入生物体内,影响其生物形态及生理指标,从而对水生生物造成损伤(刘娥,2013)。然而,这种伤害的前提是水生生物被动置于有毒的环境,并被迫吸入有毒物质。研究表明,鱼类对水环境中理化因子的变化极为敏感,通过嗅觉、味觉、视觉、 侧线及其他感受器官的生化、生理等变化,有些鱼类的辨别能力可以达到现代仪器无法检测到的精密程度,因此,对于水体中的有毒污染物,鱼类能够产生自然的“回避”行为,从而保护它们不受有毒物质的侵害(Tierney,2016)。鱼类这种对于污染物胁迫产生的快速响应行为在很多系统中都被观测到,如金鳟(Oncorhynchus mykiss)会对农药、酚、重金属、阻燃剂等多种类型的污染物产生回避(Folmar,1976;Carr et al,1990;Svecevi?ius,2001;Wells et al,2004);大鳞大麻哈鱼(Oncorhynchus tshawytscha)会对温排水和复杂有机混合物产生回避(Gray,1990;Smith & Bailey,1990);斑马鱼(Danio rerio)会对铜、酸矿废水和杀真菌剂产生回避(Moreira-Santos et al,2010;Araújo et al,2014a)。
尽管鱼类的这种回避行为可以帮助它们进行自我保护,如躲避排放的废污水(章敏等,1989;Sprague et al,1965),但也会对鱼类必要的生存活动(如洄游)造成干扰(Saunders & Sprague,1967)。更严重的,长期回避会导致鱼类从喜爱的栖息地迁移至生存条件(食物、繁殖、躲避等)较差的区域(Atchison et al,1987),在一定程度上改变鱼类的空间分布,进而影响整个生态系统的结构和功能,因此具有极大的生态风险(Robinson,2009;Araújo et al,2019)。
氨氮是水环境质量的常见表征因子,每年大量的氨氮通过污水排放、地表径流和大气沉降进入城市水体。氨氮中的非离子氨 (NH3)对鱼类具有较强的毒性,这一点被很多早期的研究所证实(姜礼燔,1983),在此基础上国内外学者对氨氮的急性毒理效应开展了大量研究(周莹等,2016;陈智威等,2019;Liu et al,2017),然而,鱼类对氨氮胁迫的行为响应研究较少,主要见于十刺鱼(Pygosteus pungitius)、南乳鱼(Galaxias maculatus)、胡瓜鱼(Retropinna retropinna)、大鮈塘鳢 (Gobiomorphus cotidianus)及鲢(Hypophthalmichthys molitrix)等报道(Jones,1948;姜礼燔,1983;Richardson et al,2001)。由于氨氮中的非离子氨浓度受水温、pH等因素的影响很大(刘娥,2013),实验条件不同,得出的结论也不尽相同,现有成果不宜直接引用。
为了深入揭示城市水体中氨氮胁迫对鱼类生存和栖息地的影响,有必要针对特定鱼类对氨氮胁迫的行为响应进行探究。本文选择对非离子氨反应非常敏感的鲢幼鱼(王梦杰等,2019)作为实验对象,通过氨氮急性毒性预实验和鲢幼鱼在不同氨氮浓度下的行为响应实验,分析鲢幼鱼对氨氮胁迫的行为响应特征,为进一步探索城市河道废污水排放生态风险分析与鱼类栖息地保护提供科学依据。
1 材料与方法
1.1 实验鱼
实验鲢幼鱼购于水产市场,体长(5 ± 1)cm,实验开始前在实验室水族箱驯养2周,每2 d换水1/3,投喂1次,实验开始前24 h停止喂食。实验用水为经充分曝气的自来水,其水质指标如下:水温(25 ± 1)℃,pH7.9 ± 0.1,溶解氧> 9.0 mg/L,电导率约400 [μ]S/cm。
1.2 实验方法
1.2.1 氨氮急性毒性预实验 采用 96 h静水式实验法对鲢幼鱼进行氨氮急性毒性预实验,确定其24、48、72、96 h的半数致死浓度LC50,以确定回避实验中氨氮浓度范围,防止浓度过高引起鲢幼鱼死亡。
采用干燥分析纯晶体 NH4Cl(分析纯)配制不同浓度的氨氮溶液(5、10、20、40 mg/L),挑选体质健康、大小均匀的鲢幼鱼各10尾放于水族箱中。每组氨氮浓度设置3个重复。日曝气12 h,且日换水1次,换水率 30%。实时观察幼鱼中毒症状,并做好死亡个体记录,及时捞出死亡个体,防止因水质变坏影响实验结果 。
1.2.2 鲢幼鱼行为响应实验 为了排除其他因素(如流速)的干扰,研究参照Araújo等(2014a;2014b;2014c)提出的“静态多室无压系统”设计了满足本实验需求的实验装置(图1)。该装置由6个首尾相接的单元串联而成,每个单元由2个去底的聚对苯二甲酸乙二醇酯瓶汇接而成,长度为25 cm,单元上部开口(6 cm × 4 cm),整个实验装置总长为150 cm。各单元中氨氮浓度依据氨氮毒性预实验结果及我国地表水环境质量标准确定为0、0.5、1.0、5.0、10.0和20.0 mg/L,其中0.5 mg/L和1.0 mg/L分别对应我国地表水II、III类水体氨氮浓度标准。
实验在安静、光线均匀的环境中开展。首先开展对照实验。在实验装置中充入清水(每个单元300 mL),每个单元中放入2条鲢幼鱼(共12条),2 h内通过红外摄像机每30 min记录鲢幼鱼在各单元中的数量,实验开始和实验结束后分别测水温、DO、pH和电导率,整个实验持续2 h,重复3次。开展鲢幼鱼的行为响应实验时,先往每个单元中注入不同浓度的氨氮溶液(每个单元300 mL),其中单元1内为无氨氮的清水。为保持氨氮浓度梯度,实验开始前各单元间用橡皮塞隔开,每个单元中放入2条鲢幼鱼(共12条),实验开始后通过镊子迅速去除各单元间的橡皮塞,2 h内通过红外摄像机每30 min记录鲢幼鱼在各单元中的数量,实验开始和实验结束后分别测水温、DO、pH和电导率,重复3次。依据实验结果,计算和分析鲢幼鱼对各氨氮浓度的喜好或回避。
1.3 数据分析
采用spss软件分析急性毒性预实验和回避实验结果。采用卡方检验分析对照实验中的分布均匀性,采用图基检验分析不同实验单元分布的显著性差异。采用 Probit法(贾春生,2006)计算96 h半致死浓度及其置信区间。
鲢幼鱼分布率的计算公式为:
D = [NoN][×]100% ①
式中:[No]为各单元出现的鲢幼鱼数;N为单次实验的鲢幼鱼总数。
回避(或喜好)率的计算公式为:
A [=Nc-NoNc×100]% ②
式中:[Nc]为对照实验各单元出现的鲢幼鱼数;[No]为回避实验中各单元出现的鲢幼鱼数。
非离子氨与氨氮的换算公式为(张武肖等,2015):
[CNH3=1.216×CNH3-N×f/100]
[f=100/(10pKa-pH+1)] ③
[pKa=0.09018+2729.92/T]
式中:[CNH3]为测定温度和pH值下水样中的非离子氨浓度,mg/L; [C][NH3-N]为水样中的氨氮浓度,mg/L;f为非离子氨的摩尔百分比,%;T为水样的开氏温度,K。
2 结果与分析
2.1 氨氮急性毒性预实验
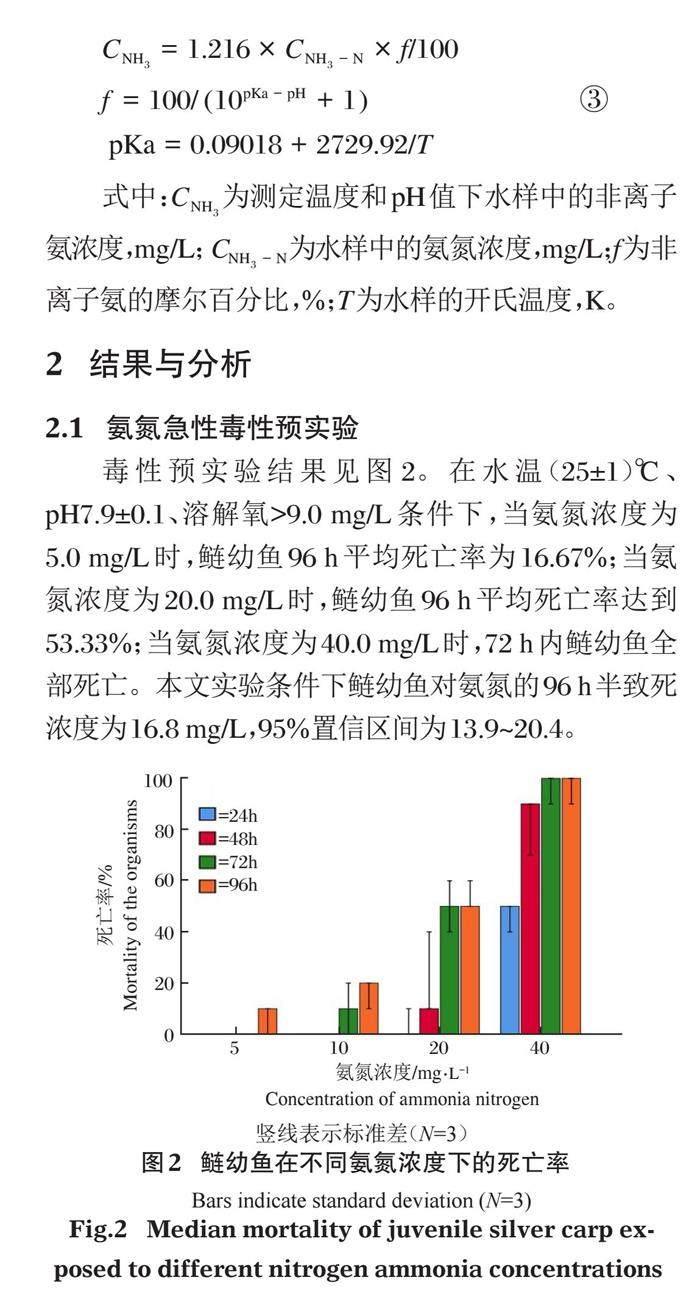
毒性预实验结果见图2。在水温(25±1)℃、pH7.9±0.1、溶解氧>9.0 mg/L条件下,当氨氮浓度为5.0 mg/L时,鲢幼鱼96 h平均死亡率为16.67%;当氨氮浓度为20.0 mg/L时,鲢幼鱼96 h平均死亡率达到53.33%;当氨氮浓度为40.0 mg/L时,72 h内鲢幼鱼全部死亡。本文实验条件下鲢幼鱼对氨氮的96 h半致死浓度为16.8 mg/L,95%置信区间为13.9~20.4。
2.2 鲢幼鱼在不同浓度下的行为响应
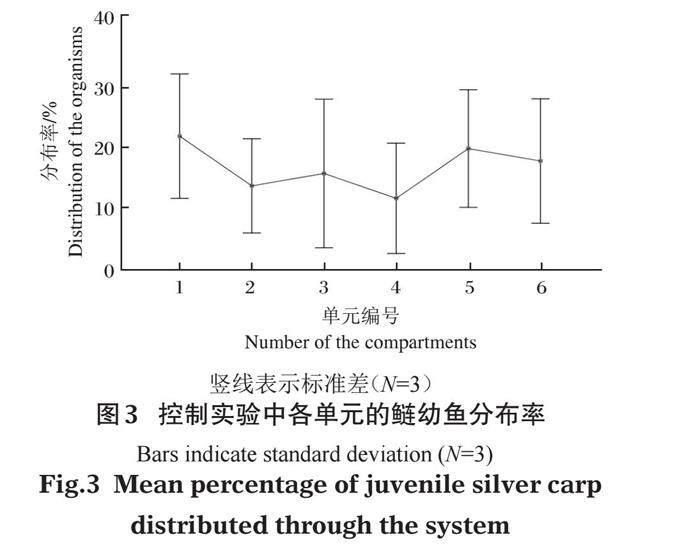
实验过程中未见个体死亡。对照实验整个过程中鲢幼鱼分布不随时间变化(ANOVA: F=0.000,P=1.000,N=48)且分布均匀(卡方检验:P=0.131)。如图3所示,控制实验中各单元的鲢幼鱼平均分布率分别为21.9%、13.5%、15.6%、11.5%、19.8%和17.7%。
回避实验的双因素方差分析结果表明,鲢幼鱼分布不随时间变化(F=0.000,P=1.000,N=72),但受浓度影响(F=7.869,P<0.05,N=72)。如图4所示,氨氮浓度为0、0.5、1.0、5.0、10.0、20.0 mg/L单元中的鲢幼鱼平均分布率分别为44.4%、13.9%、4.9%、13.2%、13.2%和10.4%。根据鲢幼鱼分布计算出的回避率,见图5。0 、0.5、1.0、5.0、10.0、20.0 mg/L单元中的鲢幼鱼平均回避率分别为 -58.0%、-48.1%、68.9%、20.8%、33.3%和37.5%。实验结束后,各单元的平均氨氮浓度分别为0.99、1.35、2.19、7.78、9.03和18.82 mg/L。
由图5可以看出,鲢幼鱼对0.5 mg/L以下和1.0 mg/L以上的氨氮浓度响应表现明显不同。当氨氮浓度小于0.5 mg/L时,鲢幼鱼数量较对照实验有所增加(回避率均为负值),鲢幼鱼对该浓度范围表现出喜好(preference);当单元内氨氮浓度大于1.0 mg/L时,鲢幼鱼数量较对照实验有所减少(回避率为正值),鲢幼鱼对该浓度范围表现出回避,且在1.0 mg/L时回避率最高。当氨氮浓度超过1.0 mg/L后,鲢幼鱼回避率有所下降,氨氮浓度为5.0 mg/L时回避率最低,之后又开始回升。
3 讨论
3.1 氨氮对鲢的急性毒理效应
早在20世纪上叶,国外学者就研究过氨对鱼类的毒性,对鱼类起毒性作用的是氨氮中的非离子氨,鱼类受氨中毒后,鱼类粘液增多,表皮细胞充血,损害肝肾及肠道组织,还会使血红蛋白丧失结合氧的能力,呼吸率及心跳率增加,并使血浆中钠含量减少,扰乱血液缓冲系统及酶化学作用(刘娥,2013)。陈惠等(1994)的研究表明,与鲤、草鱼相比,鲢[全长(5.14±0.24)cm,体重(0.84±0.165)g]对氨的毒性最为敏感,其对非离子氨的96 h半致死浓度为0.712 mg/L[水温(20±1)℃,pH7.14±0.16];徐镜波和马逊风(1994)的研究表明,鲢在13℃时的非离子氨96 h半致死浓度为0.38 mg/L;Wang等(2017)的研究表明,孵化后5 d大的鲢仔鱼对非离子氨的96 h半致死浓度为0.35 mg/L,相应条件下[水温(19±0.1)℃、pH8.63±0.1,溶解氧(7.6±0.2) mg/L]的氨氮96 h半致死浓度为30.8 mg/L。
在本文实验条件下[水温(25±1)℃,pH7.9±0.1,溶解氧>9.0 mg/L,电导率约400 [μ]S/cm]的实验结果表明,体长为(5±1)cm的鲢幼鱼对氨氮的96 h半致死浓度为16.8 mg/L,换算成相应的非离子氨浓度为0.87 mg/L。由于鲢幼鱼大小、体重以及水温、pH值等实验条件的不同,本文结果与前人结果有所差异。
3.2 氨氮胁迫对鲢幼鱼的行为学影响
3.2.1 行为响应实验装置 回避实验装置是研究鱼类回避行为的基本工具,目前主要有管道型、双槽/多槽型、“流动多室无压系统”和“静态多室无压系统”。早期的管道型回避装置由Jones(1947)在研究十刺鱼对乙醇、氯仿、福尔马林、氯化汞和硫酸锌的回避反应时设计并提出,其优点是鱼类反应的敏感性高、效果好,缺点是操作不便,不适应实验需要。双槽型回避装置由清水槽和污水槽于混合区联结构成,通过鱼类进入左槽或右槽的数量计算回避率(姜礼燔和王鸿太,1982;Degraeve,1982;Carr et al,1990),该装置操作简便,但每次实验只能设置某个特定浓度,不符合污染物在水体中的实际分布。“流动多室无压系统” (Lopes et al,2010;Moreira-Santos et al,2010)能够反映污染物在水体中的梯度分布,但形成的浓度不可调节。Araújo等(2014a;2014b;2014c;2016;2018)从经济、节省能耗的角度出发设计了“静态多室无压系统”,并利用这一装置开展了不同水生生物对铜、农药、杀虫剂、多环芳烃等污染物的回避行为的一系列研究 。“静态多室无压系统”中各实验单元中的水是静止的,单元中的污染物浓度是可以任意设定的。Araújo 等(2014a)认为“回避”是一种快速响应的行为,只要实验时间被控制在合理的范围内(如4 h),污染物浓度梯度的稳定性可以得到有效保证,因而是一种有效的研究鱼类回避行为的装置。
3.2.2 鲢幼鱼对氨氮的行为响应表现类型 综合目前研究成果,鱼类对有毒染物的行为响应主要有3种类型,分别为不回避、某一阈值触发回避、由浓度决定吸引或回避3种表现类型(Beitinger,1990;姜礼燔等,2004;Tierney,2016)。如鱼类对内毒素、敌草快、草甘膦、三氯乙酸、林丹五种农药以及勒伦酸硒不产生回避(Summerfelt & Lewis,1967;Halter et al,1980;Beitinger,1990),而在Beitinger和 Freeman(1983)的研究中,包括氯胺、丙烯醛、镉、二甲胺、铁、镍、氰化钠、甲苯等在内的28种化学污染物均在某一阈值引起了实验鱼类的回避行为。还有些实验案例中,鱼类对污染物展现出“高浓度回避、低浓度吸引”的行为特征,如Folmar(1976)的研究中,二甲苯浓度达到0.1 mg/L时虹鳟显著回避,但是对于0.01 mg/L的二甲苯有明显被吸引的行为;Beitinger(1990)认为总余氯、总残余氧化剂、氯化一级出水和氨这些污染物也会引起鱼类在高浓度回避和低浓度吸引。某些学者的研究表明,鱼类对马拉硫磷和铜这2种污染物表现出“低浓度回避、高浓度吸引或不回避”的行为特征,如食蚊鱼(Gambusia affinis)在浓度为50 mg/L时对马拉硫磷产生回避,而当马拉硫磷的浓度高达5 000 mg/L时食蚊鱼没有回避(Halter et al,1980);虹鳟(Oncorhynchus mykiss)会对10~200 mg/L的铜产生回避,却会被300~390 mg/L的铜吸引(Giattina & Garton,1983)。
在本实验条件下[水温(25±1)℃,pH7.9±0.1,溶解氧>9.0 mg/L,电导率约400 [μ]S/cm]的结果表明,当氨氮浓度为0.5 mg/L时,鲢幼鱼表现出明显的偏爱(平均回避率为 -48.1%)。当氨氮浓度升高到1.0 mg/L后,鲢幼鱼对氨氮的响应行为表现为回避。因此,鲢幼鱼对氨氮胁迫做出的行为响应表现为“低浓度吸引、高浓度回避”,与姜礼燔(1983)、Jones(1948)和Richardson等(2001)的实验中其他鱼类对氨氮的响应表现类型一致。
3.2.3 鲢幼鱼对氨氮的回避阈值 Beitinger 和Freeman(1983)的研究表明,28种化学污染物中的25种在浓度小于1 mg/L时均引起了实验鱼类的回避行为,其中90%的回避阈值小于其他文献报道的致死浓度,只有小部分污染物的回避阈值超过了其致死浓度,如石油烃、毒杀芬、丙烯醛 、煤浆中的水溶性部分以及镉(Kynard,1974;Weber,1981;Dauble et al,1985)
本实验条件下,鲢幼鱼在0.5~1.0 mg/L这一浓度区间对氨氮由喜爱转为回避,显然引起幼鱼由喜爱转为回避的氨氮浓度阈值小于1.0 mg/L。若按鲢幼鱼回避率在0.5~1.0 mg/L线性变化推算,引起鲢幼鱼回避的氨氮浓度阈值为0.55 mg/L。姜礼燔(1983)的研究结果为,鲢幼鱼在氨氮浓度为0.51 mg/L时回避率为 -33%,在氨氮浓度为0.75 mg/L时回避率为42.8%,推算回避阈值约为0.61 mg/L,与本文结果接近。根据非离子氨与总氨的换算关系,本实验条件下1.0 mg/L氨氮相对应的非离子氨浓度为0.05 mg/L,该值略大于我国《渔业水质标准(GB11607-89)》中的非离子氨浓度限值(0.02 mg/L)。鲢幼鱼回避阈值远远小于本实验得出及其他文献报道的96 h半致死浓度值,表明回避行为可以有效保护鲢幼鱼免受有毒物质的侵害。
3.2.4 高浓度氨氮的生理麻痹效应 污染物浓度过高引起的感官麻痹会阻止或妨碍鱼类逃生(Robinson,2009;Araújo et al,2018),如Tierney(2016)的研究表明,高浓度的阿特拉律会影响鱼类的神经生理学反应以及基于嗅觉的行为响应,从而降低实验鱼类对其他物质的偏好,做出行为改变。本实验中,当氨氮浓度超过1.0 mg/L后,随着氨氮浓度升高,鲢幼鱼回避率并未呈现正相关变化趋势,而是在氨氮浓度为5.0 mg/L时降到最低点,然后逐渐回升。这一现象与氨氮浓度过高导致鲢幼鱼的生理指标变化和应激反应能力降低有关。在自然环境中,当氨氮浓度为2 mg/L时,鲢幼鱼的肝脏和鳃仍能保持正常形状;而当氨氮浓度达到10和20 mg/L时,鲢幼鱼的肝细胞会出现浑浊肿胀及水样变化,鳃会出现基底上皮增厚伴随毛细血管扩张和氯细胞增生(Wang et al,2017)。相比于自然环境,由于无法对氨氮进行转化和吸收,实验室中氨的毒性应该更大。如Richardson等(2001)曾发现,南乳鱼、胡瓜鱼和大鮈塘鳢对高浓度非离子氨(7.8~9.2 mg/L)均没有明显的回避行为。
3.2.5 水质指标对实验结果的影响 对鱼类产生毒性作用的是氨氮中的非离子氨,其在水体中的含量主要受pH、水温、溶解氧和含盐量等水质指标的影响。pH是影响水环境中非离子氨和离子氨含量的最为重要的因素之一,当水体中pH升高,非离子氨的比例增加,水体毒性增强(Broderius et al,1985),引起鱼类回避的氨氮阈值减小;反之,pH降低时非离子氨的比例减少,毒性随之减弱,氨氮阈值会有所增加。
由于离子氨向非离子氨的转化是一个吸热过程,因此水温是影响非离子氨含量的另一主要因素。水温升高,氨氮中的非离子氨浓度增加,氨氮毒性呈增大的趋势(沈成钢和鲍文奎,1995),将导致氨氮阈值进一步减小。因此要更加留意温度较高水域氨氮对鱼类的行为学效应和生态风险。
非离子氨含量还受到水体中溶解氧含量的影响。在富氧状态下,水体中有效氮以硝态氮为主,而在缺氧状态下以氨态氮为主,鱼类对氨氮的耐受性减弱(李波等,2009),从而降低引起鱼类回避的氨氮阈值。高盐度会抑制硝化菌和反硝化菌产生,进而影响水体中的硝化作用,使水体中的非离子氨含量增加,毒性增强,氨氮阈值降低(刘娥,2013)。
参考文献
陈惠,王丽华,刘兰,1994. 氨对鱼类毒性的研究[J].水产学杂志,7(2):55-61.
陈智威,许然,南泽,等,2019. 不同浓度氨氮胁迫下长蛸(Octopus minor)的半致死浓度和急性毒性评估[J].海洋与湖沼,50(6):1361-1369.
姜礼燔,王鸿太,1982. 鱼类对水污染回避反应的机制及实验装置[J].环境污染与防治,(2):38-41.
姜礼燔,1983. 氨对鱼类的毒性影响试验[J].环境污染与防治,(3):19-22.
姜礼燔,樊俊峰,宗网华,2004. 在不同药物及其不同施药浓度中鱼类的行为反应[J].当代水产,29(3):44-45.
李波, 樊启学, 张磊,等,2009.不同溶氧水平下氨氮和亚硝酸盐对黄颡鱼的急性毒性研究[J].淡水渔业,39(3):31-35.
刘娥,2013. 草幼鱼对氨氮胁迫的形态及生理学响应[D].济南:山东大学.
贾春生,2006. 利用SPSS软件计算杀虫剂的LC50[J].应用昆虫学报,43(3):414-417.
沈成钢,鲍文奎,1995. 氨态氮在低温下对鱼的急性毒性研究[J].大连海洋大学学报,10(3):58-64.
王梦杰, 陈建华,王海华,2019. 氨氮对水产动物的毒性效应研究进展[J].江西水产科技, (2):38-43.
徐镜波,马逊风,1994. 温度、氨对鲢、鳙、草、鲤鱼的影响[J].中国环境科学,14(3):214-219.
章敏,周风帆,丁树荣,1989. 白鲢对常州市主要工业废水及部分有机毒物的回避反应[J].南京大学学报(自然科学版),(4):122-128.
张武肖,孙盛明,戈贤平,等,2015. 急性氨氮胁迫及毒后恢复对团头鲂幼鱼鳃,肝和肾组织结构的影响[J].水产学报,39(2):233-244.
周莹,孙梨宗,刘志红,等,2016. 氨氮对斑马鱼3种酶活性和基因表达的影响[J].沈阳师范大学学报(自然科学版),34(1):88-91.
Araújo C V M,Shinn C,Mendes L B,et al,2014a. Avoidance response of Danio rerio to a fungicide in a linear contamination gradient[J].Science of the Total Environment,484(1):36-42.
Araújo C V M,Shinn C,Moreira-Santos M,et al,2014b. Copper-driven avoidance and mortality in temperate and tropical tadpoles[J]. Aquatic Toxicology,146:70-75.
Araújo C V M,Shinn C,Vasconcelos A M,et al,2014c. Preference and avoidance responses by tadpoles: the fungicide pyrimethanil as a habitat disturber[J]. Ecotoxicology,23(5):851-860.
Araújo C V M,Moreira-Santos M,Ribeiro R,2016. Active and passive spatial avoidance by aquatic organisms from environmental stressors: A complementary perspective and a critical review[J]. Environment International,(92/93):405-415.
Araújo C V M,Silva D C V R,Gomes L E T,et al,2018. Habitat fragmentation caused by contaminants: Atrazine as a chemical barrier isolating fish populations[J].Chemosphere,193:24-31.
Araújo C V M,Gonzalez-Ortegon E,Pintado-Herrera M G,et al,2019. Disturbance of ecological habitat distribution driven by a chemical barrier of domestic and agricultural discharges: An experimental approach to test habitat fragmentation[J].Science of the Total Environment, 651:2820-2829.
Atchison G J,Henry M G,Sandheinrich M B,1987. Effects of metals on fish behavior:a review [J]. Environmental Biology of Fishes,18(1):11-25.
Beitinger T L,Freeman L,1983. Behavioral avoidance and selection responses of fishes to chemicals[J].Residue Reviews,90(10):35-55.
Beitinger T L,1990. Behavioral reactions for the assessment of stress in fishes[J]. Journal of Great Lakes Research,16(4):495-528.
Broderius S,Drummond R,Fiandt J,et a1,1985. Toxicity of ammonia to early life stages of the smallmouth bass at four pH values[J].Environmental Toxicology and Chemistry,4(1):87-96.
Carr R S,Barrows M E,Reichenbach N G,et al,1990. Investigation of preference-avoidance responses to an oil refinery effluent with striped bass and steelhead trout[J].Environmental Toxicology and Chemistry,9(12):1513-1521.
Dauble D D,Gray R H,Skalski J R,et al,1985. Avoidance of a water-soluble fraction of coal liquid by fathead minnows[J].Transaction of the American Fisheries Society,114(5):754-760.
Degraeve G M,1982. Avoidance response of rainbow trout to phenol[J].The Progressive Fish-Culturist,44(2):82-87.
Folmar L C,1976. Overt avoidance reaction of rainbow trout fry to nine herbicides[J]. Bulletin of Environmental Contamination and Toxicology,15(5):509-14.
Giattina J D,Garton R R,1983. A review of the preference-avoidance response of fishes to aquatic contaminants[J]. Residue Reviews,87(12):43-90.
Gray R H,1990. Fish behavior and environmental assessment[J].Environmental Toxicology and Chemistry,9(1):53-67.
Halter M T,Adams W J,Johnson H E,1980. Selenium toxicity to Daphnia magna,Hyallela azteca, and the fathead minnow in hard water[J].Bulletin of Environmental Contamination and Toxicology,24(1):102-107.
Jones J R E,1947. The reactions of Pygosteus pungitius to toxic solutions[J].Journal of Experimental Biology,24(1/2):110-122.
Jones J R E,1948. A further study of the reactions of fish to toxic solutions[J].J Exp Biol,25:22-34.
Kynard B,1974. Avoidance behavior of insecticide susceptible and resistant populations of mosquitofish to four insecticides[J]. Transaction of the American Fisheries Society,103(3):557-561.
Liu Z,Li X,Tai P,et al,2017. Toxicity of ammonia, cadmium, and nitrobenzene to four local fishes in the Liao River,China and the derivation of site-specific water quality criteria[J].Ecotoxicology and Environmental Safety,147:656-663.
Lopes I,Baird D J,Ribeiro R,2010. Avoidance of copper contamination by field populations of Daphnia longispina[J].Environmental Toxicology and Chemistry,23:1702-1708.
Moreira-Santos M,Donato C,Lopes I,et al,2010. Avoidance tests with small fish: determination of the median avoidance concentration and of the lowest-observed-effect gradient[J].Environmental Toxicology and Chemistry,27(7):1576-1582.
Richardson J,Williams E K,Hickey C W,2001. Avoidance behavior of freshwater fish and shrimp exposed to ammonia and low dissolved oxygen separately and in combination[J]. New Zealand Journal of Marine & Freshwater Research,35(3):625-633.
Robinson P D,2009. Behavioral toxicity of organic chemical contaminants in fish: application to ecological risk assessments (ERAs)[J].Candian Journal of Fisheries and Aquatic Sciences, 66(7):1179-1188.
Saunders R L,Sprague J B,1967. Effects of copper-zinc mining pollution on a spawning migration of Atlantic salmon[J].Water Research,1(6):419-432.
Smith E H,Bailey H C,1990. Preference/avoidance testing of waste discharges on anadromous fish[J]. Environmental Toxicology and Chemistry,9(1):77-86.
Sprague J B,Elson P F,Saunders R L,1965. Sublethal copper-zinc pollution in a salmon river-A field and laboratory study//[M].Advances in Water Pollution Research:Proceedings of the Second International Conference Held in Tokyo:61-82.
Summerfelt R C,Lewis W M,1967. Repulsion of green sunfish by certain chemicals[J].Water Pollution Control Federation,39(12):2030-2038.
Svecevi?ius G,2001. Avoidance response of rainbow trout Oncorhynchus mykiss to heavy metal model mixtures: a comparison with acute toxicity tests[J].Bulletin of Environmental Contamination and Toxicology,67(5): 680-687.
Tierney K B,2016. Chemical avoidance responses of fishes[J].Aquatic Toxicology,174:228-241.
Wang H J,Xiao X C,Wang H Z,et al,2017. Effects of high ammonia concentrations on three cyprinid fish: Acute and whole-ecosystem chronic tests[J].Science of the Total Environment, 598(15):900-909.
Weber D,1981. Avoidance Reactions of Juvenile Coho Salmon (Oncorhynchus kisutch) to Monocyclic Aromatics[J].Canadian Journal of Fisheries and Aquatic Sciences,38(7):772-778.
Wells J B,Little E E,Calfee R D,2004. Behavioral response of young rainbow trout (Oncorhynchus mykiss) to forest fire-retardant chemicals in the laboratory[J].Environmental Toxicology and Chemistry,23:621-625.
(责任编辑 郑金秀)
Behavioral Response of Juvenile Silver Carp to Ammonia Nitrogen Stress
JI Hong1,3,LIN Yu‐qing2,CHEN Qiu‐wen2,WANG Jun2,ZHANG Yuan‐guang1,YU Shi‐jin1,YU Dao‐ping3
(1. School of Resources & Environment,Anqing Normal University,Anqing 246133,P.R. China;
2. Eco-Environmental Research Department,Nanjing Hydraulic Research Institute,
Nanjing 210029,P.R. China;
3. Engineering & Technology Research Center of Higher Education Institute in Anhui Province for
Aquatic Organism Protection and Aquatic Ecological Restoration,Anqing 246133,P.R. China)
Abstract:Silver carp, an important economic fish species that is sensitive to ammonia nitrogen was selected for study in this investigation. We studied the behavioral response of silver carp to ammonia nitrogen, aiming to better understand the effect of ammonia nitrogen toxicity on fish survival and habitat in urban waters. The concentration range of ammonia nitrogen for testing was determined based on the literature value of acute ammonia nitrogen toxicity. The 96-hour LC50 reported for silver carp [BL = (5 ± 1) cm] is 16.8mg/L. Based on the result, six ammonia nitrogen concentrations (0, 0.5, 1.0, 5.0, 10.0, 20.0 mg/L) were set for the test, and a "static multi-compartment" experimental device was designed for the behavioral response experiment, with a different ammonia nitrogen concentration in each compartment. The experimental conditions were as follows: water temperature (25 ± 1)℃, pH (7.9 ± 0.1), dissolved oxygen > 9.0 mg/L, conductivity 400 [μ]S/cm. The fraction of test fish in each compartment was recorded and the avoidance rate was calculated. The average distribution of juvenile silver carp in the six compartments were, respectively, 44.4%, 13.9%, 4.9%, 13.2%, 13.2% and 10.4% , and the corresponding average avoidance rates were, -58.0%,-48.1%,68.9%,20.8%,33.3% and 37.5%. The avoidance threshold of juvenile silver carp to ammonia nitrogen was estimated to be < 1.0 mg/L, with a corresponding non-ionic ammonia concentration < 0.05mg/L. When the concentration of ammonia nitrogen exceeded 1.0 mg/L, the avoidance rate of juvenile silver carps decreased initially and then increased. Our study shows that juvenile silver carp detect and avoid ammonia nitrogen, and display a behavioral pattern of attraction at low concentration and avoidance at high concentration. The avoidance threshold is far less than the lethal concentration reported in the literature, so the avoidance response can effectively protect juvenile silver carps from ammonia nitrogen toxicity. However, at very high concentrations of ammonia nitrogen the behavioral response of juvenile silver carp is diminished and increases vulnerability toward ammonia-nitrogen toxicity. This study provide a basis for further research on the effect of ammonia nitrogen toxicity on the survival of juvenile silver carp.
Key words:ammonia nitrogen;juvenile silver carp;avoidance behavior;avoidance test

