乌原鲤仔鱼摄食和饥饿耐受能力研究
李娟 杨波 董微微 阙延福 朱滨 乔晔


摘要:研究乌原鲤(Procypris merus)仔鱼早期培育过程的摄食特点和饥饿耐受力,为苗种规模化培育提供技术支撑。试验缸为玻璃烧杯(1 L),置于恒温水浴锅中;试验用水为经过24 h曝气的地下水,无天然生物饵料;水温20~22℃;仔鱼随机分为3组(摄食组、饥饿1组、饥饿2组),每组500尾仔鱼,每组设置3个重复,静水养殖;摄食组每日投喂3次丰年虫。结果显示,乌原鲤仔鱼5日龄开口摄食,初次摄食率15 %,5~9日龄为混合营养期,8日龄初次摄食率达100 %,并维持到14日龄;15日龄后呈下降趋势,在19日龄时降至45 %,达到饥饿不可逆点。饥饿胁迫对乌原鲤仔鱼全长、体长、体高、肛前长、眼径等生长指标有极显著影响(P<0.01)。在水温20~22℃条件下,可在乌原鲤仔鱼6日龄开始投喂适口饵料,不迟于10日龄,生产中可根据实际情况观察乌原鲤仔鱼肠道贯通、卵黄囊消耗等情况,掌握仔鱼初次投喂时机。
关键词:乌原鲤;仔鱼;饥饿;摄食率;摄食强度;饥饿不可逆点
中图分类号:Q178 文献标志码:A 文章编号:1674-3075(2023)02-0089-07
乌原鲤(Procypris merus)隶属于鲤形目鲤科鲤亚科原鲤属,地方名乌勾、黑鲤、乌鲫、墨鲤,分布于珠江流域西江水域红水河、桂江、柳江、左江、右江等支流,是珠江水系特有鱼类(朱瑜,2006)。乌原鲤被《中国脊椎动物红色名录》列为濒危(Endangered,EN)物种(蒋志刚等,2016),被《国家重点保护野生动物名录》(国家林业和草原局和农业农村部,2021)列为国家Ⅱ级重点保护野生动物。由于乌原鲤具有迁移习性,自然环境的改变导致适宜乌原鲤生存的生境不断减少(李育森等,2019),加之洄游通道受阻,自然繁殖生态条件发生改变,难以满足其自然繁殖需求,乌原鲤自然群体不断萎缩,物种延续存在不确定性。通过人工增殖放流补充野外资源量是保护乌原鲤的重要补救措施之一,开展乌原鲤人工繁殖,实现规模化苗种培育迫在眉睫。
在自然水域生态系统中,饥饿是鱼类经常面临的一种生理胁迫现象,也是影响鱼类生长发育及生存的重要环境因子,仔鱼期是鱼类对环境条件最敏感的生活阶段,而饥饿是导致仔鱼死亡的重要原因之一(Blaxter &Hempel,1963)。卵黄囊期阶段是仔鱼从内源性营养向外源性营养转化的重要阶段,仔鱼需建立主动摄食能力才能完成从内源性营养向外源性营养的转化,以维持正常的生长发育(李艳秋等,2014)。饥饿不可逆点(point of no return, PNR)是从生态学角度测量仔鱼饥饿耐受能力的一项重要指标,即初次摄食仔鱼耐受饥饿的时间临界点,仔鱼饥饿至PNR时,即使没有死亡,但50%个体已经丧失了主动摄食的能力,进入生态死亡阶段(Blaxter &Hempel,1963)。通过饥饿试验确定仔鱼初次摄食率和不可逆点,对鱼类早期生活史研究及鱼苗培育有重要意义。
关于仔鱼饥饿试验及不可逆点确定的研究有较多报道(张海发等,2006;黄洪贵等,2010;宋勇等,2019;张建明等,2020),目前尚未见针对乌原鲤的研究。本文选用乌原鲤初孵仔鱼进行饥饿试验,研究饥饿胁迫对乌原鲤仔鱼生长、发育、存活、卵黄囊消耗、初次摄食率以及摄食强度的影响,并确定乌原鲤仔鱼的PNR,掌握乌原鲤仔鱼初次投喂的时机,为提高乌原鲤仔鱼的成活率和规模化培育提供技术指导。
1 材料与方法
1.1 试验材料
1.1.1 仔鱼来源 2021年3-4月,在广西来宾市红水河鱼类保护增殖站进行人工繁殖试验。人工催产乌原鲤亲鱼,通过挤压腹部获得成熟鱼卵和精子,干法授精获得受精卵,在循环水系统中流水孵化获得仔鱼。
1.1.2 生物饵料 试验用的生物饵料为丰年虫。丰年虫卵在水温27~29 ℃、盐度20 的水体中孵化。
1.1.3 试验条件 初孵仔鱼置于试验缸中培育,试验缸为玻璃烧杯(1 L),置于恒温水浴锅中静水养殖。试验用水为经过24 h曝气的地下水,无天然生物饵料;每日换水和吸污1次,换水量为50%。试验期间采用YSI水质分析仪记录水体理化参数,水温维持在20~22 ℃,氨氮含量处于安全范围,溶解氧>6.0 mg/L。
1.2 试验设置
选用同批次初孵仔鱼放置在试验缸中暂养,试验前将仔鱼随机分为3组(摄食组、饥饿1组、饥饿2组),每组500尾仔鱼,每组设置3个重复,分开放置于不同的养殖缸。摄食组每日投喂3次丰年虫,饥饿组不投喂饵料。试验时长为试验开始至饥饿1组试验鱼全部死亡的时间。
1.3 指标及测定
1.3.1 形态学指标 每日观察记录仔鱼生长发育、死亡及摄食情况,同时在投喂组和饥饿1组中各随机取10尾仔鱼,在体视显微镜下测量并记录全长、体长、体高、肛前长、眼径、鳔长、鳔高、卵黄囊长、卵黄囊高等。
卵黄囊和鳔形状为椭球形,卵黄囊和鳔体积计算公式:
y=[43][π]([R2])2L/2 ①
式中:R为卵黄囊(鳔)高,L为卵黄囊(鳔)长。
开鳔率=鳔充气仔鱼数/样本仔鱼数×100 %。
1.3.2 初次摄食率和初次摄食强度 乌原鲤仔鱼开口后,每天在饥饿2组中取20尾仔鱼,放到有效水体1 L的容器中,投喂丰年虫,摄食2 h后取出仔鱼,在体视显微镜下解剖消化道,记录每尾仔鱼摄食丰年虫数,并计算仔鱼初次摄食率和初次摄食强度。
初次摄食率=摄食仔鱼数/样本仔鱼数×100%。
初次摄食强度=摄食仔鱼消化道内丰年虫数/样本仔鱼数。
1.3.3 PNR 当所测定的仔鱼初次摄食率低于最高初次摄食率的一半时,乌原鲤仔鱼的日龄即为PNR。
1.4 统计分析
试验所得数据使用Excel 2013和SPSS 20.0进行统计分析及制图,并以t检验比较分析饥饿组和摄食组仔鱼的生物学指标。
2 结果与分析
2.1 乌原鲤仔鱼生长情况
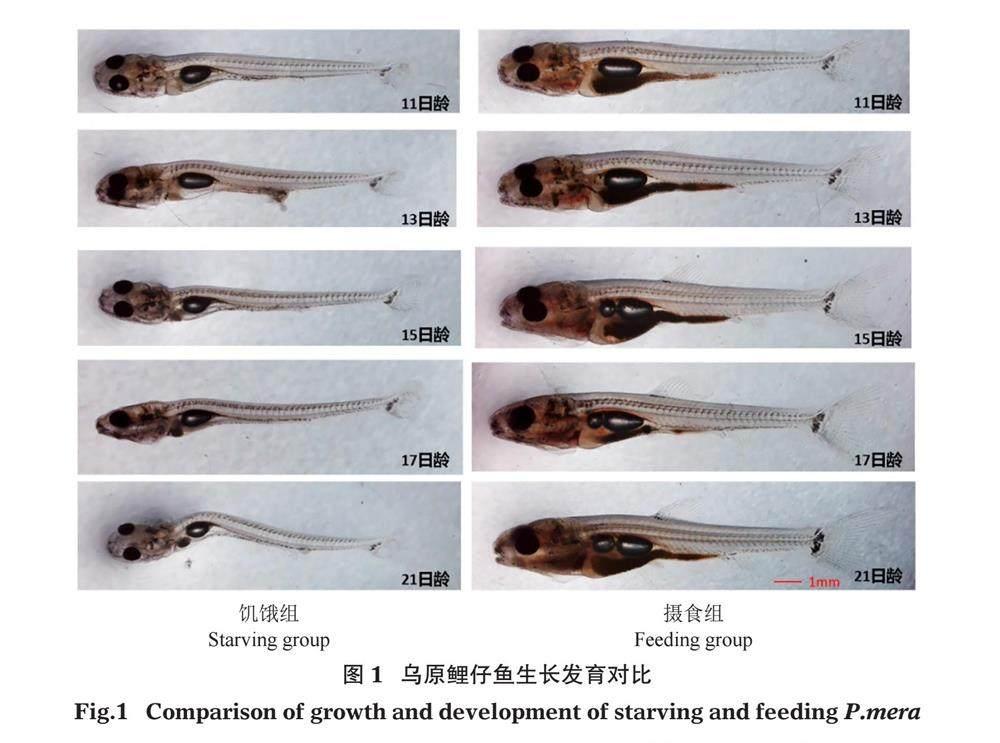
2.1.1 生长变化 饥饿组和摄食组乌原鲤仔鱼生长指标见表1,生长发育对比见图1。在水温20~22 ℃条件下,乌原鲤初孵仔鱼全长(7.03±0.10)mm,体长(6.69±0.03)mm,体高(1.25±0.75)mm,肛前长(4.81±0.13)mm,眼径(0.35±0.12)mm。随着卵黄囊的吸收,仔鱼各项生长指标不断增长。本研究对4日龄乌原鲤仔鱼进行分组,5日龄摄食组开始投喂外源性营养丰年虫饵料。7日龄时,摄食组各项生长指标均高于饥饿组,其中全长、体长差异显著(0.01
摄食组仔鱼经过内营养、混合营养、外营养阶段,生长迅速,鱼体粗壮,体质健壮,试验结束(21日龄)时,仔鱼全长(16.12±0.37)mm、体长(12.55±0.28)mm、体高(2.42±0.07)mm、肛前长(9.26±0.25)mm、眼径(0.94±0.01)mm。饥饿组仔鱼从孵化至试验结束,未进行外营养投喂,在卵黄囊消耗完全后,未建立外源性营养,鱼体头大消瘦,脊索弯曲,肠道萎缩,仔鱼各项生长指标几乎停滞,试验结束(21日龄)时,仔鱼全长(10.02±0.32)mm、体长(8.82±0.26)mm、体高(1.09±0.07)mm、肛前长(6.36±0.18)mm、眼径(0.54±0.02)mm。
2.1.2 卵黄囊吸收 饥饿组和摄食组仔鱼卵黄囊体积变化见表2。初孵仔鱼卵黄囊体积为(5.51±0.15)mm3,随日龄的增加而不断减小。0~4日龄,卵黄囊消耗显著;4日龄,摄食组卵黄囊体积为(2.59±0.07)mm3,占初孵仔鱼卵黄囊体积的47.01%,饥饿组卵黄囊体积为(2.62±0.06)mm3,占初孵仔鱼卵黄囊体积的47.55%;5日龄,开始投饵,饥饿组和摄食组卵黄囊体积变化差异极显著(P<0.01 );5~9日龄,卵黄囊消耗饥饿组低于摄食组;10日龄,在显微镜下饥饿组和摄食组仔鱼均未发现卵黄囊,卵黄囊消耗完全。在水温20~22 ℃条件下,乌原鲤仔鱼混合营养期为5 d。
2.1.3 开鳔率及鳔体积变化 乌原鲤仔鱼开鳔率随日龄变化见图2。4日龄时开始出现鳔组织,仔鱼卵黄囊尚未消耗完毕,已经做好开口准备;到5日龄时饥饿组和摄食组开鳔率均达到50%。6~7日龄,饥饿组与摄食组出现显著差异,饥饿组开鳔率低于摄食组,饥饿组开鳔率仅90%,而摄食组开鳔率达100%。8日龄,2组仔鱼开鳔率均达到100%。
随着仔鱼发育,摄食组和饥饿组的鳔体积显现出不同的变化趋势(表3,图3)。4~8日龄鳔体积整体上呈增长趋势,期间鳔体积变化差异小,饥饿组仔鱼鳔体积变化范围为(0.08±0.004~0.20±0.06)mm3,摄食组鳔体积变化范围为(0.08±0.004~0.19±0.02)mm3。投喂7日(即10日龄),摄食组与饥饿组仔鱼鳔体积差异显著(0.01 2.1.4 初次摄食强度 乌原鲤仔鱼初次摄食强度见图4。5~11日龄仔鱼初次摄食强度随日龄增长而增强,12~21日龄仔鱼摄食强度随饥饿时间增加而递减。 2.1.5 死亡率 在20~22 ℃水温条件下,乌原鲤仔鱼饥饿组与摄食组死亡率见图5。4~15日龄,饥饿组累积死亡率稍高于摄食组,但差异不显著。15日龄,饥饿组累积死亡率为12.33%,摄食组累积死亡率为7.67%;16日龄以后,饥饿组累积死亡率急剧上升;20日龄,饥饿组仔鱼累积死亡率为60.00%,超过50%;22日龄,饥饿组累积死亡率达100%,而摄食组累积死亡率仅为10.33%。 2.2 乌原鲤仔鱼PNR 在水温20~22 ℃条件下,乌原鲤仔鱼初次摄食率变化见图6。仔鱼5日龄开始摄食外源性营养,当日初次摄食率为15%;随后初次摄食率上升,到8日龄达到最高值100%,并维持到14日龄;15日龄后呈下降趋势,在19日龄时降至45%。仔鱼初次摄食率在7~17日龄保持在80 %以上,共11 d。 根据PNR定义,乌原鲤仔鱼PNR为19日龄,即饥饿15 d到达PNR。 3 讨论 3.1 仔鱼混合营养期 仔鱼在卵黄囊期完成一系列与摄食、消化相关器官功能发育,从而具备从内源卵黄营养转入外源摄食营养,卵黄囊仔鱼大多在卵黄耗尽前的短期内开始摄食,因而构成内源与外源营养共存的混合营养期(mixed feeding stage)(殷名称,1995)。鱼类混合营养期的长短因种类不同而异。本研究乌原鲤仔鱼5日龄开始摄食,指示混合营养期开始,至10日龄卵黄囊完全消耗殆尽,混合营养期结束。乌原鲤在水温20~22℃条件下,混合营养期为5 d。中华倒刺鲃(Spinibarbus sinensis)在水温(25±0.5)℃条件下,混合营养期维持4 d(黄洪贵等,2010);鲈鲤(Percocypris pingi)在水温18.5~21.9℃条件下,混合营养期维持5 d(张建明等,2020);细鳞鲴(Plagiognathops microlepis)在水温27~29℃条件下,混合营养期仅维持2 d(叶忠平等,2012);叶尔羌高原鳅(Triplophysa yakandensis)在水温(20±1)℃条件下,混合营养期维持5 d(宋勇等,2019)。单秀娟和窦硕增(2008)为减小水温与卵黄吸收速率对混合营养期仔鱼的影响,提出以仔鱼开口摄食到卵黄囊消耗完毕的时间与仔鱼孵化后到开口摄食的时间之比作为客观反映不同鱼类仔鱼混合营养期相对状况的判断依据。根据此判断标准,乌原鲤两者之比为1,说明乌原鲤仔鱼摄食能力处于中间水平。本研究摄食组,5~9日龄乌原鲤仔鱼开始摄食后,其卵黄囊消耗速率比饥饿组相对较快,可能是乌原鲤仔鱼对饥饿胁迫作出的生理适应(杨育凯等,2019)。在生产中,需要观察卵黄囊消耗情况,精准掌握开口饵料的投喂时间,避免饥饿对仔鱼生存、生长发育造成影响,提高鱼苗的成活率。 3.2 初次摄食率与PNR 初次摄食仔鱼大多具备色素完善、发育良好和可动的双眼,依靠视觉搜索、选择和捕食活饵。摄食效率随种类而不同,与仔鱼捕食和游泳等器官的形态功能特点相关。初次摄食时间受内源性因素如种属遗传特性、器官发育、卵黄囊大小以及吸收速率等和外界因子如水温、饵料等的影响(Houde,1987;殷名称,1995;马旭洲等,2006)。本研究,在水温20~22℃条件下,乌原鲤5日龄开始初次摄食,此时初次摄食率仅为15%,8日龄达到100%,并维持5 d后开始下降。乌原鲤仔鱼最高初次摄食率持续时间较长,与瓦氏黄颡鱼(Pseudobagrus vachelli)(马旭洲等,2006)、圆口铜鱼(Coreius guichenoti)(黄洪贵等,2010)、赤眼鳟(Squaliobarbus curriculus)(李彩娟等,2016)、中华倒刺鲃(曲焕韬等,2017)等结果相似,而与鲤科其他种类如细鳞鲴(叶忠平等,2012)、鲈鲤(张建明等,2020)、齐口裂腹鱼(Schizothorax prenanti)(张建明,2020)等最高摄食率仅维持1~2 d存在明显差异。 PNR是评价仔鱼摄食和耐饥饿能力的主要指标,抵达PNR的时间越长,鱼类耐受饥饿的能力越强,反之耐受饥饿的能力越弱(Yin & Blaxter,1987;殷名称,1996)。本研究,在水温20~22℃条件下,乌原鲤仔鱼PNR发生在19日龄,长于鲢(Hypophthalmichthys molitrix)和鳙(Aristichthys nobilis)及草鱼(Ctenopharyngodon idella)的16.5日龄、白甲鱼(Onychostoma sima)的13.5日龄、赤眼鳟的10~11日龄、齐口裂腹鱼的17日龄、鲈鲤的17日龄和圆口铜鱼的13~14日龄(殷名称,1997;李强等,2009;李彩娟等,2016;曲焕韬等,2017;张建明,2020),说明在鲤科鱼类中,乌原鲤仔鱼具有较强的饥饿耐受能力。 3.3 饥饿对仔鱼存活和生长的影响 仔鱼分为前期仔鱼(卵黄囊期仔鱼)和后期仔鱼。仔鱼期是鱼类生活史中最敏感、最脆弱的时期,易受各类环境因子的影响,饥饿是影响仔鱼正常生长发育和行为的重要因素之一(张海发等,2006;张建明等,2020)。本研究结果表明,饥饿对乌原鲤仔鱼存活具显著影响。饥饿组仔鱼从18日龄开始累计死亡率迅速上升,20日龄时累积死亡率为60.00%。 饥饿对乌原鲤仔鱼全长、体长、体高等生长指标有极显著影响。摄食组在5日龄开始投喂,0~6日龄饥饿组和摄食组生长指标差异不显著,10日龄(饥饿6 d)饥饿组仔鱼由于内源性营养消耗殆尽,未及时建立外源性营养摄入,导致仔鱼各项生长指标几乎停滞甚至部分出现负增长的趋势,仔鱼头大体瘦,甚至脊柱出现弯曲,游泳能力弱,行动缓慢,行为迟钝。而摄食组仔鱼从内源性营养顺利过渡到外源性营养,仔鱼生长迅速,鱼体粗壮,游泳迅速,与饥饿组各项生长指标差异极显著。本研究结果与鲈鲤(张建明等,2020)、齐口裂腹鱼(张建明,2020)等鱼类饥饿试验结果一致。 饥饿对乌原鲤仔鱼鳔组织具有显著的影响。摄食组仔鱼15日龄出现鳔2室;而饥饿组仔鱼至试验结束只出现鳔1室,甚至在饥饿9 d后(卵黄囊消耗殆尽后)出现鳔组织体积生长停滞,甚至逆生长。此结果与大头鳕、鲈鲤饥饿试验等结果(李艳秋等,2014;张建明等,2020)基本一致。 3.4 仔鱼初次投喂时机 理论上,若在抵达PNR之前得到适口的外源性营养补给,仔鱼就有可能摄食后恢复正常生长。饥饿组乌原鲤仔鱼累计死亡率超过50%出现在PNR之后,表明在PNR之前获得适口饵料对乌原鲤仔鱼存活有重要意义。 在仔鱼人工培育过程中,过早、过晚或过量地投喂适口饵料均会导致仔鱼死亡率的升高(宋兵等,2004)。本研究,乌原鲤仔鱼在5日龄开始摄食,但初次摄食率仅15%,6日龄为50%,至7日龄达90%以上,8日龄达到最高值;卵黄囊在10日龄时吸收完全。综合考虑,在水温20~22℃条件下,可在乌原鲤仔鱼6日龄开始投喂适口饵料,不迟于10日龄。生产中,可根据实际情况观察乌原鲤仔鱼肠道贯通、卵黄囊消耗等情况(杨西伟等,2017),掌握仔鱼初次投喂时机,避免仔鱼受饥饿影响,提高仔鱼成活率,为乌原鲤的大规模培育提供基础。 参考文献 国家林业和草原局,农业农村部,2021-02-05.国家林业和草原局农业农村部公告:附件:国家重点保护野生动物名录[EB/OL].[2021-11-01].http://www.moa.gov.cn/govpublic/YYJ/202102/t20210205_6361292.htm. 黄洪贵,胡振禧,黄种持,等,2010.饥饿对中华倒刺鲃仔鱼摄食、存活与生长发育的影响[J].江西农业大学学报,32(2):231-235. 蒋志刚,江建平,王跃招,等,2016.中国脊椎动物红色名录[J].生物多样性,24(5):500-551. 李强,李孟均,周传江,等,2009.饥饿对白甲鱼(Onychostoma sima)仔鱼摄食、生长的影响[J].淡水渔业,39(5):32-37. 李彩娟,许郑超,张振早,等,2016.赤眼鳟仔鱼饥饿试验和不可逆点研究[J].扬州大学学报(农业与生命科学版),37(3):65-70. 李艳秋,姜志强,孙阳,等,2014.太平洋鳕仔鱼饥饿实验及不可逆生长点的确定[J].生态学报,34(14):3873-3878. 李育森,雷建军,韩耀全,等,2019.水温和光照强度对乌原鲤耗氧率与临界窒息点的影响[J].南方农业学报,50(2):418-423. 马旭洲,王武,甘炼,等,2006.延迟投饵对瓦氏黄颡鱼仔鱼存活、摄食和生长的影响[J].水产学报,(3):323-328. 曲焕韬,刘勇,胡美洪,等,2017.饥饿对圆口铜鱼Coreius guichenoti仔鱼早期发育的影响[J].水生态学杂志,30(6):24-29. 单秀娟,窦硕增,2008.饥饿胁迫条件下黑鮸 (Miichthys miiuy)仔鱼的生长与存活过程研究[J].海洋与湖沼,(1):14-23. 宋兵,陈立侨,高露姣,等,2004.饥饿对杂交鲟仔鱼摄食、生长和体成分的影响[J].水生生物学报,28(3):333-336. 宋勇,江志香,马卓勋,等,2019.叶尔羌高原鳅仔鱼饥饿试验及不可逆点的确定[J].水生态学杂志,40(2):102-107. 杨育凯,林黑着,王志勇,等,2019.黑棘鲷仔鱼饥饿实验及不可逆点的确定[J].渔业科学进展,41(2):87-94. 杨西伟,徐钢春,徐跑,2017.淡水鱼仔鱼开口摄食及其饵料的研究进展[J].长江大学学报(自科版),14(22):45-48. 叶忠平,吕业坚,林岗,2012.细鳞斜颌鲴仔鱼饥饿试验与不可逆点的确定[J].南方农业学报,43(4):536-539. 殷名称,1995.鱼类仔鱼期的摄食和生长[J].水产学报,(4):335-342. 殷名称,1996.鱼类早期生活史阶段的自然死亡[J]水生生物学报,20(4):363-372. 殷名称,1997.鲢、鳙、草、银鲫卵黄囊仔鱼的摄食生长、耐饥饿能力[C]//中国鱼类学会.鱼类学论文集:第6辑.北京:科学出版社:69-79. 张海发,刘晓春,刘付永忠,等,2006.斜带石斑鱼胚胎及仔稚幼鱼形态发育[J].中国水产科学,(5):689-699. 张建明,2020.齐口裂腹鱼仔鱼饥饿试验及不可逆生长点的确定[J].水产科学,39(4):532-538. 张建明,姚金忠,姜伟,等,2020.鲈鲤仔鱼饥饿试验及不可逆生长点的确定[J].南方农业学报,51(10):2565-2572. 朱瑜,2006.鲤形目鲤科的鱊亚科 鲍亚科(除金线鲍属)、野鲮亚科和鲤亚科[M]//广西壮族自治区水产研究所,中国科学院动物研究所.广西淡水鱼类志.南宁:广西人民出版社:346-348. Blaxter J H S,Hempel G,1963.The influence of egg size on herring larvae[J].Journal du Conseil Conseil International POUR lExploration de la Mer,28:211-240. Houde E D,1987.Fish early life dynamics and recruitment variability[J].Amer Fish Symp,2:17-29. Yin,Blaxte,1987.Feeding ability and survival during starvation of marine fish larvae reared in the laboratory[J].Journal of Experimental Marine Biology and Ecology,105:73-83. (责任编辑 张俊友) Feeding and Starvation Tolerance of Yolk-sac Larvae of Percocypris mera LI Juan1, 2, YANG Bo1, 2, DONG Wei‐wei1, QUE Yan‐fu1, ZHU Bin1, QIAO Ye1 (1. Key Laboratory of Ecological Impacts of Hydraulic-Projects and Restoration of Aquatic Ecosystem of Ministry of Water Resources & Hubei Engineering Research Center of Hydroecology Protection and Restoration,Institute of Hydroecology,Ministry of Water Resources and Chinese Academy of Sciences, Wuhan 430079,P.R. China; 2. Institute of Changjiang Ecological Conservation Co. LTD, Hubei, Wuhan 430014, P.R. China) Abstract:In this study, we explored the feeding characteristics and starvation tolerance of yolk-sac larvae of Percocypris mera. At a water temperature of 20-22℃, newly hatched P.mera larvae were selected to study the effects of starvation stress on the growth, development, survival, yolk sac absorption, initial feeding rate and feeding intensity of P.mera larvae. The initial feeding time and point of no return (PNR) of P.mera larvae were determined based on the test results. It aimed to provide technical support for the large-scale breeding of P.mera. In March and April 2021, artificial breeding test of P.mera was carried out at the fish breeding and releasing station of Hongshui River, Guangxi Province. Newly hatched yolk-sac larvae of P.mera were randomly divided into three groups (feeding group, starving group 1 and 2), with each treatment run in triplicate and 500 individuals per group. The test fish in feeding group were fed with fairy shrimp three times daily and the test lasted util the death of all individuals in starving group 1. During the test, the growth parameters of P.mera in the feeding group and starving group 1 were observed each day. After feeding began, 20 fish in starving group 2 were randomly selected each day and fed with fairy shrimp and the initial feeding rate and initial feeding intensity were recorded two hours after feeding. Results show that 5-9 day-old larvae were in mixed nutrition stages. The larvae of P.mera began feeding on day 5, with an initial food intake rate of 15%, while the feeding rate of 8-day P.mera larvae reached the highest level of 100%. The high feeding rate was maintained until day 14 and then trended downrd. The 19-day-old larvae of P.mera reached the irreversible growth point. Starvation had highly significant effects on the growth indices of P.mera larvae, including full length, body length, body height, anterior anal length, and eye diameter (P<0.01). In conclusion, the larvae of P.mera have strong starvation tolerance. At a water temperature of 20-22℃, we recommend that the larvae of P.mera are fed from day 6 and no later than day 10. Mastering the first feeding time of P.mera larvae will improve the survival rate and support large-scale cultivation of the P.mera. Key words:Percocypris mera;larvae;starvation;feeding rate;feeding intensity;point of no return(PNR)

