拉萨裂腹鱼胚胎适宜孵化水温研究
曾本和 龚君华 刘海平 王万良 王金林 何林强


摘要:为探索拉萨裂腹鱼(Schizothorax waltoni)胚胎适宜孵化水温,提高胚胎受精率和孵化率,降低初孵仔鱼畸形率,设置5℃、9℃、12℃、14℃、16℃、18℃、20℃、22℃共8个温度梯度进行拉萨裂腹鱼鱼卵孵化实验,统计各温度下的胚胎发育速度、鱼卵受精率和孵化率、初孵仔鱼畸形率及形体指标。结果显示,拉萨裂腹鱼胚胎卵裂期发育最快,到囊胚期、原肠期、器官分化期及出膜期,每个发育时期积累时间逐渐增长;随温度的升高,胚胎发育时间缩短,发育速度加快。各温度条件下,胚胎发育时期与孵化时间均呈幂函数关系,孵化积温随温度升高呈现逐渐降低的趋势。水温9~18℃的鱼卵受精率较高,均超过90%;水温12~16℃的孵化率较高,均超过95%;水温9~16℃的鱼苗畸形率较低,均低于4%。初孵仔鱼全长与孵化温度呈二次多项式函数关系;不同水温的初孵仔鱼体高没有显著性差异,但卵黄囊体积先升高、后降低、再升高。研究表明,适当提高孵化水温能缩短胚胎孵化周期,但水温过高会影响胚胎孵化率,增加初孵仔鱼畸形率,影响仔鱼对营养物质的吸收利用以及器官发育分化。综合考虑胚胎孵化周期、孵化率、初孵仔鱼畸形率及形体指标,拉萨裂腹鱼胚胎适宜孵化水温为12~16℃。
关键词:拉萨裂腹鱼;胚胎发育;受精率;孵化率;畸形率;水温
中图分类号:Q142 文献标志码:A 文章编号:1674-3075(2023)02-0096-08
鱼卵受精率和孵化率、胚胎发育各阶段的存活率和发育速度及初孵仔鱼畸形率是鱼类胚胎发育过程的重要生物学参数,各种内、外环境因素对这些参数均有不同程度的影响(唐丽君等,2014)。水温、溶氧、pH、光照及遗传变异等对鱼类胚胎发育均有影响(Zacharia & Kakati,2004),其中温度的影响尤为显著(Hilder & Ned,2003)。研究表明,在一定的范围内,水温升高能加速鱼类胚胎发育进程,缩短孵化时间(El-Gamal,2009)。但鱼类胚胎对水温变化的适应能力有一定限度,若超出适宜水温阈值,过高或过低的水温都会导致胚胎发育畸形或者停滞甚至死亡(Jobling,1993);此外,不同鱼类的胚胎发育对水温的敏感性也不尽相同(孙恒志和任丽珍,1992)。温度首先是对胚胎细胞体酶系统产生影响,继而影响鱼类胚胎发育(刘艳超等,2018)。在适宜的温度范围内,温度越高,孵化酶活力越强,孵化周期越短;高于或低于此范围,孵化酶活力就会受到破坏或抑制(郭永军等,2004);在胚胎发育过程中,水温还可能造成胚胎变态发育(张甲等,2004),其中温度胁迫使得鱼类胚胎的成活率、孵化率和生存能力均下降,初孵仔鱼畸形率上升(柳学周等,2004)。
拉萨裂腹鱼(Schizothorax waltoni)俗称拉萨弓鱼,隶属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、裂腹鱼亚科(Schizothoracinae)、裂腹鱼属(Schizothorax),仅分布于我国西藏地区的雅鲁藏布江中上游干、支流及附属水体,资源量少,生长速度缓慢,性成熟年龄较迟,为我国特有种,也是西藏地区主要的经济鱼类之一(西藏自治区水产局,1995)。近几十年以来,受外来鱼类入侵、水电水利工程建设、过度捕捞、水质环境恶化等因素的影响(周贤君,2014;刘海平等,2018),2016年拉萨裂腹鱼被《中国脊椎动物红色名录》列为易危鱼类(VU)(蒋志刚等,2016),2019年被《西藏雅鲁藏布江中游裂腹鱼类优先保护等级定量评价》列为三级优先保护鱼类(李雷等,2019),2021年被列为国家二级水生野生保护动物。因此,亟待开展拉萨裂腹鱼自然资源相关保护性研究工作。
目前,有关拉萨裂腹鱼的研究包括分类学与起源和演化(Qiu & Chen,2009)、分子系统发育与生物地理学(Guo et al,2014)、基因组(周建设等,2019)、年龄与生长(郝汉舟,2005)、食性组成(周贤君,2014)、人工驯养(王万良等,2016)、人工繁殖(曾本和等,2020a)、胚胎发育(徐滨等,2020)、苗种培育(曾本和等,2020b)等,但迄今未见有关其胚胎适宜孵化水温的研究报道。本实验设置一系列温度梯度孵化拉萨裂腹鱼胚胎,探究水温对其孵化时间、受精率、孵化率、初孵仔鱼畸形率、形体指标的影响,明确其适宜孵化水温,以期为拉萨裂腹鱼资源保护积累生物学资料。
1 材料和方法
1.1 实验材料
实验材料选取2019年4月12日在西藏自治区重要特有鱼类水产种质资源场生产的拉萨裂腹鱼受精卵1.3万粒,亲本为雅鲁藏布江日喀则段捕获的野生群体,经人工催产,在水温(12.0±0.5)℃条件下干法授精所得。
1.2 实验方法
1.2.1 实验分组 鱼卵挤出后,在12℃的自然水温下,待鱼卵吸水膨胀后,用体积法计算鱼卵总数量,并将鱼卵平均分成8组,每组3个重复,分别于5℃、9℃、12℃、14℃、16℃、18℃、20℃、22℃共8个水温条件下孵化鱼卵。
将鱼卵置于长×宽×高规格为21 cm × 7 cm × 4 cm孵化盘中,底部覆盖网孔直径为1.5 mm的筛网。孵化盘置于直径45 cm、高度25 cm的红色塑料盆中。14℃、16℃、18℃、20℃、22℃水温组通过恒温加热棒调节,温差±0.5℃;5℃通过冰箱调节温度,温差±1.0℃;9℃通过恒温培养箱调节温度,温差±1.2℃。孵化用水为曝气后的井水,溶氧≥8 mg/L,每天换水1次,每次换水1/3。
1.2.2 日常管理 每天测量水温和溶氧4次(6:00、12:00、18:00、0:00),如水温偏高或者偏低应及时调节。每天剔除1次死卵并记录。从受精卵到鱼苗出膜,每隔2 h在显微拍照系统下观察各温度组胚胎发育时期并拍照记录。孵化结束后,统计不同温度组胚胎受精率、孵化率、初孵仔鱼畸形率,计算不同温度组胚胎孵化积温,测量出孵仔鱼形体数据。
1.3 计算方法
胚胎受精率和孵化率、初孵仔鱼畸形率以及孵化积温、孵化速度、卵黄囊体积计算公式如下:受精率=(原肠中期活卵数/总卵数)×100%;孵化率=(孵出仔鱼数/受精卵数)×100%;畸形率=(孵出仔鱼畸形数/孵出仔鱼数)×100%;孵化积温=孵化平均温度(℃)×孵化持续时间(h);孵化速度=1/孵化时间;卵黄囊体积 = (4/3)π ×(R/2)×(r/2)2,式中:r为卵黄囊短径,R为卵黄囊长径(骆豫江等,2008)
1.4 数据分析
数据通过Excel 2010进行统计和作图;采用SPSS 19.0统计软件中One-way ANOVA进行单因子方差分析,若差异显著,则采用Duncan's进行多重比较,显著水平为P<0.05。
2 结果
2.1 胚胎发育特征
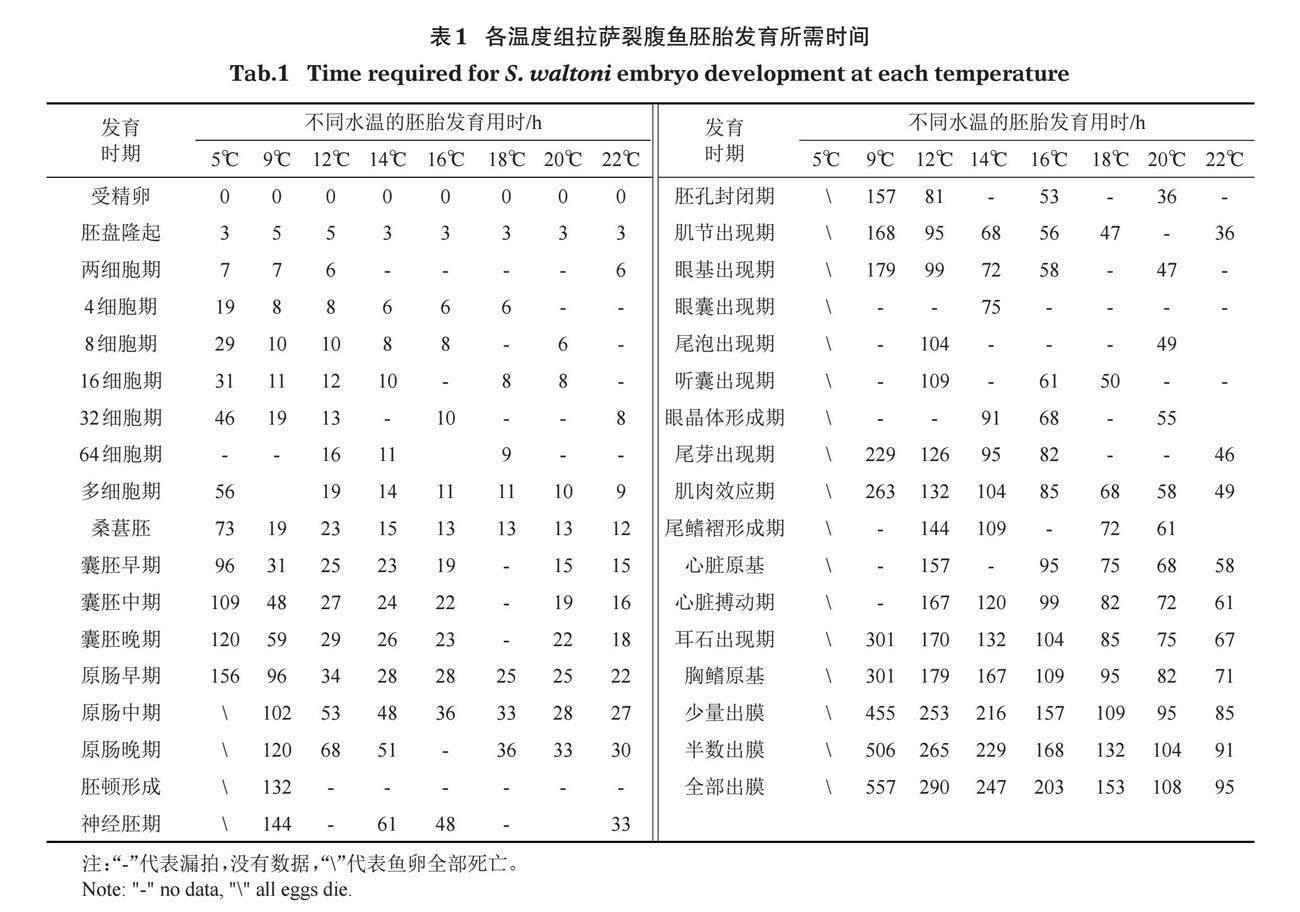
拉萨裂腹鱼胚胎呈棕黄色,沉性,非粘性,不含油球,卵质均匀分布,极性不明显。发育过程一般可分为受精卵、胚盘期、卵裂期、囊胚期、原肠期、神经胚期、器官分化和孵化期共8个阶段(表1)。初孵仔鱼身体透明,淡黄色,色素未出现,大多数在水底静息,在外界刺激下游动。
2.2 水温与胚胎孵化时间
水温对各发育时期胚胎孵化时间的影响见表1和图1。水温5℃时,拉萨裂腹鱼受精卵发育到原肠早期便全部死亡;水温9~22℃,受精卵均能发育到鱼苗出膜。拉萨裂腹鱼受精卵卵裂期发育最快,至囊胚期、原肠期、器官分化期及出膜期,每个发育时期所需时间逐渐增长。回归分析表明,各温度组的发育期与孵化时间均呈冥函数关系,并且拟合方程的相关系数(R2)均较大,随着孵化水温升高,函数系数越小,各发育时期所需时间越短(表2)。
水温与孵化时间和速度的关系见图2-a和图2-b。随着水温升高,拉萨裂腹鱼孵化时间逐渐减少,孵化速度逐渐升高。5℃组胚胎不能顺利孵化出膜,9℃组胚胎孵化时间最长(557 h);22℃组胚胎孵化时间最短(95 h),较9℃组缩短了462 h。回归分析表明,孵化时间(H)与孵化水温(T)呈幂函数关系:H=580.84T-0.876(R2=0.9655);孵化速度(V)与孵化水温(T)呈线性关系:V=0.0014T+3×10-5(R2=0.9629)。
2.3 水温与孵化积温
水温与孵化积温的关系见图2-d。随着水温升高,拉萨裂腹鱼胚胎孵化积温逐渐降低,9℃组孵化积温最高(5 249 h·℃),22℃组孵化积温最低(2 118 h·℃)。回归分析表明,水温与孵化积温呈幂函数关系:y=5 232.3x-0.439(R2=0.9135)。
2.4 水温与孵化效果
2.4.1 受精率 水温对胚胎受精率的影响见图2-c。5℃组胚胎发育到原肠早期便不再发育,9~18℃组胚胎受精率较高,均超过90%;水温在20℃及以上时,鱼卵受精率明显降低,20℃组受精率81.47%,22℃组受精率仅18.34%。
2.4.2 孵化率 水温对胚胎孵化率的影响见图2-e。随着水温升高,胚胎孵化率呈先升高、后降低趋势。5℃组孵化率最低,为0;5~14℃,孵化率逐渐升高,14℃时达到最高,为96.23%;水温超过16℃后,孵化率明显降低;22℃组最低,仅有3.29%。水温12~16℃,孵化率较高,均超过95%。回归分析表明,水温与孵化率呈二次函数关系:y=-7.9608x2+68.145x-44.317(R2=0.9138)。
2.4.3 仔鱼畸形率 水温对初孵仔鱼畸形率的影响见图2-f。随着水温升高,初孵仔鱼畸形率显著升高。12℃组畸形率最低,为0.76%;水温9~16℃时畸形率较低,且均低于4%;水温高于18℃后,畸形率显著升高;18℃、20℃、22℃组的畸形率分别为16.04%、27.87%、84.21%。回归分析表明,水温与畸形率呈指数函数关系:y=0.2325e0.7935x(R2=0.8926)。畸形鱼苗主要表现为尾部畸形、脊柱骨畸形、眼睛缺失或发育不良和卵黄囊畸形(图3)。
2.5 水温与初孵仔鱼形体指标
水温对初孵仔鱼形体指标的影响见表3。水温与初孵仔鱼全长呈二次多项式函数关系(图4-a)。12~20℃,各温度组全长没有显著性差异(P>0.05),但显著高于9℃组与22℃组(P<0.05)。水温与初孵仔鱼卵黄囊体积呈3次函数关系(图4-b);9~20℃各组间没有显著性差异(P>0.05),22℃组显著性增加(P<0.05)。水温9~14℃,初孵仔鱼眼径随温度升高显著增加(P<0.05);14~20℃,各温度组差异不显著(P>0.05);22℃组显著降低(P<0.05)。水温9~22℃,初孵仔鱼体高均没有显著性差异(P>0.05)。
3 讨论
3.1 水温对胚胎发育速度的影响
水温可直接影响胚胎发育的速度(沈和定等,2005),在一定温度范围内,胚胎发育速度随水温升高而加快(甘小平,2012)。本次实验中,由于水温5℃时胚胎发育在原肠早期之后就停止发育,无法统计孵化时间;其余水温组孵化时间随温度的升高而逐渐缩短。对拉萨裸裂尻鱼(Schizopygopsis younghusbandi)(刘艳超等,2019)、尖裸鲤(Oxygymnocypris stewartii)(刘艳超等,2018)、日本黄姑鱼(Nibea japonica)(许源剑等,2010)、稀有鮈鲫(Gobicypris rarus)(甘小平,2012)、大银鱼(Prolosalanx hylocranius)(戈志强等,2003)、云纹石斑鱼(Epinephelus moara)(张廷廷等,2016)的研究均得出类似结果。
3.2 拉萨裂腹鱼孵化极限水温及适宜水温
水温对于鱼类的胚胎发育至关重要,水温过低会导致胚胎发育停止(张鑫磊,2006);即使能够孵化出膜,初孵仔鱼死亡率也极高(刘艳超等,2018);而过高的水温会影响孵化率,甚至使受精卵无法孵化(戈志强等,2003)。楼允东(1965)认为鱼类胚胎的孵化主要依靠胚体运动和孵化酶两方面作用;温度是影响酶催化活性最重要的外界因素之一,酶只有在其适宜的温度范围内拥有最大活性,当温度在其适宜范围之外时,酶活力会大大降低,且高温下酶失活后的活性不可逆。樊廷俊和史振平(2002)指出,在胚胎发育过程中,温度降低不仅显著延迟孵化,而且胚胎的存活率也明显降低;但温度到达30℃时,受精卵发育至胚体形成期便停止分裂,长时间的高温使孵化酶分泌受到抑制或过早消耗,最终导致绝大多数的胚胎无法破膜而出。本次实验结果表明,水温5℃组胚胎发育在原肠早期即停止发育,水温9~22℃时受精率和孵化率基本均呈现出先增后减的趋势,各水温组畸形率随孵化水温升高而显著升高。温度通过影响孵化酶的分泌及其活性控制仔鱼孵出,同时影响胚胎的成活率和畸形率(楼允东,1965;樊廷俊和史振平,2002)。因此,综合考虑受精率、孵化率、初孵仔鱼畸形率等因素,拉萨裂腹鱼胚胎发育极限最低温为5℃,极限最高温为22℃,适宜水温为12~16℃。
拉萨裂腹鱼极限最低温与尖裸鲤、拉萨裸裂尻鱼、大泷六线鱼(Hexagrammos otakii)相近;极限最高温与扁吻鱼(Aspiorhynchus laticeps)、大泷六线鱼相近,胚胎孵化适宜水温与尖裸鲤、拉萨裸裂尻鱼、大泷六线鱼、中华多刺鱼(Pungitius sinensis)等大部分冷水性鱼类接近,较鲢(Hypophthalmichthys molitrix)、鲤(Cyprinus carpio)、扁吻鱼、半滑舌鳎(Cynoglossus semilaevis)等温带鱼类和泰国斗鱼(Betta splendens)、鳜(Siniperca chuatsi)、神仙鱼(Pterophyllum scalare)、云纹石斑鱼(Epinehelus moara)等热带鱼类低,详见表4。
3.3 基于孵化水温解析拉萨裂腹鱼高原适应性
鱼类胚胎孵化极限水温和适宜水温与鱼类长期生活环境水温密切相关,半滑舌鳎繁殖季节的自然水温17.5~22.0℃,其胚胎最适合孵化水温为20.5~21.6℃(杜伟等,2004);瓦氏黄颡鱼繁殖季节的自然水温22.0~28.0℃,其胚胎最适合孵化水温为25℃(袁伦强等,2005);以上2种温带鱼的胚胎适宜孵化水温均在繁殖季节自然水温范围内。拉萨裂腹鱼繁殖季节雅鲁藏布江日喀则段水温为5~8℃,本实验发现其适宜孵化水温为12~16℃,较其繁殖季节自然水温高,可能是在西藏高原隆起以前,拉萨裂腹鱼生活环境为温带,喜欢温带水环境;但随着西藏高原隆起,海拔逐渐升高,拉萨裂腹鱼生活的水域水温逐渐降低,为了生存不断适应低温环境,但其胚胎发育目前还没有完全适应低温环境。因此,拉萨裂腹鱼的卵在高于自然水温条件下孵化,其受精率、孵化率及初孵仔鱼畸形率要优于自然水温条件。拉萨裂腹鱼的繁殖在每年4-5月,为雅鲁藏布江水温升高的季节,在此时段繁殖,鱼卵在水温较高的环境中可获得较高的孵化率,产生较多的后代,可见拉萨裂腹鱼繁殖季节也是长期适应高原水域环境的结果。
参考文献
卞绍雷,赵亚辉,张洁,等,2008. 温度和盐度对中华多刺鱼胚胎发育过程的影响[J]. 动物学报, 1(2):282-289.
杜伟,蒙子宁,薛志勇,等,2004. 半滑舌鳎胚胎发育及其与水温的关系[J]. 中国水产科学, 1(1):48-53.
樊廷俊,史振平,2002. 鱼类孵化酶的研究进展及其应用前景[J]. 海洋湖沼通报, 1(1):48-56.
甘小平,2012. 温度对稀有鮑鲫(Gobicypris rarus)繁殖、胚胎发育和仔鱼生长的影响[D]. 重庆:西南大学:23-38.
戈志强,朱江,朱玉芳,等,2003. 不同光照、温度对大银鱼受精卵孵化率的影响[J]. 淡水渔业, 1(5):23-24.
郭永军,陈成勋,李占军,等,2004. 水温和盐度对鲤鱼(Cyprinus carpio L.)胚胎和前期仔鱼发育的影响[J]. 天津农学院学报, 11(3):5-9.
郝汉舟,2005. 拉萨裂腹鱼的年龄与生长研究[D]. 武汉:华中农业大学:23-37.
何利君,1999. 温度对鳜鱼胚胎发育的影响[J]. 四川畜牧兽医学院学报, 1(4):19-22,28.
胡发文,潘雷,高凤祥,等,2012. 大泷六线鱼胚胎发育及其与水温的关系[J]. 渔业科学进展, 33(1):28-33.
蒋志刚,江建平,王跃招,等,2016. 中国脊椎动物红色名录[J]. 生物多样性, 24 (5):501-551,615.
李岑,姜志强,刘庆坤,等,2011. 泰国斗鱼的胚胎发育及温度对胚胎发育的影响[J]. 大连海洋大学学报, 26(5):402-406.
李雷,马波,金星,等,2019. 西藏雅鲁藏布江中游裂腹鱼类优先保护等级定量评价[J]. 中国水产科学, 26(5):914-924.
刘海平,牟振波,蔡斌,等,2018. 供给侧改革与科技创新耦合助推西藏渔业资源养护[J]. 湖泊科学, 30(1):266-278.
刘艳超,刘海平,刘书蕴,等,2018. 温度对尖裸鲤胚胎发育及其仔稚鱼生长性状的影响[J]. 动物学杂志, 53(6):910-923.
刘艳超,范丽卿,何文佳,等,2019. 温度对拉萨裸裂尻鱼胚胎发育的影响[J]. 高原农业, 3(2):168-175.
柳学周,徐永江,马爱军,等,2004. 温度、盐度、光照对半滑舌鳎胚胎发育的影响及孵化条件调控技术研究[J]. 海洋水产研究,1(6):1-6.
楼允东,1965. 鱼类的孵化酶[J]. 动物学杂志, 7(3):97-101.
骆豫江,朱新平,潘德博,等, 2008. 高体革仔稚鱼的生长和发育[J]. 水产学报, 1(5):697-702.
马燕武,张人铭,吐尔逊,等,2008. 温度和水流对扁吻鱼胚胎发育的影响[J]. 淡水渔业, 1(1):57-61.
沈和定,陈贤龙,陈汉春,等,2005. 水温对石磺胚胎发育的影响[J]. 水产学报, 1(6):776-782.
孙恒志,任丽珍,1992. 草鱼和鳙鱼人工繁殖可行温度[J]. 淡水渔业, 1(1):29-30.
唐丽君,张筱帆,张堂林,等,2014. 水温对鲢早期发育的影响[J]. 华中农业大学学报, 33(1):92-96.
王万良,李宝海,周建设,等,2016. 两种不同模式人工驯养野生拉萨裂腹鱼试验效果比较[J]. 西藏农业科技, 38(1):16-20.
西藏自治区水产局,1995. 西藏鱼类及其资源[M]. 北京:中国农业出版社:26-28.
徐滨,朱祥云,魏开金,等, 2020. 拉萨裂腹鱼的胚胎及仔稚鱼发育特征[J]. 大连海洋大学学报, 35(5):663-670.
许源剑,孙敏,柴学军,等,2010. 日本黄姑鱼胚胎发育及温度对其过程的影响[J]. 浙江海洋学院学报(自然科学版), 29(6):544-550.
袁伦强,谢小军,曹振东,等,2005. 温度对瓦氏黄颡鱼胚胎发育的影响[J]. 动物学报, 1(4):753-757.
张甲,苏奋振,杜云艳,2004. 东海区中上层鱼类资源与海表温度关系[J]. 资源科学, 26(5):147-152.
张廷廷,陈超,施兆鸿,等,2016. 温度对云纹石斑鱼(Epinephelus moara)胚胎发育和仔鱼活力的影响[J]. 渔业科学进展, 37(3):28-33.
张鑫磊,2006. 半滑舌鳎胚胎发育及幼鱼营养需求的研究[D]. 青岛:中国海洋大学:22-43.
周建设,张驰,刘海平,等, 2019. DNA条形码在西藏水系裂腹鱼亚科鱼类鉴定中的研究[J]. 淡水渔业, 49(1):33-41.
周贤君,2014. 拉萨裂腹鱼个体生物学和种群动态研究[D]. 武汉:华中农业大学:26-53.
周玉,张俊辉,杨振国,等,2001. 温度和光照对神仙鱼胚胎发育的影响[J]. 水产科学, 1(3):9-10.
曾本和,杨瑞斌,刘海平,等,2020a. 拉萨裂腹鱼人工繁殖初探[J]. 淡水渔业, 50(5):69-73.
曾本和,王万良,张驰,等,2020b. 不同开口饲料及投喂频率对拉萨裂腹鱼仔鱼存活和生长的影响[J]. 渔业现代化, 47(4):38-43.
El-Gamal A E E, 2009. Effect of temperature on hatching and larval development and mucin secretion in common carp, Cyprinus carpio(Linnaeus,1758)[J]. Global Veterinaria, 3(2):80-90.
Guo X Z, Zhang G R, Wei K J, et al, 2014. Development and characterization of 20 polymorphic microsatellite loci for the Schizothorax waltoni[J]. Conservation Genetics Resources, 6(2):413- 415.
Hilder M L, Ned W, 2003. Pankhurst. Evidence that temperature change cues reproductive development in the spiny damselfish Acanthochromis polyacanthus[J]. Environmental Biology of Fishes, 66(2):187-196.
Jobling M, 1993. Bioenergetics, Food intake and energy partitioning[C]//Ranking J E, Jansen F. Fish eco-physiology. London: Chapman and Hall.
Qiu H, Chen Y F, 2009. Age and growth of Schizothorax waltoni in the Yarlung Tsangpo River in Tibet, China[J]. Ichthyological Research, 56(3):260-265.
Zacharia S, Kakati V S, 2004. Optimal salinity and temperature for early developmental stages of Penaeus merguiensis Deman[J]. Aquaculture, 232(1):373-382.
(责任编辑 万月华)
Suitable Water Temperature for Incubating Schizothorax waltoni Eggs
ZENG Ben‐he1, GONG Jun‐hua1, LIU Hai‐ping1, WANG Wan‐liang1, WANG Jin‐lin1, HE Lin‐qiang2
(1. Institute of Fisheries Science, Tibet Academy of Agricultural and Animal Husbandry Sciences,
Lhasa 850002, P.R. China;
2. College of fisheries, Huazhong Agricultural University, Wuhan 430070, P.R. China)
Abstract:Schizothorax waltoni, the primary economic fish species of Tibet, is distributed only in the Yarlung Zangbo River basin. In recent decades, the S. waltoni resource has been threatened by invasive fish species, hydropower project construction, overfishing and habit degradation and it is urgent to carry out research to support S. waltoni conservation. In this study, we conducted an incubation test of S. Waltoni eggs at 8 water temperatures (5℃, 9℃, 12℃, 14℃, 16℃, 18℃, 20℃, 22℃), to study the effect of water temperature on incubation time, fertilization rate, hatching rate, deformity rate and body indices of newly hatched larvae of S. Waltoni and determine the optimal incubation water temperature for embryo development. On April 12th 2019, approximately thirteen thousand fertilized eggs were obtained by artificially induced spawning and fertilization. The eggs were divided into 8 groups and one group was incubated at each water temperature. From fertilized eggs to newly hatched larvae, the development of S. waltoni embryos were observed every two hours, and the pertinent data were recorded for each group. With increasing water temperature, embryo development accelerated and incubation time decreased, while the accumulated incubation temperature gradually decreased. The relationship between the developmental period of S. waltoni embryo (incubation time) was described as a power function of incubation temperature. In the incubation temperature range of 9-18℃, the fertilization rate of eggs exceeded 90%. In the incubation temperature range of 12-16℃, the hatching rate exceeded 95%. In the temperature range of 9-16℃, the deformity rate of newly hatched larvae were less than 4%. The relationship between the total length of the newly hatched larvae and temperature was described by an quadratic function. In the temperature range of 9-22℃, differences in larvae body height were not large, and the yolk sac volume increased initially, then decreased and again increased. The relationship of yolk sac volume and temperature was expressed by a cubic function. In conclusion, increasing the incubation water temperature appropriately can reduce the incubation period. However, a water temperature that is too high adversely affects the hatching rate, the deformity rate, the absorption and utilization of nutrients, organ development and differentiation of the larvae. Considering the hatching cycle, hatching rate, deformity rate and body indices of the newly hatched larvae, the optimal temperature range for hatching S. waltoni embryo is 12-16℃.
Key words:Schizothorax waltoni; embryo development; fertilization rate; hatching rate; deformity rate; water temperature

