养殖尾水处理系统填料生物膜氮循环微生物功能特征
曲疆奇 张清靖 杨浩辰 赵萌 朱华

摘要:为探讨填料生物膜在养殖尾水处理中对水体氮循环的影响机制,采用16S rRNA基因扩增子测序和宏基因组测序技术,对填料生物膜、水体细菌的群落结构及其与氮循环相关的功能基因丰度差异特征进行了研究。结果显示,填料生物膜微生物主要参与氮代谢活动。在属水平上,Pseudomonas、Spirochaeta、Opitutus和Syntrophus是填料生物膜氮素转化过程的重要功能微生物类群。与水体相比,填料生物膜的碳代谢活动能力较强(P<0.05);填料生物膜上固氮功能基因nifH、硝化功能基因hao、反硝化和异化硝酸盐功能基因napA、nirS、norB、norC、nrfA、nirB和氮代谢调控基因ntrC及其相应的关键酶均显著高于周围水体(P<0.05),且对含氮污染物有显著去除效果。研究表明,养殖尾水处理系统内复合填料生物膜具有比周围水环境更强的氮周转能力,主要通过关键功能物种介导的固氮和反硝化作用实现养殖尾水氮素的转化和迁移。研究结果作为野外实验证据,可为复合填料生物膜系统在水产养殖尾水治理中的应用提供理论依据。
关键词:养殖尾水;填料生物膜;氮循环;功能微生物
中图分类号:X506 文献标志码:A 文章编号:1674-3075(2023)02-0104-10
水产养殖业作为现代农业发展的重要组成部分,水资源短缺和水污染已成为制约水产行业健康发展的关键问题。传统养殖池塘中高浓度的氨氮不仅会严重影响水产养殖动物机体组织、酶活性、代谢以及摄食活动,甚至造成死亡(王梦杰等, 2019);同时,氮素的累积也是池塘水体富营养化形成的重要因子(薛飞等, 2005)。因此,探索水产养殖绿色发展模式,加强池塘尾水处理与循环再利用,对于养殖水质调控和水生动物健康至关重要。填料生物膜水质净化技术是近年来发展的一种用于淡水养殖池塘尾水处理、养分循环再利用的可持续渔业生产新兴技术。相比于传统的理化方法,生物膜法在水体修复过程中具有清洁污染物效率高和经济成本低等优点(Zhao et al,2019)。在养殖池塘中,主要在池塘尾水端设置生物属性的载体填料,附着在载体上的生物膜主要由微生物及其胞外聚合物混合组成(Arunkumar et al,2020);生物膜在水体中具有较大的比表面积,从而为微生物生长和生物膜形成提供了良好的环境,同时增加空间异质性,加速氮污染物的去除效率(Ruiz et al,2020)。
微生物在水体氮循环过程中发挥重要作用,氮循环核心过程主要包括固氮作用、硝化作用、同化硝态氮还原(ANRA)、反硝化作用、异化硝态氮还原为铵(DNRA)等(Sun et al, 2019);其功能基因(如固氮nifH、反硝化narG、nirS和nosZ、硝化amoA)参与了不同的氮素转化过程(Zhang et al, 2020)。目前,随着宏基因组测序技术的快速发展,不仅能够快速获取目标微生物整个基因组信息(Zaheer et al, 2018),而且可以通过掌握微生物群落结构演替和与氮代谢相关编码酶及功能基因变化特征,解析微生物群落的物种间以及与环境间的相互作用机制,并将可能的基因表达功能变化归因于微生物群落中的某种特定物种(Chen et al, 2022a)。
研究表明,填料生物膜通过吸附、解吸、积累和降解等机制,影响污染物的迁移和分布(Morgan-Sagastume, 2018),并显著消减养殖水体中的氨氮、亚硝酸盐、硝酸盐等有害物质(Sun et al, 2019),从而实现养殖尾水原位脱氮修复,达到水质净化与环境修复目的。然而,目前关于养殖尾水处理过程中填料生物膜微生物在氮素迁移转化中功能特征(包括功能基因,功能微生物等)机理研究明显不足。为此,本研究利用宏基因组技术和16S扩增子高通量测序技术,联合研究填料生物膜在尾水处理过程中的微生物群落多样性特征、主要代谢活动以及氮循环功能基因和关键酶的变化特征,探讨核心功能微生物在氮素转化过程中的潜在驱动机制,以期为淡水养殖池塘尾水处理填料生物膜脱氮处理技术的发展提供野外试验数据。
1 材料与方法
1.1 试验材料
本试验于2020年在北京市农林科学院水产科学研究所示范基地进行试验。试验选用复合填料购自江苏华赛环保填料有限公司(图1)。填料参数规格为单元直径120 mm、塑料环片、密度为0.93 g/cm3的维纶醛化丝、套管、中心绳组成,每组填料间距100 mm,每根截成长度150 cm悬挂在钢架上,下端坠重物使生物填料能在水体中处于垂直状态,下端距池塘底部5 cm。在长×宽×深=65 m×55 m×2 m的池塘中铺设复合填料生物膜养殖尾水处理系统。当填料材料自然挂膜稳定后,在养殖高峰期的5-8月进行试验。
1.2 样本采集
每月分别采集池塘复合填料生物膜(Bioflm)养殖尾水处理系统填料样本(B组)300 g及搭载生物膜浮床系统(Floating-bed water)的周围水样(FW组)500 mL,每次均采集3个平行样,分别位于系统前端、中部和尾部,共采集24个样本用于16S rRNA高通量测序和宏基因组高通量测序分析,试验期间池塘养殖管理措施基本保持一致。分别在该系统进水口和出水后处使用英国Aquaread AP-700多参数便携式水质分析仪,现场测定水温(WT)、溶解氧(DO)、pH 和总固定悬浮物(TDS)等常规水质指标;同时,分别取等量的500 mL水样带回实验室,参照《水和废水监测分析方法》测定总氮(TN)、氨氮(NH4+-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)和总磷(TP)等水化指标。
1.3 微生物DNA提取和宏基因组测序
参考前人实验操作方法(Chen et al, 2022b),首先将填料生物膜样本剪碎后置于50 mL离心管中,并向离心管中注入适量的PBS缓冲液;然后在振荡器上震荡5 min,重复操作6次后收集水样,在低温环境下12 000 r/min下离心10 min,收集到的沉淀样本使用Fast DNATM Spin Kit for Soil(MP Biomedicals 美国)试剂盒抽提样本DNA;同时提取水环境样本DNA,待所有24个样本DNA浓度和纯度检验合格后,干冰保存寄送至上海美吉生物医药科技有限公司。
以细菌特异性引物338F: 5'-ACTCCTACGGGAGGCAGCAG-3', 806R: 5'-GGACTACHVGGGTWTCTAAT-3'扩增16S rRNA基因V3-V4高变区,构建测序文库后,基于illumina Miseq PE300高通量测序技术,对填料生物膜尾水处理系统内的微生物群落结构和多样性特征(其中α多样性指数包括香浓多样性指数、辛普森多样性指数和丰富度指数)进行研究;此外,利用NEXT flexTM Rapid DNA-Seq(Bio Scientific,美国)构建PE文库,使用Hiseq Xten(Illumina,美国)测序平台进行宏基因组测序,使用fastp(https://github.com/OpenGene/fastp,version 0.20.0)对原始数据reads进行质量剪切,对优化的reads进行拼接组装。使用Meta Gene(http://metagene.cb.k.u-tokyo.ac.jp/)对拼接结果中的contigs进行开放阅读框ORF预测,利用CD-HIT(http://www.bioinformatics.org/cd-hit/,version 4.6.1)构建非冗余基因集。最后,使用SOAP align软件(http://soap.genomics.org.cn/,version 2.21),分别将每个样品的高质量reads与非冗余基因集进行比对(95% identity),统计基因在对应样品中的丰度信息,对得到的基因进行NR(Amino acid sequence of non-redundant protein)物种注释和KEGG(Kyoto Encyclopedia of Genes and Genomes)功能注释,筛选得到与氮循环代谢相关的基因类群及其相对丰度信息。
1.4 数据处理
使用Excel 2007和R软件对试验数据进行数据处理和作图。采用STAMP对填料生物膜微生物主要代谢功能差异进行单因素Welch方差分析;利用R语言scale函数将不同量级的基因拷贝数进行数据离差标准化处理后,计算出相对丰度值;采用单因素(One-way ANOVA)分析填料生物膜上不同氮循环功能基因拷贝数的差异,其中*代表P<0.05,**代表P<0.01,***代表P<0.001。
[Ai = Xi-XminXmax-Xmin] ①
[φ = Ai i=0nA] ②
式中:Ai为样本i功能基因数据标准化值,Xi为样本i实际值,Xmax为样本数据的最大值,Xmin为样本数据的最小值,φ为样本相对丰度。
2 结果与分析
2.1 填料生物膜微生物多样性及群落结构特征
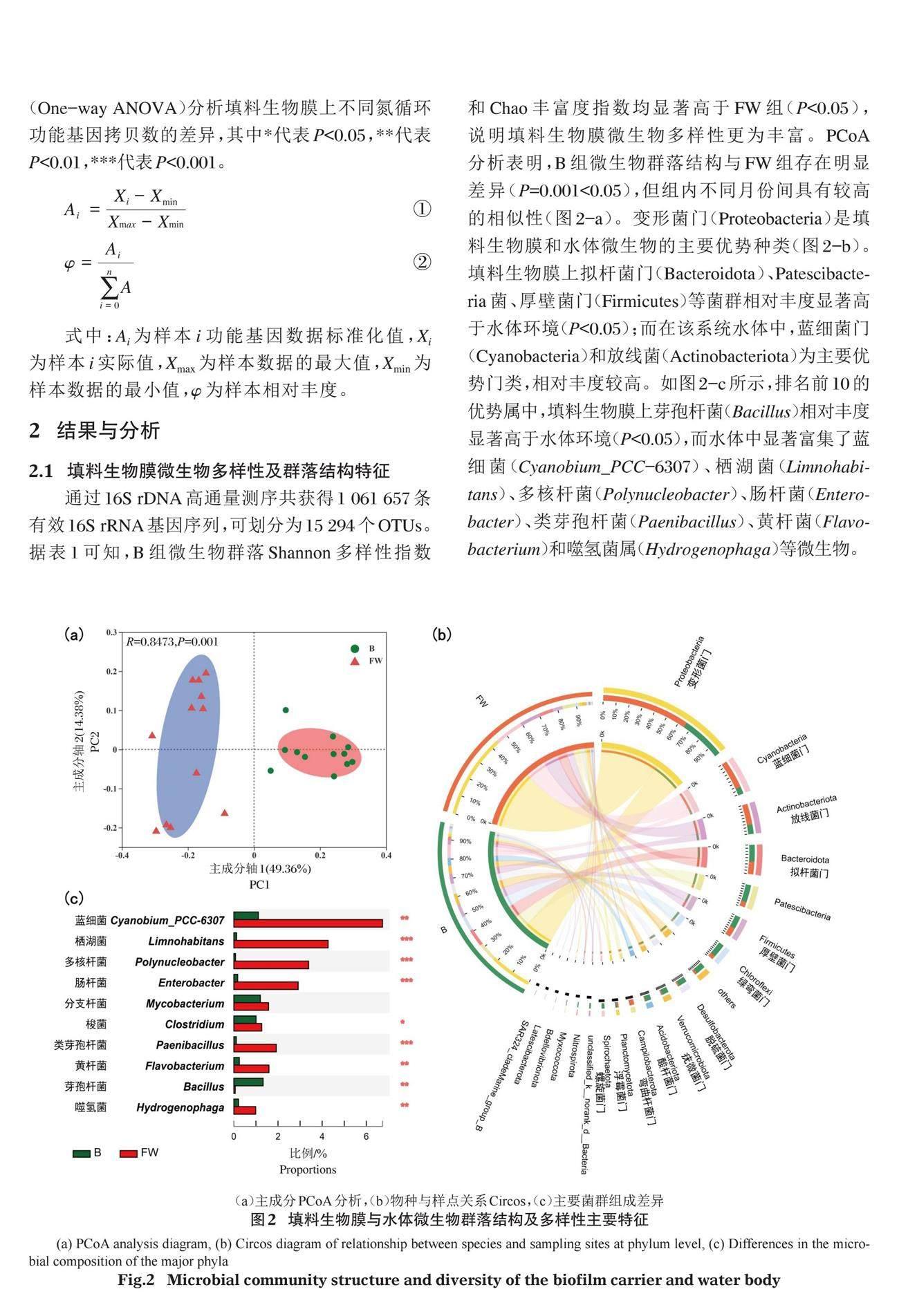
通过16S rDNA高通量测序共获得1 061 657条有效16S rRNA基因序列,可划分为15 294个OTUs。据表1可知,B组微生物群落Shannon多样性指数和Chao丰富度指数均显著高于FW组(P<0.05),说明填料生物膜微生物多样性更为丰富。PCoA分析表明,B组微生物群落结构与FW组存在明显差异(P=0.001<0.05),但组内不同月份间具有较高的相似性(图2-a)。变形菌门(Proteobacteria)是填料生物膜和水体微生物的主要优势种类(图2-b)。填料生物膜上拟杆菌门(Bacteroidota)、Patescibacteria菌、厚壁菌门(Firmicutes)等菌群相对丰度显著高于水体环境(P<0.05);而在该系统水体中,蓝细菌门(Cyanobacteria)和放线菌(Actinobacteriota)为主要优势门类,相对丰度较高。如图2-c所示,排名前10的优势属中,填料生物膜上芽孢杆菌(Bacillus)相对丰度显著高于水体环境(P<0.05),而水体中显著富集了蓝细菌(Cyanobium_PCC-6307)、栖湖菌(Limnohabitans)、多核杆菌(Polynucleobacter)、肠杆菌(Enterobacter)、类芽孢杆菌(Paenibacillus)、黄杆菌(Flavobacterium)和噬氢菌属(Hydrogenophaga)等微生物。
2.2 填料生物膜微生物主要代谢功能
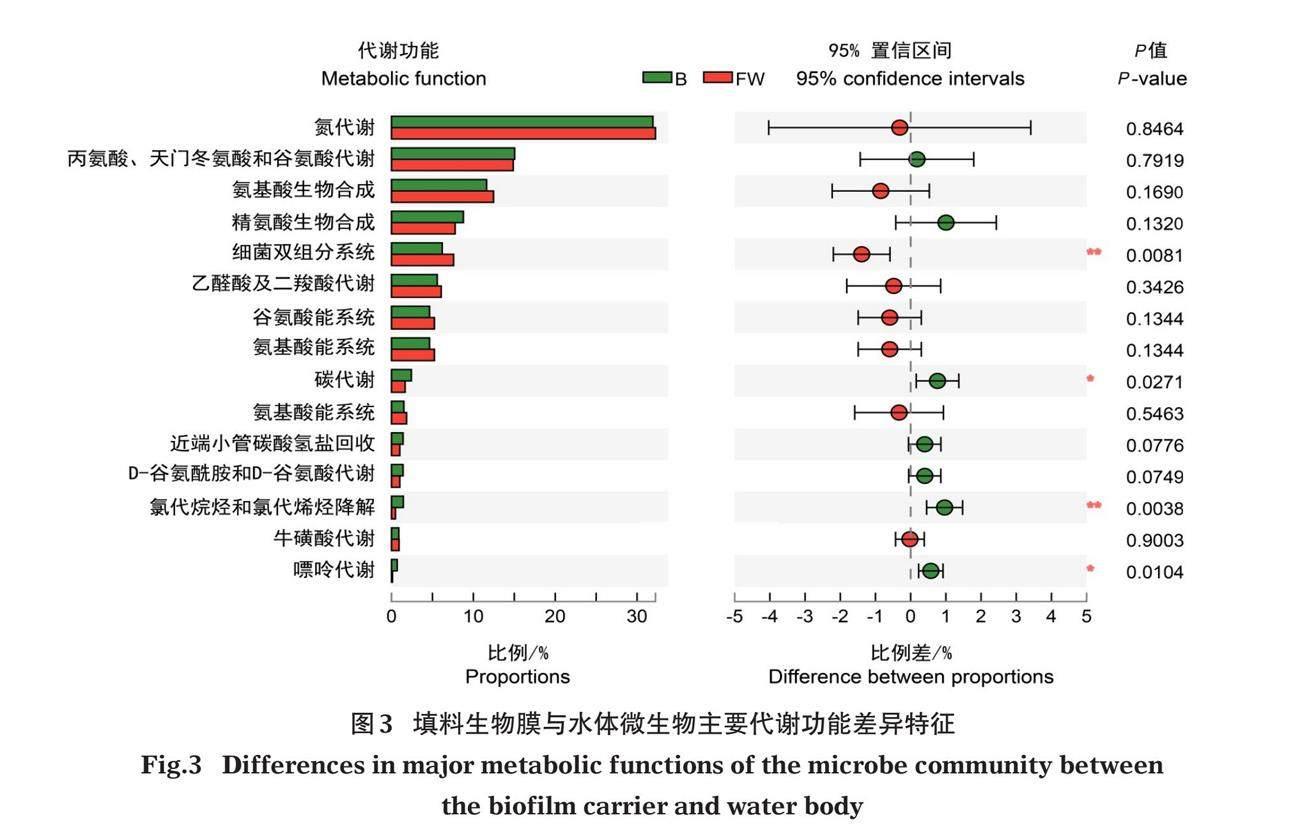
根据KEGG数据库微生物的三级功能分类(图3),相对丰度排名前5的分别是氮代谢、丙氨酸、天门冬氨酸和谷氨酸代谢、氨基酸生物合成、精氨酸生物合成、细菌双组分系统等代谢功能途径。结果表明,在养殖尾水处理系统中填料生物膜和水体微生物主要参与氮代谢和氨基酸代谢活动;其中,填料生物膜在细菌双组分系统功能途径上与周围水环境呈极显著性差异(P=0.008<0.01),说明填料生物膜微生物双组分系统能够快速响应周围水环境变化,并通过调控相关生理活动维持细胞体内碳氮代谢平衡。与水体相比,填料生物膜微生物在碳代谢和嘌呤代谢等代谢过程表现得更为活跃(P<0.05);此外,填料生物膜上氯代烷烃和氯代烯烃降解途径也显著增强(P=0.008<0.01),说明填料生物膜微生物可能对卤代烃污染物也有具有潜在的生物降解能力。
2.3 填料生物膜微生物氮循环功能基因和关键酶
填料生物膜和水体微生物参与的氮循环过程主要包括氮固定、硝化作用、反硝化作用、异化硝酸盐和同化硝酸盐还原作用5个主要途径(图4)。结果表明,参与氮循环的关键功能基因丰度发生了明显变化;其中,填料生物膜上有9个关键功能基因相对丰度显著高于周围水体(P<0.05)。主要包括氮循环固氮功能基因nifH、硝化作用功能基因hao、反硝化和异化硝酸盐还原作用功能基因napA、nirS、norB、norC、nrfA和nirB以及氮代谢调控基因ntrC。而在水体中,硝化作用功能基因amoA相对丰度较高(P<0.05),其他功能基因在2组中无显著性差异(P>0.05);此外,共检测到27个与氮代谢通路相关的关键编码酶信息。与水体相比,填料生物膜上固氮酶(nitrogenase,EC1.18.6.1)、羟胺还原酶(hydroxylamine reductase,1.7.99.1)和氧化亚氮还原酶(nitrous-oxide reductase,EC1.7.2.4)和一氧化氮还原酶(nitric oxide reductase,EC1.7.2.5)、细胞色素C亚硝酸盐还原酶(nitrite reductase (cytochrome),EC1.7.2.2)的相对丰度较高(P<0.05)(图5)。这些关键酶主要催化氮循环中的固氮反应、硝化反应、反硝化反应和DNRA过程。由此可见,填料生物膜上是养殖尾水处理系统内生物固氮和生物脱氮过程的主要场所。
2.4 填料生物膜核心功能微生物
物种与功能贡献度关联分析(图6-a)结果表明,在属水平上共筛选出16个填料生物膜核心功能物种,分别在固氮、反硝化作用和异化硝酸盐还原途径贡献比例较高。其中,固氮假单胞菌(Pseudomonas)在固氮途径所占丰度最大(>50%),其他贡献度较高的分别是甲基杆菌(Methylobacter)、地杆菌(Geobacter)和荚硫菌(Thiocapsa);螺旋菌(Spirochaeta)完全与反硝化作用有关,每个月的贡献度均为100%;而丰佑菌(Opitutus)和互营菌(Syntrophus)完全参与异化硝酸盐还原途径,每个月的贡献度也为100%,其他均菌属均同时参与反硝化和异化硝酸盐还原途径。从图6-b可以看出,上述核心功能微生物中,Spirochaeta、Syntrophus、Methylobacter等微生物主要富集在填料生物膜上,并在氮循环过程中发挥了重要作用。
2.5 填料生物膜养殖尾水处理系统的水质变化
试验期间,温度、溶解氧浓度、总固体悬浮物和 pH 值等常规水质指标在养殖尾水净化前后均无显著性差异(P>0.05);而养殖尾水经填料生物膜养殖尾水系统处理后,水体中的总氮、氨氮、硝态氮、亚硝态氮浓度均显著降低(P<0.05)(表2),说明铺设填料生物膜系统后可以有效去除养殖尾水中含氮污染物。
3 讨论
3.1 填料表面微生物显著增强生物膜氮代谢功能
填料表面微生物群落通过聚集及其代谢产物共同形成生物膜结构,占据了膜系统微生态环境的主要生态位(Mahto & Das, 2022)。本研究结果表明,在尾水处理过程中氮代谢是填料生物膜参与最主要的代谢活动,同时会耦联细菌双组分系统、碳代谢和氨基酸合成与代谢等生理活动(图3)。细菌双组分系统是存在于细菌内的一种信号传导系统,通过参与和调控多个生理代谢过程,维持自身细胞碳氮平衡(Li & Lu,2007)。研究发现,氮代谢调控蛋白NtrC普遍存在于细菌中,是微生物氮代谢调控系统中双组分系统;NrtC蛋白由ntrC基因编码,主要参与固氮微生物的一般氮代谢和固氮过程。本研究结果显示(图4),填料生物膜ntrC基因相对丰度高于水体,说明填料生物膜能够快速响应系统内水环境变化。研究表明,NrtC蛋白能够与碳代谢调控蛋白CbrB发生偶联作用(李琴等, 2013);在微生物胞外聚合物(EPS)的作用下,可将大分子有机污染物降解成水溶性低分子的氨基酸、单糖和无机酸等,从而使污染物得到降解(林治岐等, 2018);此外,吸附在载体上的营养物质含有大量氨基酸,会增强生物膜上嗜氨基酸类细菌活性,从而微生物更容易利用氨基酸类和羧酸类等碳源物质强化生物膜形成(车建锋等, 2017)。研究发现,芽孢杆菌、假单胞菌、硫杆菌等微生物均可利用氨基酸和羧酸类作为营养源(庄康等,2020),这些微生物也是本研究中填料生物膜的主要功能类群;其中,芽孢杆菌是水产养殖水环境中一种主要的嗜氨基酸类细菌,能够显著提高水体微生物群落代谢的多样性(杨莺莺等,2009)。本研究结果表明,芽孢杆菌显著富集在填料生物膜上(图2-c),不仅可以提高微生物代谢活性,而且有利于降解有机物并改善养殖水体环境(李卓佳等,2007)。
3.2 填料生物膜有利于固氮微生物富集
微生物介导的固氮过程在生态系统氮循环和平衡中具有极为重要的作用。微生物固氮作用由高度保守负责编码钼铁固氮酶nif基因(包括nifH、nifD、nifK基因)催化完成(马贵兴和井申荣, 2013),其中nifH被广泛用于检测环境样本中固氮微生物多样性(Baskaran & Prabavath, 2022)。本研究中,填料生物膜上nifH基因微生物种群的丰度较高 (图4),说明填料生物膜上富集了大量的固氮微生物。固氮假单胞菌(Pseudomonas)对固氮途径贡献度最大,其次是甲基杆菌(Methylobacter)和地杆菌(Geobacter)(图6-a),这些核心微生物主要富集在填料生物膜上(图6-b)。研究发现,假单胞菌中Gac/Rsm系统主要参与固氮和生物膜形成(张译兮等,2019)。通过调控生物膜形成关键蛋白RpoN(Shang et al, 2021)在转录水平上激活nifH基因,从而触发Gac/Rsm系统中的RsmZ,并在RpoS蛋白制动作用下调控假单胞菌固氮生物膜的形成(Zhang et al, 2021);而在生物膜上,富集的Geobacter菌不仅是关键固氮微生物类群,而且其还是一种具有产电、吸电功能的电活性微生物(Ye et al, 2022);电活性微生物是生物膜重要组成部分,可在EPS介导下通过胞外电子传递实现污水处理、生物固氮与清洁电能生产的三重功效(Jing et al, 2022),因此也是当前废水处理和其他污染控制措施中最有前途的生物膜类型之一(Li et al, 2021a);与此同时,具有固氮生理活性的好氧甲烷氧化菌Methylobacter更倾向消耗中生物膜内部的氧气(Costa et al, 2022),从而增强甲烷氧化过程,并为反硝化作用创造厌氧微环境(Cao et al, 2021)。由此可见,Pseudomonas、Methylobacter和Geobacter等核心功能微生物主要通过自身不同的氮代谢调控途径和生理功能特征,促进填料生物膜的形成,提高生物膜的固氮能力,同时也为反硝化过程提供了缺氧环境条件。
3.3 功能菌群促进填料生物膜反硝化脱氮过程
反硝化和异化硝酸盐还原作用均可还原硝酸盐氮,是废水处理中生物脱氮的关键途径(张博雅和余珂, 2020)。本研究中,填料生物膜微生物反硝化和异化硝酸盐还原作用的功能基因(图4)和关键酶的丰度(图5)明显增加;其中,功能基因norB和nosZ分别是编码一氧化氮还原酶 Nor 和一氧化二氮酶Nos的关键反硝化菌群结构的分子标记(梁丽华和左剑恶, 2009);两者丰度的显著增加,说明填料生物膜微生物能够促进氮素一氧化氮向氮气完成转化,从而完成脱氮过程。试验结果表明,中空纤维膜生物反应器中的优势菌Spirochaeta能够利用反硝化去除一氧化氮(Razaviarani et al, 2019)。本研究中,Spirochaeta菌具有完全参与反硝化过程的能力(图6-a);此外,异化硝酸盐还原途径是废水处理中维持厌氧氨氧化过程强化脱氮的关键步骤,其中nrfA功能基因是造成DNRA差异的关键生物因子,填料生物膜上高nrfA功能基因丰度说明,填料生物膜DNRA群落占据主要了主要生态位。有研究发现,A2/O 生物反应器(FBBR)中厌氧氨氧化细菌对缺氧填料生物膜具有显著的生态位偏好(Li et al, 2021b)。在本研究中,填料生物膜上Syntrophus菌和Opitutus菌完全参与异化硝酸盐还原途径。Syntrophus菌是一种极端厌氧氨氧化细菌,也是为数不多能够降解有机物脂肪酸的生命形式,在全球碳循环中发挥关键作用(Mcinerney et al, 2007);此外,Opitutus菌是厌氧消化反应器中有机物厌氧降解产二氧化碳和甲烷过程中的关键功能类群(张雪等,2019)。研究发现,Opitutus菌株PB90-1拥有编码反硝化和异化硝酸盐还原途径的完整功能基因(Sanford et al,2012)。因此,填料生物膜上的功能菌群在异化硝酸盐还原成铵和反硝化脱氮过程中发挥着关键性的作用。然而,有关填料生物膜微生物复杂群落中种间的异质相互作用非常复杂,其参与氮素转化机制需要进一步深入研究加以证实,这也是未来生物膜技术在废水生物处理应用中的重要研究方向之一。
参考文献
车建锋,李志斐,王广军,等,2017. 混养池塘生物膜微生物群落功能多样性特征分析[J]. 上海海洋大学学报, 26(6):862-871.
国家环境保护总局,2002. 水和废水监测分析方法[M]. 第4版. 北京:中国环境科学出版社.
李琴,燕永亮,苏磊,等,2013. 一般氮代谢调控蛋白NtrC的研究进展[J]. 中国农业科技导报, 15(3):113-122.
李卓佳,林亮,杨莺莺,等,2007. 芽孢杆菌制剂对虾池环境微生物群落的影响[J]. 农业环境科学学报, 26(3):1183-1189.
梁丽华,左剑恶,2009. 反硝化功能基因——检测反硝化菌种群结构的分子标记[J]. 微生物学通报, 36(4):627-633.
林治岐,张信,邵尉,等,2018. 废水生物处理过程中微生物胞外聚合物与污染物的分子间相互作用[J]. 中国科学:化学, 48(9):1102-1108.
马贵兴,井申荣,2013. 固氮分子机理及固氮基因转移研究进展[J]. 生命科学, 25(1):113-118.
王梦杰,陈建华,王海华,2019. 氨氮对水产动物的毒性效应研究进展[J]. 江西水产科技, (2):38-43.
薛飞,周维仁,徐小明,2005. 养殖水体富营养化的成因与危害[J]. 江苏农业科学, (6):121-124.
杨莺莺,李卓佳,梁晓华,等,2009. 芽胞杆菌对鱼池微生物群落代谢功能的影响[J]. 微生物学杂志, 29(3):11-17.
张博雅,余珂,2020. 微生物基因数据库在氮循环功能基因注释中的应用[J]. 微生物学通报, 47(9):3021-3038.
张雪,张辉,承磊,2019. 获取有机物厌氧降解产甲烷过程中关键功能类群——互营细菌培养物[J]. 微生物学报, 59(2):211-223.
张译兮,张亚妮,马艳玲,等,2019. 铜绿假单胞菌中Ⅲ型分泌系统调控机制及针对性治疗的研究进展[J]. 微生物学通报, 46(2):362-373.
庄康,胡晓娟,曹煜成,等,2020. 不同寡营养培养条件下南海水体细菌群落结构及其对碳源的利用特征[J]. 微生物学通报, 47(9):2697-2710.
Arunkumar M, Lewisoscar F, Thajuddin N, et al, 2020. In vitro and in vivo biofilm forming Vibrio spp: A significant threat in aquaculture[J]. Process Biochemistry, 94:213-223.
Baskaran V, Prabavath V R, 2022. Diverse key nitrogen cycling genes nifH, nirS and nosZ associated with Pichavaram mangrove rhizospheres as revealed by culture-dependent and culture-independent analyses[J]. Archives of Microbiology, 204(1):109.
Cao Q, Li X, Xie Z, et al, 2021. Compartmentation of microbial communities in structure and function for methane oxidation coupled to nitrification-denitrification[J]. Bioresource Technology, 341:125761.
Chen G, Bai R, Zhang Y, et al, 2022a. Application of metagenomics to biological wastewater treatment[J]. Science of The Total Environment, 807:150737.
Chen J, Li W, Tan Q, et al, 2022b. Effect of disinfectant exposure and starvation treatment on the detachment of simulated drinking water biofilms[J]. Science of The Total Environment, 807:150896.
Costa R B, Lens P N L, Foresti E, 2022. Methanotrophic denitrification in wastewater treatment: microbial aspects and engineering strategies[J]. Critical Reviews in Biotechnology, 42(1):145-161.
Jing X Y, Liu X, Zhang Z S, et al, 2022. Anode respiration-dependent biological nitrogen fixation by Geobacter sulfurreducens[J]. Water Research, 208:117860.
Li J, Peng Y, Gao R, et al, 2021a. Highly enriched anammox within anoxic biofilms by reducing suspended sludge biomass in a real-sewage A2/O process[J]. Water Research, 194:116906.
Li Z, Zhang P, Qiu Y, et al, 2021b. Biosynthetic FeS/BC hybrid particles enhanced the electroactive bacteria enrichment in microbial electrochemical systems[J]. Science of The Total Environment, 762:143142.
Li W, Lu C D, 2007. Regulation of Carbon and Nitrogen Utilization by CbrAB and NtrBC Two-Component Systems in Pseudomonas aeruginosa[J]. Journal of Bacteriology, 189(15):5413-5420.
Mahto K U, Das S, 2022. Bacterial biofilm and extracellular polymeric substances in the moving bed biofilm reactor for wastewater treatment: A review[J]. Bioresource Technology, 345:126476.
Mcinerney M J, Rohlin L, Mouttaki H, et al, 2007. The genome of Syntrophusaciditrophicus: Life at the thermodynamic limit of microbial growth[J]. Proceedings of the National Academy of Sciences, 104(18):7600-7605.
Morgan-Sagastume F, 2018. Biofilm development, activity and the modification of carrier material surface properties in moving-bed biofilm reactors (MBBRs) for wastewater treatment[J]. Critical Reviews in Environmental Science and Technology, 48(5):439-470.
Razaviarani V, Ruiz-Uriguen M, Jaffe P R, 2019. Denitrification of Nitric Oxide Using Hollow Fiber Membrane Bioreactor, Effect of Nitrate and Nitric Oxide Loadings on the Reactor Performance and Microbiology[J]. Waste and Biomass Valorization, 10(7):1989-2000.
Ruiz P, Vidal J M, Sepul Veda D, et al, 2020. Overview and future perspectives of nitrifying bacteria on biofilters for recirculating aquaculture systems[J]. Reviews in Aquaculture, 12(3):1478-1494.
Sanford R A, Wagner D D, Wu Q, et al, 2012. Unexpected nondenitrifier nitrous oxide reductase gene diversity and abundance in soils[J]. Proceedings of the National Academy of Sciences, 109(48):19709-19714.
Shang L, Yan Y, Zhan Y, et al, 2021. A regulatory network involving Rpo, Gac and Rsm for nitrogen-fixing biofilm formation by Pseudomonas stutzeri[J]. NPJ Biofilms and Microbiomes, 7(1):1-15.
Sun S, Liu J, Zhang M, et al, 2019. Simultaneous improving nitrogen removal and decreasing greenhouse gas emission with biofilm carriers addition in ecological floating bed[J]. Bioresource Technology, 292:121944.
Ye Y, Liu X, Nealson K H, et al, 2022. Dissecting the Structural and Conductive Functions of Nanowires in Geobacter sulfurreducens Electroactive Biofilms[J]. mBio, 13(1):e03822.
Zaheer R, Noyes N, Ortega Polo R, et al, 2018. Impact of sequencing depth on the characterization of the microbiome and resistome[J]. Scientific Reports, 8(1):5890.
Zhang X, Ward B B, Sigman D M, 2020. Global Nitrogen Cycle: Critical Enzymes, Organisms, and Processes for Nitrogen Budgets and Dynamics[J]. Chemical Reviews, 120(12):5308-5351.
Zhang C, Wang C, JattA N, et al, 2021. Role of RpoS in stress resistance, biofilm formation and quorum sensing of Shewanellabaltica[J]. Letters in Applied Microbiology, 72(3):307-315.
Zhao Y, Liu D, Huang W, et al, 2019. Insights into biofilm carriers for biological wastewater treatment processes: Current state-of-the-art, challenges, and opportunities[J]. Bioresource Technology, 288:121619.
(责任编辑 万月华)
Functional Characteristics of Nitrogen Cycling Microbes in the Biofilm Carrier
of an Aquaculture Tailwater Treatment System
QU Jiang‐qi1, ZHANG Qing‐jing1, YANG Hao‐chen1,2, ZHAO Meng1, ZHU Hua1
(1. Beijing Key Laboratory of fishery Biotechnology, Fisheries Science Institute,
Beijing Academy of Agriculture and Forestry Sciences, Beijing 100068, P.R. China;
2. Dalian Ocean University, Dalian 116023, P.R. China)
Abstract: In this study, we explored the differences in bacterial community structure and abundance in the functional genes related to nitrogen cycling between the biofilm carrier and pond water of an aquaculture tailwater treatment system. Our objective was to better understand the mechanism by which the biofilm carrier effects nitrogen cycling during tailwater treatment. The study was carried out from May to August of 2020 in an aquaculture pond (65 m×55 m×2 m) with a biofilm carrier treatment system. After the biofilm stabilized on the carrier, samples of the biofilm and pond water were collected monthly for microbial analysis by 16S rRNA gene amplicon sequencing and metagenomic sequencing. As samples were collected, some water quality parameters were determined in situ and others by laboratory analysis. Results show that nitrogen metabolism was carried out primarily by biofilm microbes and, at the genus level, the primary bacterial groups involved with nitrogen transformations included Pseudomonas, Spirochaeta, Opitutus and Syntrophus. Compared with the pond water, carbon metabolic activity in the biofilm carrier was significantly stronger (P<0.05). The relative abundance of the functional gene nifH (nitrogen fixation), hao (nitrification), napA, nirS, norB, norC, nrfA and nirB (denitrification) and ntrC (nitrogen metabolism regulation) and their corresponding key enzymes were significantly higher than those in the surrounding water (P<0.05). Further, the biofilm carrier system significantly decreased nitrogen concentration, indicating that the biofilm microbes had a stronger nitrogen turnover rate than the surrounding water environment. Our results show that biofilm microbes in the aquaculture tailwater treatment system were primarily involved in the transformation and migration of nitrogen through nitrogen fixation and denitrification. The field data from this study provide a theoretical basis for implementing biofilm carrier systems for treating aquaculture tailwater.
Key words:aquaculture tailwater; biofilm carrier; nitrogen cycle; functional microorganisms

