环境盐度对红耳龟卵孵化及稚龟形态表型和行为的影响
孔雨晨 梁方槟 王晓丹 黄鹏 张苗苗 洪美玲 史海涛 丁利


摘要:为了探究全球气候变化背景下淡水和沿岸土壤盐化对龟类生存造成的威胁和挑战,了解盐度变化对龟类早期生活史的影响,以红耳龟(Trachemys scripta elegans)为研究对象,设置淡水对照组(CK)、0.5盐度组(S0.5)、2.5盐度组(S2.5)和5盐度组(S5),分析盐度变化对其受精卵孵化、稚龟表型及行为特征的影响。结果显示,随着基质中盐度的升高,CK、S0.5、S2.5、S5组红耳龟稚龟孵化率(80.00%、83.33%、60.00%、43.33%)基本呈下降趋势,孵化时间(51、52、54、53 d)略有增加,稚龟在30 d时的存活率(95.83%、95.83%、94.44%、81.80%)逐渐下降,并导致孵出个体的畸形率增加,且以龟甲畸形占比最高(S5组为100%)。高盐度(S5)基质中孵出的稚龟,其体重极显著低于对照组(P<0.01),背、腹甲的长度和宽度也显著低于对照组(P<0.05)。稚龟的运动速度及耐力受到显著抑制,翻身速度变慢,摄食能力显著降低(P<0.05)。研究表明,红耳龟作为一种耐受性较强的淡水龟代表,上升的环境盐度可直接影响其受精卵的孵化率、初生幼体的存活率及适合度,对红耳龟卵孵化和稚龟行为具有显著的负面效应。由此推断淡水咸化对其他淡水龟类的影响可能更为严重。
关键词:红耳龟;盐度;孵化;形态表型;行为特征
中图分类号:Q142 文献标志码:A 文章编号:1674-3075(2023)02-0128-08
淡水咸化是一个复杂的动态过程,受气候变暖、海平面上升、地质以及人类活动如农业灌溉、工业生产、自然资源利用等诸多因素影响,内陆淡水和沿海等处的盐浓度正在持续增加(Ven?ncio et al,2019)。在全球气候变暖的过程中,海洋变暖引起的热膨胀以及冰盖融化的加速,导致海平面加速上升(Frederikse et al,2020)。联合国政府间气候变化专门委员(IPCC)预测,至2100年,全球海平面将上升1.0~1.1 m (Levermann et al,2013),由此导致海(咸)水入侵加剧,全球50多个国家和地区均发现了海(咸)水入侵现象(Williams,2001)。
河岸、海岸是陆地和水生生态系统的交错地带,受径流、潮流、盐水入侵等共同影响,在水体盐度上升的同时,河岸带基质、土壤中的盐度也必然升高,且存在积累效应,环境盐度的升高对生物可产生严重的负面效应,并影响其生存、繁殖等(Ca?edo-Argüelles et al,2016)。与恐龙同时代的龟类是生态系统重要的组成部分,在目前已知的约360种现存龟类中,大部分龟类是半水生或水生淡水龟,其中约240种沿着海岸线或河口延伸带分布。在全球升温的大环境下,许多现存的沿海分布龟类物种(约占90%)在某种程度上受到淡水生境盐水入侵的影响(Agha et al,2018);淡水盐化环境中动物生态位、种群、生理调控等方面的研究也得到重视(Ven?ncio et al,2019)。
目前,关于盐度对水生动物生命早期的影响研究主要集中在受精卵孵化、胚胎发育等方面。例如,奥尼罗非鱼(Oreochromis niloticus × O.areus)受精卵随着盐度的增加,其孵化周期逐渐增加,当胚胎破膜并发育一段时间后,盐度越高、畸形率越高、死亡个体越多(强俊等,2009)。淡水龟类多沿河岸筑巢产卵,故随着沿岸基质中盐度的增加,其孵化、幼体发育及行为等或将受到影响。红耳龟(Trachemys scripta elegans)广泛分布于世界各地淡水水域中,具有较强的代表性,被广泛应用于科研,如温度决定性别机制、胚胎发育、生态环境的影响作用等(Koshiba-Takeuchi et al,2009;Weber et al,2020; Ding et al,2021)。本次实验选取红耳龟作为研究对象,探究盐度对红耳龟卵孵化及稚龟行为的影响,以期揭示淡水咸化对全球淡水龟类繁殖和稚龟行为的影响。
1 材料与方法
1.1 实验材料
实验用红耳龟受精卵购于海口市鸿旺龟鳖养殖场,所有龟卵均在产下后24 h内收集。各组间卵重均值为(10.27±0.134)g,无显著性差异(P>0.05,n=30)。龟卵从养殖场带回实验室,静置12 h后进行形态学指标测定。随机各选取30枚受精卵半埋于不同盐度的孵化基质中(由干蛭石分别与不同盐度的水和淡水以质量比1:1 配合而成,湿度为-220 kPa)。利用HEM-3D模型预测的盐度变化,当海平面上升0.5 m和1.0 m时,平均盐度增加分别为2和4(Rice et al,2012)。本实验将盐度设定为低、中、高3个浓度组,即盐度0.5、2.5、5(分别以S0.5、S2.5、S5表示),同时设置淡水对照组(CK),每组设置3个平行。将受精卵白斑面朝上,置于孵卵盒(32.5 cm×22.3 cm×10.0 cm)内,放置于智能恒温恒湿孵化箱内,根据红耳龟正常孵化条件,将温度设定为29℃。每天查看一次蛭石湿度和盐度并进行调节,待稚龟出壳后开展相关形态学及行为学实验。
1.2 实验方法
1.2.1 孵化率、存活率及畸形率统计 临近稚龟破壳,每日定时查看龟卵孵化情况,及时将刚破壳的稚龟进行编号、拍照。稚龟自行破壳后,记录其畸形情况,并记录孵出30 d时稚龟的存活率。
1.2.2 初生幼体形态指标测量 稚龟的形态学指标均使用精密电子天平([±]0.1 mg)和电子游标卡尺([±]0.01 cm)进行测量。在稚龟孵出的第1、3、7 天进行卵黄囊直径测量,稚龟孵出的第1、3、7、14、30 天进行背甲长、背甲宽、腹甲长、腹甲宽及体重的测量。第1天和第3天的稚龟用软毛刷轻轻刷去卵黄囊表面的蛭石,测量其卵黄囊直径,测定完毕后放置于原孵化对应盐度的蛭石中。第7天稚龟卵黄囊基本吸收,测量其卵黄囊直径(腹甲中间缝隙的宽度)后,将卵黄囊完全吸收的稚龟放入相对应的盐度水中。
1.2.3 稚龟的行为学观察 (1)稚龟翻身能力比较。取孵出7 d的稚龟,置于装置盒(44.2 cm×37.5 cm×7.4 cm)中,并将其放至有透明玻璃板的29℃恒温箱内。测量之前,先将龟放入恒温箱中适应10 min,将需要测定的龟一次性放入盒中并开始摄像,依次将龟翻转过来后,人迅速离开,每隔3~4 min隔着门上玻璃观察其是否全都翻身成功。实验设置最长翻身时间为10 min。10 min中内如若有龟未翻身成功,终止实验。每只稚龟重复测量3次。
(2)稚龟摄食能力比较。红耳龟稚龟的卵黄可维持机体约1个月的能量供应(盛成等,2017),故本研究于稚龟第28天时开始第1次喂食。各组中分别按照每只稚龟3粒饲料投喂足量的龟鳖养殖专用饲料(主要成分为鱼粉、虾粉等),2~3 h后将水中剩余饲料全部捞出,统计各组的进食数量,计算出摄食率。
(3)稚龟运动能力比较。对孵出30 d的稚龟进行运动能力测定。测定前,在其孵出第28天时饱食投喂1次。实验跑道为长方形水槽(120 cm×40 cm×28 cm),水位5 cm,确保高于龟背甲;跑道底部放一卷尺作为距离参照物,并模拟外界环境铺设一薄层细沙。在距离稚龟1~2 cm处用毛笔或小木棍使水产生波动,当稚龟在水槽内游一个来回后,结束实验。若稚龟长时间(>5 min)不动,则放弃实验。通过回放录像记录其疾跑速度(稚龟泳过25 cm的最大速度)、停顿次数(次/min)和最大持续运动距离(耿军,2017)。
1.3 数据处理
本实验所有数据均使用Office 2010整理。行为实验录像通过视频播放软件(ACG player)处理,数据所用时间精度为0.1 s。所得数据采用(平均值±标准误)表示,使用SPSS 20进行数据处理。对稚龟的形态学指标和运动能力指标进行单因素ANOVA LSD和Duncan分析,并进行双变量Pearson相关性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 盐度对孵化率和孵化时间的影响
随着环境中盐度的升高,CK、S0.5、S2.5、S5红耳龟稚龟孵化率(80.00%、83.33%、60.00%、43.33%)基本呈下降趋势(图1-A),尤其是S5盐度组的孵化率显著降低(P<0.05);此外,随着盐度的进一步增加,孵化时间(51、52、54、53 d)略有增加,盐度进一步升高,孵化时间稍有缩短,但与对照组差异并不显著(图1-B)。
2.2 环境盐度对稚龟存活率的影响
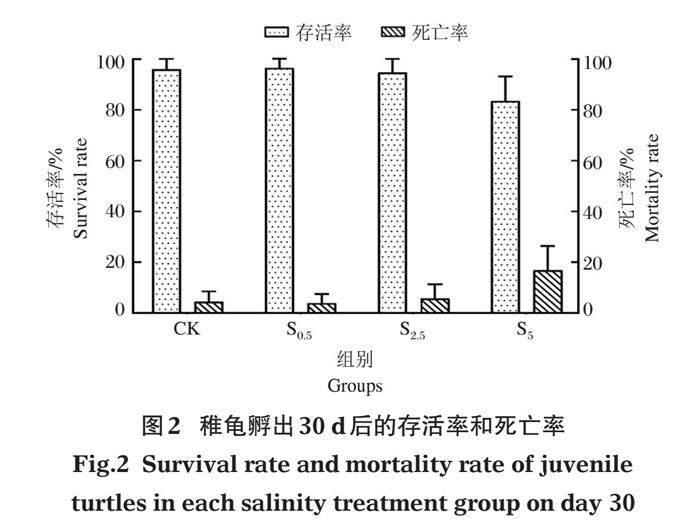
CK、S0.5、S2.5、S5组稚龟在30 d时的存活率为95.83%、95.83%、94.44%、81.80%。由此可见孵化基质盐度及水体盐度增加了孵出龟的死亡率(图2)。
2.3 环境盐度对稚龟的影响
2.3.1 稚龟形态表型 盐度导致稚龟形态发育异常,主要表现在背腹甲畸形、眼球及尾部未发育或发育不完整等(图3)。
随着孵化基质中的盐度增加,孵出的稚龟形态异常个体呈上升趋势,尤其是S5组,异常个体达到了60%(图4-A)。在各形态表型中,以龟甲的畸形率最高,其中S5组龟甲的畸形率高达100%(图4-B)。
2.3.2 稚龟体指标 S5组中孵出的稚龟在1、3、7、14、30 d时体重极显著低于对照组(P<0.01),与环境中盐度大小呈显著负相关(P<0.05);稚龟腹甲长、背甲长、背甲宽在孵出后1、3、7、14 d时显著低于对照组(P<0.05),但S0.5和S2.5组中孵出的稚龟体重、背腹甲指标等与对照组无显著差异(P>0.05);稚龟卵黄囊直径各组间差异不显著(表1,图5)。
2.4 稚龟行为学观察
2.4.1 翻身能力 稚龟孵出7 d时,其翻身速度与环境盐度呈负相关(图6)。对照组稚龟翻身所需平均时间为71.63 s,较低盐度组稚龟翻身所需时间虽稍短,但与对照组差异不显著(P>0.05);而S5组稚龟翻身所需时间较对照组长,平均为82.5 s。
2.4.2 摄食能力 随着环境盐度的升高,稚龟的摄食率逐渐降低(图7),尤其是高盐度组(S5)稚龟的摄食率只有47.69%,与对照组相比差异显著 (P<0.05)。
2.4.3 运动能力 在孵出30 d时,稚龟的疾跑速度及最大持续运动距离与盐度呈显著负相关(P<0.05)。S0.5和S2.5组的稚龟疾跑速度虽有所下降,但与对照组(7.34±0.72)cm/s相比,差异并不显著(P>0.05),S5组的稚龟疾跑速度明显降低(图8-A),下降约40%,且与对照组有显著差异(P<0.05);此外,S5组稚龟运动时的最大持续距离显著缩短(图8-B),由对照组的58.17 cm缩短至39.09 cm。
3 讨论
全球气候变化背景下,淡水咸化对淡水生物的影响越来越受到保护生物学家的关注,尤其是对淡水生物早期生活史阶段的影响日益受到重视(Ven?ncio et al,2019)。如高盐导致了中华绒螯蟹(Eriocheir sinensis)卵中水分流失、卵体积减少,从而抑制胚胎发育(Wang et al,2019);盐度降低了帕达绚鲶(Ompok pabda)孵化率,幼体的发育速率下降等(Alam et al,2020)。作为生态系统中重要的组成部分,淡水龟类的生存和繁殖等也面临着严重威胁和挑战。
3.1 盐度显著影响龟卵孵化及稚龟形态表型
本研究发现,孵化基质中一定范围的盐度对红耳龟受精卵的孵化率、稚龟存活率和畸形率均产生较大影响,S5组中龟卵的孵化率仅为33.3%,而畸形率高达60%,由此推测较低的孵化率将显著影响淡水龟类种群的数量;同时,盐度对稚龟出生时体重影响较大,S5盐度组的稚龟体重极显著低于对照组(P<0.01),说明孵化环境中的盐度可能导致受精卵脱水,尽管孵出了幼体,但稚龟的整体形态指标明显弱于淡水对照组,其后续生存可能会受到一定影响。畸形情况直接影响其适合度,如高盐度下棘颊雀鲷(Premnas biaculeatus)胚胎出现了畸形,并导致其死亡率增加(王珊珊,2015)。本研究发现,盐度环境中稚龟形态表型出现异常,畸形率升高,其中龟甲、尾部、四肢等呈现异常发育,这些异常表型对于稚龟生存将产生深远影响。龟甲起着pH值缓冲和水、脂肪或废物储存库的作用,对于龟类的物理保护具有环境适应性价值(Gilbert et al,2001)。龟甲缺损可使其物理屏障功能减退,龟甲凹陷或凸起可能会影响其运动能力,龟甲畸形也可能干扰其交配;尾部不能弯曲也会影响其运动能力。由此推测,随着环境盐度的升高,淡水龟类子代将受到显著影响,如子代数量减少、存活率及适合度下降等。
3.2 盐度显著影响初生幼体的环境适合度
进化生态学中常用综合适合度来反映自然种群的适应性和变异性,不同物种的综合适合度指标有所不同,对于淡水龟类来说,翻身行为、运动行为和摄食行为是反映其适合度的常用指标(耿军,2017)。翻身行为是当龟类个体腹甲朝上后恢复至背甲朝上的反应,该行为是反映幼龟生存很重要的性能表现特征,其能力大小反映了初生幼体在孵化基质中能否迅速恢复自身最佳的姿势,以降低被捕食的风险(Delmas et al,2007)。对于刚从巢穴中孵化的幼体来说,其在岸边所面临的天敌更为广泛,较强的翻身能力可使其以最快的速度调整到运动和逃跑状态。高盐度环境(S5)孵出的稚龟在7 d时,其翻身能力下降,说明盐度可能增加了新生稚龟被捕食的风险。运动能力对爬行动物逃避天敌、提高觅食成功率具有重要的作用,因而与其适应性有密切的关系(潘志崇等,2003);即便某些表型性状和生存之间的关系仍然难以确定,但运动能力在一定程度上反映了个体的适合度,野外环境下运动能力较强的稚龟,更容易躲避天敌并存活下来(耿军, 2017)。研究发现,体重会影响稚龟的运动能力,较重新生幼体的运动能力显著高于低体重个体(杜卫国和郑荣泉, 2004)。本研究中,盐度较高基质中孵化出的稚龟,在30 d时,其运动速度及耐力均受到显著抑制(P<0.05),这可能与龟在高盐环境中由于失水而导致的体重降低有关。
3.3 稚龟应对环境盐度的行为策略
在环境应激源的作用下,动物会对自身行为作出功能性调整,以适应环境的变化(温安祥和周定刚,2009)。稚龟在盐度环境中运动力减弱,作为应对高渗环境的一种选择性策略,稚龟可能通过减少运动来避免能量的不必要消耗,进而将更多能量用于维持体内渗透压的平衡。动物为了维持生命,必须从周围环境中不断摄取食物,但在盐度环境中,机体为了避免摄入过多的盐分,可能通过减少摄食以降低其摄入(Agha et al,2018)。研究发现,稚龟在高盐度环境中摄食量显著下降,与淡水组相比差异显著,进一步印证了该推断。但淡水生物生活在盐度环境中,为维持内环境稳定所进行的渗透压调节过程中,需要消耗大量能量(舒超华等,2012)。在盐度环境中龟类摄食量减少,势必会导致营养物质缺少;若长期生活在盐度环境中,机体能量供应将严重不足。
3.4 淡水咸化对水生生态系统的影响
IPCC报告指出,许多陆地、淡水和海洋物种已经因气候变化改变了其生活习性,以应对正在进行的气候变化(IPCC,2021)。虽然有些物种因气候变化而灭绝,但在过去的数百万年里,由于人为干扰导致全球自然气候变化,加速了生态系统的重大变化和物种灭绝(Frederikse et al,2020)。淡水生物对水体盐度升高较为敏感,即使稍微增加也会对生物群落造成很大影响(Ca?edo-Argüelles et al,2016)。水体盐化将直接导致非耐盐动物逐渐消失,自然选择出耐盐的物种(Agha et al,2018);但这种负效应通过食物链和食物网扩散并放大,最终导致生物多样性丧失,生态平衡遭到破坏(赵开拓,2017)。本研究所在对龟类进行长达10多年的研究中发现,红耳龟在夺食能力、生态幅宽度、耐受应激环境等方面要强于其他淡水龟类,是一种耐受性较强的淡水龟(马凯等,2013;赵龙辉等,2013;裘正元等,2015);此外,红耳龟成体和亚成体可通过生理调控耐受一定范围的盐度(Ding et al,2019;Hong et al,2019;Ding et al,2021)。尽管如此,研究依然发现红耳龟的早期生活史阶段对盐度耐受力极低,其孵化及幼体的行为受到了严重影响,由此不难推断,淡水咸化对其他淡水龟类的影响或许更为严重。因此,加强淡水咸化对淡水生物影响的研究,将有助于了解全球气候变化下淡水生态系统所面临的威胁,为生物保护提供理论依据。
参考文献
杜卫国,郑荣泉,2004. 不同孵化湿度下的乌龟卵孵化成功率及新生幼体特征[J]. 动物学报, 50(1):133-136.
耿军,2017. 不同温度效应下红耳龟与乌龟幼体表型、生理与功能的比较[M]. 杭州:杭州师范大学.
马凯,李闯,史海涛,等,2013. 海南万泉河琼海段外来物种红耳龟与本地种中华条颈龟家域的比较研究[J]. 动物学杂志, 48(3):331-337.
潘志崇,张永普,计翔,2003. 中华花龟幼体热耐受性、体温昼夜变化和运动表现的热依赖性[J]. 动物学报, 49(1):45-52.
强俊,王辉,李瑞伟,2009. 盐度对奥尼罗非鱼受精卵孵化和仔鱼活力的影响[J]. 水产科学, 28(6):329-332.
裘正元,洪美玲,张豪,等,2015. 急性亚硝酸盐胁迫对红耳龟和中华条颈龟幼体抗氧化能力的比较研究[J]. 生态科学, 34(4):99-104.
盛成,洪美玲,史海涛,2017. 红耳龟与中华条颈龟初生幼体剩余卵黄、表型特征及运动能力的比较研究[J]. 动物学杂志, 52(1):57-63.
舒超华,张珂,洪美玲,等,2012. 盐度胁迫对红耳龟生长与血液生化指标的影响[J]. 四川动物, 31(6):912-916.
王珊珊,2015. 环境因子对棘颊雀鲷的产卵及胚胎发育的影响[M]. 舟山:浙江海洋学院.
温安祥,周定刚,2009. 应激对龟鳖类动物的影响[J]. 经济动物学报, 13(2):108-114,120.
赵开拓,2017. 水体盐化对淡水藻类生理特性的影响及取水规避藻类技术研究[M]. 西安:西安建筑科技大学.
赵龙辉,李杰,魏朝军,等,2013. 红耳龟与中华条颈龟争抢食物能力的对比研究[J]. 四川动物, 32(6):873-878.
Agha M, Ennen J R, Bower D S, et al, 2018. Salinity tolerances and use of saline environments by freshwater turtles: implications of sea level rise[J]. Biological Reviews, 93:1634-1648.
Alam M R, Sharmin S, Islam S M, et al, 2020. Salinity intrusion affects early development of freshwater aquaculture species pabda, Ompok pabda[J]. Aquaculture Reports, 18:100476.
Ca?edo-Argüelles M, Hawkins C P, Kefford B J, et al, 2016. Saving freshwater from salts[J]. Science, 351:914-916.
Delmas V, Baudry E, Girondot M, et al, 2007. The righting response as a fitness index in freshwater turtles[J]. Biological Journal of the Linnean Society, 91:99-109.
Ding L, Li W H, Li N, et al, 2019. Antioxidant responses to salinity stress in an invasive species, the red-eared slider (Trachemys scripta elegans) and involvement of a TOR-Nrf2 signaling pathway[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 219:59-67.
Ding L, Li W H, Liang L Y, et al, 2021. Modulation of the intestinal barrier adaptive functions in red-eared slider (Trachemys scripta elegans) invading brackish waters[J]. Science of The Total Environment, 751:141744.
Frederikse T, Landerer F, Caron L, et al, 2020. The causes of sea-level rise since 1900[J]. Nature, 584:393-397.
Gilbert S F, Loredo G A, Brukman A, et al, 2001. Morphogenesis of the turtle shell: the development of a novel structure in tetrapod evolution[J]. Evolution & development, 3:47-58.
Hong M L, Li N, Li J Y, et al, 2019. Adenosine monophosphate-activated protein kinase signaling regulates lipid metabolism in response to salinity stress in the red-eared slider turtle Trachemys scripta elegans[J]. Frontiers in Physiology, 10:962.
IPCC. Climate Change 2021: The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change[R]. Cambridge University Press.
Koshiba-Takeuchi K, Mori A D, Kaynak B L, et al, 2009. Reptilian heart development and the molecular basis of cardiac chamber evolution[J]. Nature, 461:95-98.
Levermann A, Clark P U, Marzeion B, et al, 2013. The multimillennial sea-level commitment of global warming[J]. Proceedings of the National Academy of Sciences, 110:13745-13750.
Rice K C, Hong B, Shen J, 2012. Assessment of salinity intrusion in the James and Chickahominy Rivers as a result of simulated sea-level rise in Chesapeake Bay, East Coast, USA[J]. Journal of Environmental Management, 111:61-69.
Ven?ncio C, Castro B B, Ribeiro R, et al, 2019. Sensitivity of freshwater species under single and multigenerational exposure to seawater intrusion[J]. Philosophical Transactions of the Royal Society B, 374:20180252.
Wang R F, Huang X R, Wang H H, et al, 2019. Effects of salinity on embryonic and larval development of Chinese mitten crab Eriocheir sinensis (Decapoda: Brachyura) and salinity-induced physiological changes[J]. Journal of Oceanology and Limnology, 37:1777-1788.
Weber C, Zhou Y J, Lee J G, et al, 2020. Temperature-dependent sex determination is mediated by pSTAT3 repression of Kdm6b[J]. Science, 368:303-306.
Williams W, 2001. Anthropogenic salinisation of inland waters[C]//Saline lakes. Springer: 329-337.
(责任编辑 万月华)
Effects of Salinity on Hatching Rate, Morphological Phenotype and
Fitness of Juvenile Trachemys scripta elegans
KONG Yu‐chen, LIANG Fang‐bin, WANG Xiao‐dan, HUANG Peng,
ZHANG Miao‐miao, HONG Mei‐ling, SHI Hai‐tao, DING Li
(Key Laboratory of Tropical Island Ecology, Ministry of Education,
Hainan key Laboratory of Tropical Animal and Plant Ecology, College of Life Sciences,
Hainan Normal University, Haikou 571158, P.R. China)
Abstract: Freshwater turtles are an important part of freshwater ecosystems. Global climate change, salinization of freshwater and coastal soil will pose a serious threat and challenge the survival of turtles. However, little is known about the effects of salinity on the early life stage of freshwater turtles. In this research, we studied red-eared turtles (Trachemys scripta elegans), and explored the effects of salinity on hatching rate, morphological phenotype, and fitness of juvenile T. scripta. elegans, aiming to reveal the effect of freshwater salinization on the reproduction and behavior of juvenile turtles around the world. Three salinity concentration groups (S0.5, S2.5, S5) and a control group (freshwater group, CK) were set in this study, with each trial in triplicate. For the treatments, CK, S0.5, S2.5, S5, the respective hatching rates were 80.00%, 83.33%, 60.00% and 43.33%, and the respective hatching times was 51, 52, 54 and 53 d. As salinity increased, the hatching rate tended to decrease while the hatching time increased. The survival rates of T. scripta elegans decreased gradually and, on day 30, the survival rates for treatments CK, S0.5, S2.5 and S5 were, respectively, 95.83%, 95.83%, 94.44% and 81.80%. The deformity rate of juvenile turtles increased with salinity and, among malformed individuals, carapace deformities accounted for the highest proportion (100% in the S5 treatment group). In addition, the body weight of turtles in group S5 was significantly lower than that in group CK (P<0.01), as were the length and width of carapace and plastron (P<0.05). Further, the sprint speed and maximum duration distance of the turtles on day 30 in group S5 were significantly lower than in group CK. The time to turning over increased, and feeding significantly decreased in the high salinity S5 group. Although the red-eared turtle is a highly tolerant freshwater species, the hatching rate, fitness and survival rate all decreased significantly under saline conditions, and it can be inferred that the effects of freshwater salinization will be more serious on less tolerant freshwater turtles.
Key words: Trachemys scripta elegans; salinity; hatching; morphological phenotypes; fitness characteristics

