三氯生对黄河鲤幼鱼性腺发育分化相关基因表达的影响
王凡 刘雪琴 刘飞 冉娜娜 高晓杨 石亚男 朱娜娜 程惠敏 杨瑞


摘要:为了探讨三氯生(TCS)对黄河鲤(Cyprinus carpio)幼鱼性腺分化的分子机制,采用半静态水体暴露法,将体长为7.8~9.9 cm的黄河鲤幼鱼暴露于0(对照)、0.04、0.08、0.16 mg/L的三氯生溶液中42 d,利用RT-qPCR技术检测黄河鲤性腺发育分化相关基因表达情况。结果显示,雄鱼精巢中,dax1和sox9a基因在0.04 mg/L和0.08 mg/L TCS处理组中均极显著上升(P<0.01),0.08 mg/L处理组中sox9b、dmrt1和foxl2基因显著或极显著上升(P<0.01,P<0.05,P<0.01),nobox基因在0.04 mg/L和0.16 mg/L TCS处理组显著和极显著下降(P<0.05,P<0.01),zp2基因在各TCS处理组显著或极显著上升(P<0.05,P<0.01),ar和amh基因在各TCS处理组显著和极显著下降(P<0.05,P<0.01);雌鱼卵巢中,sox9b基因在0.04 mg/L和0.08 mg/L TCS处理组均极显著上升(P<0.01),sox9a和dax1基因在0.04 mg/L TCS处理组显著和极显著上升(P<0.05,P<0.01),zp2基因在TCS处理组显著或极显著下降(P<0.05,P<0.01),foxl2基因在0.04 mg/L TCS处理组显著下降(P<0.05),nobox基因在0.16 mg/L TCS处理组显著下降(P<0.05)。研究表明,TCS影响了黄河鲤幼鱼性腺发育分化相关基因的表达,可能进一步影响其生殖腺的发育分化。
关键词:三氯生;黄河鲤;性腺发育分化;基因表达
中图分类号:Q503 文献标志码:A 文章编号:1674-3075(2023)02-0114-06
医药品与个人护理品(pharmaceuticals and personal care products, PPCPs)是近年来出现的一类新型化学污染物,该类污染物在自然环境中的半衰期短、浓度低。然而,由于其被广泛应用,环境中的PPCPs呈现“持续存在”状态,也常被称为“虚拟持久性化学污染物”(赵青青等,2016;叶芃显等,2018)。三氯生(Triclosan, TCS)作为一种高效广谱杀菌剂,应用于各种护理用品、清洁用品和医药用品中(Chen et al, 2008),是一种典型PPCPs。已有研究报道,TCS本身具有低毒性和不易降解性,在生活中的大量应用使其不可避免地释放到水环境中,在污水处理厂的进、出水浓度高达86.2 μg/L、2.7 μg/L,地表水和沉积物中高达2.3 μg/L和2.7 μg/kg(Zhao et al, 2013)。TCS还具有亲脂性且容易被生物体富集,并沿食物链进行毒性传递,也对水生生物的生长和繁殖等多方面产生影响(朱志广等,2019)。因此,关于TCS对水生生物的毒性研究已引起广泛关注。
TCS能对水生动物能产生急性致死、遗传、生理、致畸、基因以及内分泌干扰等毒性效应(郑欣等,2016;Wang et al, 2018;Wang et al, 2019)。在内分泌干扰方面,不同研究者的结论有所不同,日本青鳉成鱼(Ishibashi et al,2004)和食蚊鱼(Raut & Angus,2010)的TCS表现为雌激素效应;但也研究发现,TCS对青鳉鱼仔鱼具有弱的雄性激素作用(Foran et al,2000);这些研究均表明TCS对鱼类的性别分化产生了干扰。
近年来,已经监测到黄河受到不同程度的TCS污染,从而威胁到黄河水域生态系统平衡和人类健康(Zhao et al, 2013)。前期研究发现,TCS对黄河鲤(Cyprinus carpio)产生了雌激素效应(Wang et al, 2017;2018),表明TCS对黄河鲤性别分化产生了影响。黄河鲤中的许多基因与性别分化有关,如ar、amh、dax1、 dmrt1、sox9a、sox9b基因参与精巢分化发育,cyp19a、 cyp19b、 foxl2、nobox、zp2基因参与卵巢分化发育(贾永芳等,2016)。为了进一步揭示TCS对黄河鲤雌激素的效应机制,本研究利用PCR技术测定不同浓度TCS对黄河鲤幼鱼性腺发育分化相关基因的表达,以期探讨TCS对黄河鲤性腺分化发育影响的分子机制,同时也为环境标准制定和生态健康评价提供参考依据。
1 材料与方法
1.1 实验材料
实验用黄河鲤取自河南省黄河鲤良种场,体长7.8~9.9 cm,暴露实验前将其放入60 L去氯自来水的水族箱中,暂养7 d;挑选健康活泼、个体均匀且生长状况良好的黄河鲤进行正式实验。
1.2 实验设计
根据前期预实验结果得出黄河鲤幼鱼96 h LC50为0.8 mg/L,在此基础上,参考污水处理厂进水口TCS的最高浓度,然后按照96 h LC50的1/20、1/10和1/5(即0.04、0.08、0.16 mg/L)设置了3个TCS处理组和1个对照组(0 mg/L)共4个实验组。每个实验组随机投放暂养后的黄河鲤幼鱼,在装有20 L TCS处理液的玻璃水族箱中进行暴露实验。设置实验水温为(16±3)℃,并保持水族箱持续增氧。每天定时定点投喂并及时处理残饵和粪便,为使TCS浓度基本保持不变,每24 h更换50% TCS处理液,暴露时间为42 d。实验期间,采用高效液相色谱仪检测各实验组的TCS,TCS保持在设定浓度的80%~110%,检测方法参考Wang等(2017)。暴露实验结束后,解剖鉴别雌雄,每个实验组选取5个卵巢和5个精巢共计10个性腺样本,保存于-80℃冰箱备用。
利用总RNA极速抽提试剂盒(上海飞捷生物技术有限公司)提取黄河鲤性腺RNA,将样品用凝胶成像分析仪观察并分析,同时用超微量分光光度计进行吸光度测定。结果显示,28S亮度和宽度是18S的2倍左右,且OD260/OD280在1.8~2.1,浓度适中,说明提取的RNA样品质量较好,都可用于反转录反应。随后采用RNA反转录试剂盒(东洋纺生物科技有限公司),依照说明书配制20 μL反应体系,混匀后放入PCR仪进行反应,条件为37℃、15 min,98℃、5 min,4℃、5 s,得到的cDNA分装保存在-20℃冰箱中。
1.4 实时荧光定量PCR反应
查阅相关文献得到amh、dax1、dmrt1、foxl2、nobox、sox9a、sox9b、ar、zp2、β-actin(内参)基因的引物序列(卢月娇等,2009;贾永芳等,2016),用于实时荧光定量PCR扩增。引物由华大基因合成(表1)。
采用Bestar SybrGreen qPCR mastermix试剂盒(德国DBI生物科技有限公司),将反转录获得的cDNA配制成20 μL反应体系,实时荧光定量PCR。反应程序为95℃、2 min,95℃、10 s,55℃、30 s,72℃、30 s,共计40个循环;融解曲线为95℃、1 min,55℃、1 min,55~98℃(10 s/cycle, 0.5℃/cycle)86个循环。
1.5 数据分析
实时荧光定量PCR反应得到的数据通过2-ΔΔt法进行处理,结果用(平均值±标准差)表示;采用SPSS对实验数据进行单因素方差分析,然后用LSD法进行多重比较,分析对照组和处理组之间的差异。
2 结果与分析
2.1 黄河鲤雌鱼性别分化基因表达
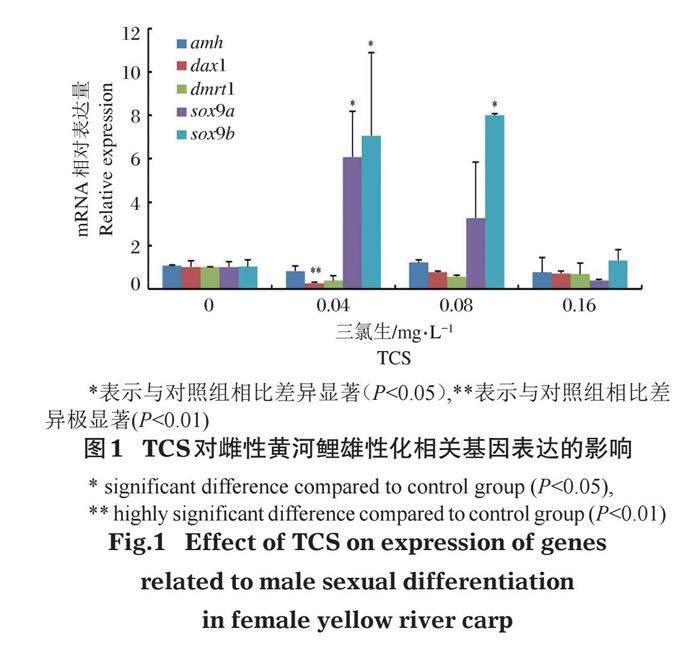
amh、dax1、dmrt1、sox9a和sox9b基因是与雄性化相关的基因,其在不同TCS雌鱼实验组的表达如图1所示(n=5)。与对照组相比,amh基因在0.04 mg/L和0.16 mg/L TCS处理组表达水平呈下降趋势,在浓度0.08 mg/L表达水平呈上升势,但整体变化不显著(P>0.05)。dax1基因在不同TCS处理组中的表达水平出现了下降趋势,且在0.04 mg/L处理组极显著下降(P<0.01),下降了73.6%。dmrt1基因在不同TCS处理组中的表达水平呈下降趋势,但整体变化不显著(P>0.05)。sox9a基因在0.04 mg/L和0.08 mg/L处理组表达水平呈上升趋势,且0.04 mg/L处理组显著上升了5.0倍(P<0.05),而在0.16 mg/L浓度组表达水平呈下降趋势。sox9b基因在不同TCS处理组中的表达水平呈上升趋势,且0.04 mg/L和0.08 mg/L处理组显著(P<0.05)上升了5.9倍和6.8倍。
foxl2、nobox和zp2是与雌性性别分化相关的基因,其在不同TCS雌鱼实验组中的表达如图2所示(n=5)。与对照组相比,foxl2基因在0.04 mg/L和0.08 mg/L TCS处理组的表达水平呈下降趋势,且在0.04 mg/L浓度组显著下降(P<0.05),下降了61.4%;而在0.16 mg/L处理组的表达水平呈上升趋势。nobox基因在不同TCS处理组中的表达水平整体呈下降趋势,且在0.16 mg/L浓度组显著下降(P<0.05),下降了36.2%。zp2基因在不同TCS处理组中表达水平整体呈下降趋势,在0.16 mg/L处理组显著下降(P<0.05),下降了47.5%;且在0.04 mg/L和0.08 mg/L处理组的表达水平呈极显著下降(P<0.01),分别下降了69.1%和62.5%。
2.2 黄河鲤雄鱼性别分化基因表达
雄性化相关基因在不同TCS雄鱼实验组的表达如图3所示(n=5)。与对照组相比,amh基因在不同TCS处理组中的表达水平极显著下降(P<0.01),在0.04 mg/L处理组下降了75.0%,在0.08 mg/L和0.16 mg/L处理组分别下降59.6%和89.5%。dax1基因在不同TCS处理组中的表达水平出现了上升趋势,且在0.04 mg/L和0.08 mg/L处理组中极显著上升(P<0.01),分别上升了2.9倍和5.9倍。dmrt1基因在0.04 mg/L和0.08 mg/L处理组表达水平呈上升趋势,且在0.08 mg/L处理组显著上升(P<0.05),上升了4.9倍;而在0.16 mg/L处理组表达水平呈下降趋势。sox9a和sox9b在不同TCS处理组中的表达水平呈上升趋势,sox9a在0.04 mg/L和0.08 mg/L处理组极显著上升(P<0.01),分别上升了8.2倍和17.9倍;sox9b在0.08 mg/L处理组呈极显著上升(P<0.01),上升了6.9倍。ar基因在不同TCS处理组中的表达水平出现下降趋势,在0.04 mg/L和0.08 mg/L处理组显著下降(P<0.05),下降69.0%和53.7%;而在0.16 mg/L处理组极显著下降(P<0.01),下降了92.7%。
雌性化相关基因在不同TCS雄鱼实验组中的表达情况如图4所示(n=5)。与对照组相比,nobox基因在不同TCS处理组中表达水平整体呈下降趋势,且在0.04 mg/L和0.16 mg/L处理组显著下降(P<0.05,P<0.01),分别下降了74.7%和83.6%。foxl2基因在不同TCS处理组中表达水平整体呈上升趋势,且在0.08 mg/L处理组极显著上升(P<0.01),上升了10.8倍。zp2基因在不同TCS处理组中的表达水平出现了上升趋势,且在0.04 mg/L和0.16 mg/L处理组显著上升(P<0.05),分别上升了5.3倍和5.5倍;而在0.08 mg/L处理组极显著上升(P<0.01),上升了15.6倍。
3 讨论
鱼类的性别发育以遗传因素为基础,同时容易受外界环境(温度、盐度、氧气、环境污染物等)和自身内分泌调节的影响(卢月娇等,2009)。因此,鱼类的性别分化机制比较复杂。本次研究发现,TCS这种新型环境污染物影响了黄河鲤幼鱼性腺性别分化相关基因的表达,但并没表现出剂量-效应反应,可能与这种化合物本身的特性有关。Ishibashi等(2004)研究发现,20 μg/L和100 μg/L的TCS对日本青鳉产生了显著的雌激素效应,而200 μg/L无显著影响;作者前期研究也发现,TCS对黄河鲤生殖轴相关基因的表达影响也没表现出剂量-效应反应(Wang et al, 2017;2018),与本次研究结果类似。
3.1 TCS对黄河鲤幼鱼雄性化相关基因表达机制
amh、dax1、dmrt1、sox9a、sox9b和ar基因与雄性性别分化有关。在雄性性腺分化期,amh基因可抑制缪勒氏管的形成,阻止卵巢发育,使中肾管发育为精巢,主要在雄性幼鱼中表达(龙雯晴和王伟民,2001)。哺乳类的dax1基因可抑制睾丸发育(王丽云等,2006);其在80 d黄河鲤中的表达,雄性高于雌性(贾永芳等,2016)。dmrt1基因是一种下游性别决定基因,其在精巢中的表达量高于卵巢,参与了精巢功能维持(曹谨玲等,2011)。本研究发现,TCS对雌鱼amh基因表达无显著影响,而使雄鱼表达量极显著下降;dax1基因在低浓度TCS处理组雌鱼中的表达量极显著下降,而在低、中浓度组雄鱼中极显著上升;dmrt1基因在雌鱼中无显著影响,雄鱼dmrt1基因在中浓度TCS处理组显著上升。这表明TCS影响黄河鲤卵巢的发育过程是通过抑制dax1基因表达来促进了卵巢的发育;而TCS影响黄河鲤精巢的发育过程是通过抑制amh基因表达来抑制精巢的发育,dmrt1和dax1表达升高可能与机体的反馈调节或其他因子的调节有关。这一结果也证实了项目组前期实验TCS对黄河鲤的雌激素效应这一结论(Wang et al, 2017;2018)。
sox9a和sox9b基因是与哺乳动物性别分化形成有关的重要基因,并与性别调控网络中的因子相互作用,维持睾丸发育(廖冰等,2008)。有研究报道了青鳉的早期性别分化与sox9基因无关,而与后期的精巢发育有关(Nakamoto et al, 2005)。本研究中,雌鱼sox9a基因在低TCS浓度组显著上升,sox9b在低、中 浓度TCS处理组显著上调;雄鱼sox9a基因在低、中浓度TCS处理组中极显著上升,sox9b在中浓度TCS处理组极显著上升。表明TCS不仅通过影响sox9基因的表达来干扰黄河鲤的精巢发育分化,同时也影响了卵巢的发育分化,其具体机制还有待进一步探讨。ar基因是一种核受体超家族中的雄激素受体,属于配体依赖型转录因子,是雄激素发挥作用的介导者,在生物体内有着不可或缺的作用(黄宝锋,2008)。本研究中,雄鱼ar基因在TCS处理组显著下降,说明TCS可能通过影响雄激素受体来对雄性黄河鲤产生雌性生殖内分泌干扰。Filby等(2007)研究也发现,17α-乙炔基雌二醇能够显著降低黑头呆鱼精巢中ar基因的表达水平,从而抑制雄激素-受体复合物,引起雌激素效应。
3.2 TCS对黄河鲤幼鱼雌性化相关基因表达机制
foxl2、nobox、zp2基因与雌性性别分化相关。foxl2基因主要在垂体和卵巢中表达,是脊椎动物卵巢决定和分化的一个标志性启动基因(贾永芳等,2016), foxl2对Sox9基因有抑制作用,进而抑制精巢分化(Nef & Vassalli, 2009)。zp2基因在雌性体内特异性表达,其编码蛋白在卵细胞运输中起支持及保护作用(郑尧等,2016)。nobox基因在生殖细胞中特异性表达,是有关早期卵子发生的关键性转录调控因子(符梅等,2014)。本研究中,雌鱼foxl2基因在低TCS浓度组显著下降,zp2基因在各TCS处理组显著下降,nobox基因在高浓度TCS处理组显著下降,其原因可能由于TCS导致的sox9基因表达升高,然后又反馈抑制foxl2基因的表达所致;雄鱼foxl2基因在中浓度TCS组显著升高,zp2基因在各浓度TCS组显著升高,项目组前期研究还发现,TCS使雄鱼精巢cyp19a显著升高(Wang et al, 2018),这些研究结果进一步表明了TCS对雄性黄河鲤产生了雌激素效应。Yang等(2018)研究发现,双酚F暴露抑制性别分化期斑马鱼的amh基因表达,诱导foxl2的表达,导致cyp19a1a表达增加,促进了雌激素产生。该研究结果与本研究及项目组的前期研究结果一致。
综上,TCS对黄河鲤的生殖腺发育分化相关基因产生一定影响。对于雌性黄河鲤,主要是通过抑制卵巢dax1基因表达来促进其发育;对于雄性黄河鲤,主要是通过抑制精巢amh和ar基因表达,诱导foxl2和zp2基因表达对精巢发育产生干扰,致使产生雌激素效应。由于性别分化及决定基因较多,且性腺分化发育受到的基因调控网络异常复杂。因此,TCS引起生殖内分泌紊乱的详细分子机制还有待进一步探究,以准确评估TCS所带来的水生态环境风险。
参考文献
曹谨玲,陈剑杰,甘西,等,2011. 鱼类DMRT基因的研究进展[J]. 广东海洋大学学报, 31(1):94-98.
符梅,陈亚冰,李键,等,2014. NOBOX基因在麦洼牦牛卵母细胞、早期胚胎及胎儿卵巢的表达[J]. 畜牧兽医学报, 45(11):1746-1751.
黄宝锋,2008. 南方鲇雄激素受体(AR)全长cDNA的克隆及分析[D]. 重庆:西南大学.
贾永芳,张弯弯,张瑞华,等,2016. 黄河鲤性别决定时间和相关基因表达研究[J]. 水生生物学报, 40(6):1121-1127.
廖冰,吴宁,韩凤桐,等,2008. SOX9调控性腺分化研究的进展[C]//中国畜牧兽医学会动物繁殖学分会第十四届学术研讨会论文集. 青岛:青岛农业大学出版社:524-526.
卢月娇,胡炜,朱作言,2009. 鲤鱼发育早期HPG轴和GH/IGF轴相关因子的转录起始分析[J]. 水生生物学报, 33(6):1126-1131.
龙雯晴,王伟民,2001. 抗苗勒氏管激素[J]. 国外医学妇产科学分册, 28(1):8-10.
王丽云,吕善潮,王金玉,2006. 哺乳动物性别决定机制研究进展[J]. 中国畜牧兽医, 33(10):52-54.
叶芃显,叶昭西,魏文瑞,等,2018. 西江支流新兴江中微污染物PPCPs的分析水平调研[J]. 科技资讯, 16(15):125-126,128.
郑尧,陈家长,邴旭文,等,2016. 彭泽鲫F1、F2代雌雄鱼VtgB和ZP2表达及卵黄蛋白原含量差异研究[J]. 水产科学, 35(4):370-375.
赵青青,高睿,王铭璐,等,2016. 药物和个人护理品(PPCPs)去除技术研究进展[J]. 环境科学与技术, 39(S1):119-125.
郑欣,刘婷婷,王一喆,等,2016. 三氯生毒性效应及水质基准研究进展[J]. 生态环境学报, 25(3):539-546.
朱志广,张玉彬,吕志伟,等,2019. 三氯生的水质基准推导及其对渤海湾近岸海域的生态风险[J]. 天津大学学报(自然科学与工程技术版), 52(7):754-762.
Chen J G, Ahn K C, Gee N A, et al, 2008. Triclocarban enhances testosterone action: a new type of endocrine disruptor[J]. Endocrinology, 149(3):173-1179.
Foran C M, Bennett E R, Benson W H, 2000. Developmental evaluation potential non-steroidal estrogen: triclosan[J]. Mar Environ Res, 50:153-156.
Filby A L, Thorpe K L, Maack G, et al, 2007. Gene expression profiles revealing the mechanisms of anti-androgen-and estrogen-induced feminization in fish[J]. Aquat Toxicol, 81(2):219-231.
Ishibashi H, Matsumura N, Hirano M, et al, 2004. Effects of triclosan on the early life stages and reproduction of medaka Oryzias latipes and reproduction of hepatic vitellogenin[J]. Aquat Toxicol, 67(2):167-179.
Nakamoto M, Suzuki A, Matsuda M, et al, 2005. Testicular type Sox9 is not involved in sex determination but might be in the development of testicular structures in the medaka, Oryzias latipes[J]. Biochem Biophys Res Commun, 333(3):729-736.
Nef S, Vassalli J D, 2009. Complementary pathways in mammalian female sex determination[J]. J Biol, 8:74.
Raut S A, Angus R A, 2010. Triclosan has endocrine-disrupting effects in male western mosquitofish, Gambusia affinis[J]. Environ toxicol chem, 29(6):1287-1291.
Wang F, Guo X, Chen W, et al, 2017. Effects of triclosan on hormones and reproductive axis in female Yellow River carp (Cyprinus carpio): Potential mechanisms underlying estrogen effect[J]. Toxicol Appl Pharm, 336:49-54
Wang F, Liu F, Chen W, et al, 2018. Effects of triclosan (TCS) on hormonal balance and genes of hypothalamus-pituitary- gonad axis of juvenile male Yellow River carp (Cyprinus carpio)[J]. Chemosphere, 193:695-701.
Wang F, Liu F, Chen W, 2019. Exposure to triclosan changes the expression of microRNA in male juvenile zebrafish (Danio rerio)[J]. Chemosphere, 214:651-658.
Yang Q, Yang X, Liu J, 2018. Effects of exposure to BPF on development and sexual differentiation during early life stages of zebrafish (Danio rerio)[J]. Comp Biochem Phys C, 210:44-56.
Zhao J L, Zhang Q Q, Chen F, et al, 2013. Evaluation of triclosan and triclocarban at river basin scale using monitoring and modeling tools: Implications for controlling of urban domestic sewage discharge[J]. Water Res, 47(1): 395-405.
(责任编辑 万月华)
Effects of Triclosan on Gene Expression Related to Gonadal Development and
Differentiation in Juvenile Yellow River Carp (Cyprinus carpio)
WANG Fan, LIU Xue‐qin, LIU Fei, RAN Na‐na, GAO Xiao‐yang,
SHI Ya‐nan, ZHU Na‐na, CHENG Hui‐min, YANG Rui
(Luoyang Normal University, Luoyang 471934, P. R. China)
Abstract:In recent years, monitoring has shown varying levels of triclosan (TCS) pollution in the Yellow River, high enough to threaten the aquatic ecosystem and human health along the Yellow River. Previous research has shown that TCS exposure affects the sexual differentiation of Yellow River carp (Cyprinus carpio). In this study, we investigated gene expression related to gonadal development and differentiation in C. carpio using a semi-static water contamination method and RT-PCR, and the effect of TCS on the molecular mechanism of gonadal differentiation of juvenile Yellow River carp was analyzed. The study aimed to provide a reference for determining environmental standards and evaluating ecological health. Healthy C. carpio of body length 7.8-9.9 cm were acclimated for 7 d in aquaria, and then exposed to four TCS concentrations (0, 0.04, 0.08, and 0.16 mg/L) for 42 days. Half of the solution was changed every 24 hours. Then the expression levels were determined for the genes amh, dax1, dmrt1, foxl2, nobox, sox9a, sox9b, ar, zp2 and β-actin in C. carpio gonads by RT-PCR. Results were as follows: (1) In the sperm of male juveniles, expression of the genes dax1 and sox9a increased significantly in the 0.04 and 0.08 mg/L TCS treatments (P<0.01); the expression of the genes sox9b, dmrt1 and foxl2 increased significantly in the 0.08 mg/L TCS group (P<0.01, P<0.05, P<0.01); nobox gene expression significantly decreased in the 0.04 and 0.16 mg/L TCS groups (P<0.05, P<0.01); zp2 gene expression significantly increased, and ar and amh gene expression significantly decreased in all TCS groups (P<0.05, P<0.01). (2) In the ovaries of female juveniles, sox9b gene expression significantly increased in the 0.04 and 0.08 mg/L TCS groups (P<0.01); sox9a and dax1 gene expression significantly increased (P<0.05,P<0.01) and foxl2 gene expression significantly decreased in the 0.04 mg/L TCS group (P<0.05); nobox gene expression decreased significantly in the 0.16 mg/L TCS group (P<0.05); and zp2 gene expression decreased significantly in all the TCS groups (P<0.05, P<0.01). TCS has a significant effect on the expression of genes related to gonadal development and differentiation in C. carpio, which could then further affect sexual development and differentiation.
Key words:triclosan; Yellow River carp; gonadal development and differentiation; gene expression

