褐菖鲉不同地理群体的形态学比较研究
刘璐 周永东 高天翔


摘要:褐菖鲉(Sebastiscus marmoratus)常见于西北太平洋近海的暖温水域底层,是我国重要的广布型海洋经济鱼类。研究褐菖鲉群体间形态差异及其与生境的关系,能够为我国近海鱼类多样性保护提供基础资料。鉴于生物多元统计需要尽量缩小不同鱼类群体大小和规格差异为前提,通过传统形态测定和多变量框架量度相结合的方法,采用主成分分析、判别分析、聚类分析和单因素方差分析多元统计方法,对采集自浙江舟山、福建厦门、广东汕头及广西北海附近海域的4个褐菖鲉群体共112尾个体的8个分节特征和15个量度特征开展研究。结果显示,不同群体间可数性状特征差异不明显,难以作为有效区分4个褐菖鲉群体的依据;结合框架法和传统形态学进行研判,4个群体的综合判别正确率在81.5%~96.7%。主成分分析表明,前4个主成分累积贡献率为51.74%,北海群体和舟山群体的形态特征指标分别与其他2个群体存在一定程度的分化。相比于北海群体,厦门群体的尾柄更长、头部更小。生境差异以及褐菖鲉生活范围相对稳定,使得被隔绝于相对独立生活环境的群体产生了形态特征上的适应性分化。由于东海海域和南海海域之间的联通性,不同海域的褐菖鲉群体之间因摄食、繁殖等出现的短距离迁徙和短暂的基因交流,在一定程度上削弱了形态特征的分化。
关键词:褐菖鲉;地理群体;形态特征;适应性分化
中图分类号:Q145 文献标志码:A 文章编号:1674-3075(2023)02-0081-08
形态学方法又被称为生物学测定方法,是传统物种分类鉴别研究的基本方法之一,已广泛应用在渔业资源管理中,在群体研究中也较为常见,通常与群体遗传学结合,分析海洋鱼类的遗传进化、系统发育和群体内部的遗传分化等(杨军山和陈毅峰,2004;Frederich et al,2012),可以为其群体结构划分和群体鉴定提供基础资料和依据(杨慧荣等,2014);其优势在于测量简单且直观性强,缺点在于测量主要集中在鱼的头、尾部和轴向,并不能全面利用其躯干部提供的有用信息。单纯地进行可数性状和可量性状比较,适用于种及以上分类阶元的鉴定,不适用于种内的不同地理群体(Cadrin,2000),由此而衍生出了形态学框架法。框架法测量时,选取鱼体有代表性的10个左右坐标点,使之能够互相连接成线,通过测量其表面的几何特征,对数据进行多元统计分析,更加准确地比较各个鱼体形态上的差异,以实现对来自不同地理群体的个体进行有效判定,从而使鱼类群体形态学研究变得更加详尽可靠(Mamuris et al,1982)。
褐菖鲉(Sebastiscus marmoratus)隶属于鲉形目(Scorpaeniformes)、鲉科(Scorpaenidae)、菖鲉属(Sebastiscus),是一种常见于中国近海的暖温性底层鱼类(Nakabo,2013);主要分布于西北太平洋中部、南部沿海暖水地带(中国、日本、菲律宾、朝鲜等),在我国渤海、黄海、东海和南海均有分布,是重要的广布型海洋经济鱼类(陈大刚和张美昭,2015);其常年生活在近海区域的底层岩礁石和海藻丛分布区,为卵胎生,且通常根据季节变化作短距离迁移,无远距离洄游习性。褐菖鲉生性凶猛,为肉食性鱼类,主要捕食小型鱼类、蟹类、虾类、端足类、泥螺和藻类(陈舜等,2008);因其肉质鲜美细嫩而备受青睐,也是海钓、定置网和流刺网的主要捕捞对象之一,经济前景广阔。与此同时,褐菖鲉也作为海洋水系生态环境的指示生物,被用于监测海域生态环境,在生态系统中的物质循环和能量流动方面发挥着重要作用(孙文静,2018)。
近年来,由于过度捕捞和环境变化等原因,褐菖鲉资源量逐渐减少。为了保护和恢复这一重要渔业资源,避免因过度捕捞而造成种质衰退,国内外学者针对其外形特征(麦杨娟等,2019)、生理生态(Liu et al,2019)、繁殖特性(杨佳喆等,2019)、资源管理(李朝文等,2018)等领域开展了系列研究,获得了许多有价值的数据资料。然而,有关我国近海不同地理群体褐菖鲉形态学比较的研究则相对较少,尤其是有关物种分布与生境关系方面更为鲜见(韦璐等,2014);通过褐菖鲉耳石形态学和传统形态学比较分析,发现中国南海群体与日本群体在形态上存在显著差异(李龙等,2014)。本研究拟对我国近岸海域褐菖鲉群体开展比较研究,结合不同海域的栖息环境条件,探讨不同地理种群的形态差异及其与生境的关系,以期为其渔业管理、资源评估和群体保护提供理论依据。
1 材料与方法
1.1 实验材料
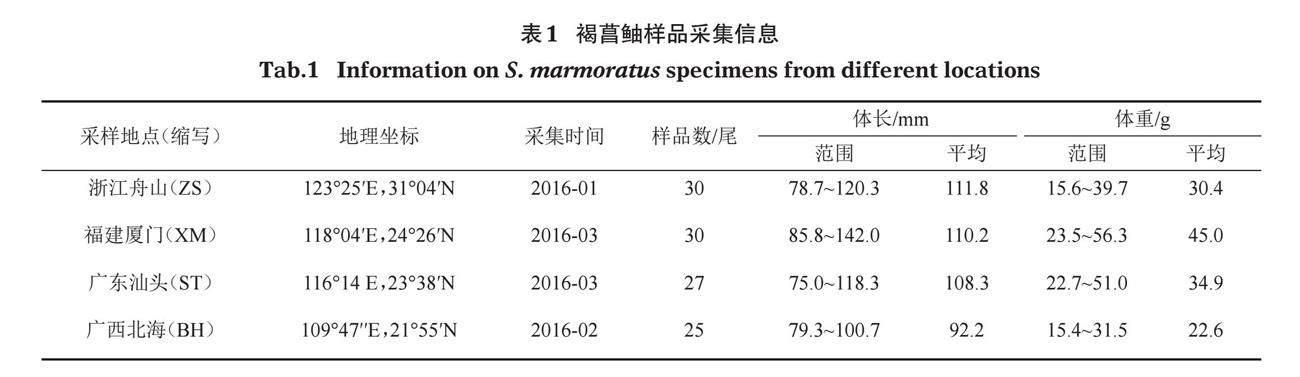
112尾褐菖鲉研究样品于2016年1-3月分别采自福建厦门、广西北海、浙江舟山和广东汕头近海。所有样品冰鲜带回实验室,首先进行形态学种类鉴定,然后选取性成熟个体进行形态学测量(Nakabo,2013),各群体样本信息详见表1。
1.2 数据测量
在实验室开展数据测量。测定褐菖鲉的8个分节特征(背鳍鳍棘数/鳍条数、腹鳍鳍棘数/鳍条数、胸鳍鳍条数、臀鳍鳍棘数/鳍条数、尾鳍鳍条数,上/下鳃耙数、脊椎骨数、侧线鳞数)和15个量度特征(全长、体长、头长、吻长、眼径、眼间隔、上颌长、体宽、体高、尾柄高、尾柄长、背鳍基长、胸鳍长、腹鳍长、臀鳍基长)。本研究共计选取了褐菖鲉外部形态的8个坐标点构建框架结构(图1)。
选取15个框架可量指标,测量两两坐标点之间的直线距离。框架数据包括D1-2(表示坐标点1与2之间的距离,下同)、D1-3、D2-3、D2-4、D2-5、D3-4、D3-5、D4-5、D4-6、D4-8、D4-7、D5-6、D6-7、D6-8、D7-8。所有量度特征均由游标卡尺测得(精确到0.01 cm),所有分节特征均由人工计数。体重由电子天平称得(精确到0.1 g)。
1.3 数据分析
本研究采用协方差分析方法、体长比值法(头部指标量度值除以头长,尾柄长除以尾柄高,其他参数值除以体长)和对数转换方法(Turan,1999;Garcia-Berthou,2001),对测量数据进行校正,以消除非同龄褐菖鲉所带来的体长差异。使用SPSS19.0单因子方差分析法(One-way Analysis of Variance,ANOVA)和LSD、Tamhane's T2多重比较法,对不同种群间褐菖鲉外部形态特征的显著性差异进行比较。运用SPSS 20.0对褐菖鲉群体的若干个形态比例参数进行主成分分析(郭显光,1998),分别计算各主成分的贡献率及其累计贡献率,并进一步采用Microsoft Excel软件,根据主成分一和主成分二绘制散点图,比较4个褐菖鲉群体的差异性和相似性,确定其形态分化情况。基于非加权组平均法(Unweighted pair-group method with arithmetic means,UPGMA)对4个不同地理群体的褐菖鲉进行聚类分析,构建群体聚类关系树,判别不同群体间的关系远近。
2 结果与分析
2.1 分节特征
对4个地理群体共112尾褐菖鲉样品的分节特征进行分析(表2)。结果显示,4个地理群体的胸鳍鳍条、腹鳍鳍棘、腹鳍鳍条、臀鳍鳍棘、臀鳍鳍条、背鳍鳍棘和背鳍鳍条均为固定值;上鳃耙4~6,96%的样品(108条)上鳃耙5~6;下鳃耙8~12,91%的样品(102条)下鳃耙10~12;其中上鳃耙5、下鳃耙10的个体最多,占总数的24%。尾鳍鳍条13~16,大多数15~16,分别占总数的41%和46%;除有3个样品脊椎骨为25外,其余样品均为24;侧线鳞在49~54,侧线鳞52的样品最多(35尾)。各群体间分节特征略有差异。
2.2 量度特征主成分
对褐菖鲉27个可量性状值的主成分分析结果见表3。可量性状包括体重/体长(A)、体高/体长(B)、尾柄长/尾柄高(C)、头长/体长(D)、眼径/头长(E)、眼间隔/头长(F)、吻长/头长(G)、上颌长/头长(H)、背鳍基长/体长(I)、臀鳍基长/体长(J)、腹鳍长/体长(K)、胸鳍长/体长(L)、1-2/体长(M)、1-3/体长(N)、2-3/体长(O)、2-4/体长(P)、2-5/体长(Q)、3-4/体长(R)、3-5/长(S)、4-5/体长(T)、4-6/体长(U)、4-7/体长(V)、4-8/体长(W)、5-6/体长(X)、6-7/体长(Y)、6-8/体长(Z)、7-8/体长(A);结合碎石图和特征值,选取4个主成分。结果表明,前4个主成分累积贡献率为51.74%,其中第一主成分贡献率为25.71%,第二主成分贡献率为10.62%。第一、二主成分中,背鳍基长/体长、2-4/体长、2-5/体长、6-8/体长、6-7/体长的载荷值较大,主要反映鱼体后半部分比例特征;第三主成分中,体重/体长荷载值较大,反映鱼体重特征;第四主成分中,吻长/头长和上颌长/头长荷载值较大,主要反映褐菖鲉的头部特征。
根据第一主和第二主成分得分情况绘制碎石散点图(图2),可见北海群体多位于散点图的左侧区域,厦门群体多位于右侧区域,其他群体则没有呈现出明显的分布倾向。
2.3 群体聚类
为了更直观地说明两两群体之间的形态差异,本研究对褐菖鲉的量度特征和分节特征平均值进行聚类分析,构建群体聚类关系树状图(图3)。可见厦门群体和汕头群体首先聚为一支,然后和舟山群体聚为一支,北海为单独一支。
2.4 量度特征判别
结合框架法和传统形态学共27个可量性状(公式中字母含义见表3),对褐菖鲉的形态特征进行判别分析,分别得到4个地理群体由10个变量构建的分类函数,据此进行判别和分组。4个群体判别正确率在81.5%~96.7%;其中,舟山群体判别正确率最高,为96.7%,综合判别正确率为90.88%(表4)。
根据典则判别函数散点图4可知,厦门(1)和汕头(3)群体的分布与函数1相关,大多分布于横轴的正半轴,多数点分布较为紧密,说明这2个群体关系密切;北海(2)和舟山(4)群体分布差异明显,舟山群体基本都在纵轴的正半轴,而北海群体则在纵轴的负半轴。
2.5 单因素方差分析
不同地理群体褐菖鲉27组可量性状的单因素方差分析结果见表5。结果显示,厦门群体与北海群体的16个指标差异显著,与汕头群体仅有4个指标差异显著;厦门与舟山群体14个指标差异显著,北海与汕头群体12个指标差异显著,北海与舟山群体11个指标差异显著,汕头与舟山群体6个指标有显著差异。差异系数显示,厦门和北海两两群体的尾柄长/尾柄高(C)和眼间隔/头长(F)差异系数分别为3.0161和2.8227,差异明显。
3 讨论
3.1 生物多元统计方法在鱼类种群研究中的应用
形态学特征可以通过外在形式较为直观地表现生物的遗传特性,将表型特征和形态学测定指标相结合,是研究物种各种群间的遗传变异、分类和系统发育最直接和最基础的方法,与遗传学分析相比,形态度量学方法更加方便、迅速、破坏性小,形态学至今仍是判明群体间差异的主要手段(费鸿年和张诗全,1990)。本研究指标主要涉及褐菖鲉的可数性状和可量性状,二者在生物统计学和渔业生物学上存有差异。可数性状在数值上不具有连续性,在褐菖鲉的发育早期就基本确定;可量性状在数值上是连续的,并且会随着其生活环境变迁而发生改变。基于传统形态学开展的鱼类研究往往偏向于可量和可数性状数据的测定,主要是对比不同群体间的变化以寻找群体间的差异,但这种方法的测量指标大多集中在鱼体的前半部且存在较多重叠,并不能较为精确地描述鱼体自身特征,加之数据的处理和分析过程中会对形态指标进行筛查,同样会影响形态数据的判别和采用(王志铮等,2011)。然而,基于框架法的多变量形态度量可将鱼体框架上不同坐标点划分成不同的单元,通过多元分析能相对精确地描述鱼体的外部特征(朱岚倩等,2019;Bookstein,1982),提高了形态差异判别和鉴定的准确率。框架结构可量性状将覆盖整个鱼体形状的标记距离通过数字特征坐标点来计算,特征点的选取也遵循易标记和同质性的原则(杨慧荣等,2016)。因此,本研究选取了传统的形态学测定和框架法相结合的方法,对4个褐菖鲉群体形态学差异进行多角度的比较分析。
事实上,基于生物多元统计的方法对鱼类群体差异进行研究,想要得到精确结果较为困难。这主要是由于鱼类群体的大小、规格差异会使研究结论失准,出现“假分离”现象。利用生物多元统计研究鱼类群体差异的前提是尽可能缩小不同群体大小与规格差异。通常情况下,采用所采集的形态特征数据与其体长的比值作为形态度量分析的性状值,本文也对分析数据进行了这样的处理。然而,这种转换方法也只是在一定程度上减弱了群体差异对研究结果的影响,即使是相同的鱼类群体,在不同发育阶段的表型比值范围也存在一定程度的差异。
3.2 不同地理群体的褐菖鲉形态差异比较
可数性状特征中,4个褐菖鲉群体的胸鳍鳍条、腹鳍软条、臀鳍鳍棘、臀鳍软条、背鳍鳍棘、背鳍鳍条、尾鳍鳍条、上鳃耙数范围均与以往的研究结果一致(吴常文,1999;金鑫波,2006;Nakabo,2013)。本研究结果中,褐菖鲉的侧线鳞、脊椎骨、下鳃耙数与其他文献资料中不尽相同,但差异甚微;其原因可能在于人工计数造成的测定误差。不同群体间可数性状特征差异不甚明显,难以作为区分4个褐菖鲉群体的依据。
主成分分析方法是一种多变量统计分析方法,该方法能够用于直观地检测个体间相似度(Gibson et al,1984)。本研究结果显示,前4个主成分累积贡献率为51.74%,远小于临界值85%,说明单独依据少数指标去分析褐菖鲉群体形态差异是不可靠的(Voss et al,1990);另外,厦门和汕头两群体形态相似度最高,而北海群体则与其他三者存在微弱差异。聚类分析直观呈现了各个群体之间的差异程度,从总体水平上反映各群体形态特征的相似性,北海群体和舟山群体的形态特征指标与其他2个群体均存在微弱差异,推测可能与近岸海域生境和摄食行为相关。判别分析是根据测量的若干变量值判断研究对象如何分类的统计方法。结合前2个判别函数值绘制的散点图,可见舟山和北海褐菖鲉群体与其他2个群体在形态上存在微弱差异。
单因素方差分析统计推断方法是推断各个样本所代表的总体的平均数是否相等,也是一种定性的多元统计方法(杨小勇,2013)。本研究中,舟山群体和北海群体与其他2个褐菖鲉群体存在差异的形态学指标略多,但经差异系数分析,只有北海群体与厦门群体在尾柄长/尾柄高和眼间隔/头长上存在显著差异。动物界的识别与划分原则是由Mayr等(1953)首先提出的,将亚种分类的差异系数临界值界定在1.28。因此,两群体间形态特征差异系数高于1.28时,表示两两群体间形态特征差异达到亚种及以上水平;反之,则属于两两群体间的差异。方差分析结果与主成分分析、聚类分析和判别分析结果基本一致,北海群体与其他3个群体存在显著性差异,但这种差异尚未达到亚种水平,仍属于种群间差异。
3.3 生境差异和长期进化影响褐菖鲉的种群形态
本研究选取的4个采样点具有较好的代表性。舟山、厦门、汕头、北海依次为我国东海北部、东海南部、南海北部和南海南部,海域环境差别较大,受水团组成和海洋生态等环境因素的影响程度也有所不同。研究表明,鱼类形态特征是遗传因素与环境因素共同作用的产物,与遗传因素相比,环境因素对鱼类形态不仅会产生影响,而且通常影响会十分显著(West-Eberhard et al,2003)。Moore等(1950)在研究北美不同水系之间鲤的形态学时发现,水流的浑浊度对鱼眼的退化程度有影响;而水流速和摄食难易程度可能是造成褐菖鲉尾部形态差异的原因(Takahashi et al,2007)。从鱼体结构和功能上分析,较小的头部可以减少鱼体与水体的接触面积,降低游泳过程中的阻力,使得游泳速度提升;较长且发达的尾柄能够提供足够的游泳动力,加快鱼类在水中的行动速度,使之在短时间内进行加速,从而快速逃避捕食者。厦门海域生物多样性丰富,褐菖鲉作为能量流动的低级肉食鱼类,有着多种天然的捕食者;附近海域居民喜食褐菖鲉,这也给近岸生存的褐菖鲉带来了被捕食压力。受上述生境选择影响,厦门群体的褐菖鲉逐渐发展出较为强壮的尾柄和较小的头部;受各地水文环境差异的影响,北海较厦门的水质条件优越很多,水体能见度更好(吴建平,2017)。厦门近岸海域的褐菖鲉在长期进化过程中对捕食和避害过程中受到水体浊度影响,视力逐渐退化,因此两群体形态指标差异显著。这一推测也在陆文泽等(2020)对于淮河流域似鯿的群体形态差异的研究中得到验证。
褐菖鲉为了更好地适应栖息地环境、更加多样地利用资源以及更优质地生存和繁衍,逐渐朝着适应环境的方向进化,形态特征也会发生不同程度的变化,生境差异可能是引起褐菖鲉不同群体间形态差异的最直接原因。生存空间不同导致的地理隔离,加之褐菖鲉的底栖定居生活习性导致的相对地理隔离,均使得各群体被隔绝于独立或相对独立的生活环境中,从而引起形态特征分化;同时,由于海洋的联通性,不同海域群体间由于繁殖、摄食等原因发生了个体迁移,使得基因交流得以保证,又会在一定程度上削弱形态特征的分化。
综上,褐菖鲉的外部形态是由外界环境和内部遗传因素共同决定的,是遗传和环境、结构基因和调控基因综合作用的结果。各群体褐菖鲉的形态特征差异与其不同栖息环境——洋流、水温、摄食习性、饵料组成等生态因子的差异密切相关,因其栖息环境的不同导致形态上产生了对环境的适应性变化(郑微云和李伦平,1988;Allendorf,1988)。鱼类外部形态差异有导致不同种群间遗传分化乃至生殖隔离的潜在可能。目前,形态学方法仍然是最主要、最基本的鱼类种群研究方法之一,在种群鉴别、群体比较等研究中发挥了重要作用,但在种群鉴定的同时,需要与之对应的遗传学方面的证据。为进一步探讨褐菖鲉不同地理群体形态差异及其成因,还需要开展分子遗传学方面的研究。
参考文献
陈大刚,张美昭,2015. 中国海洋鱼类[M]. 青岛:中国海洋大学出版社.
陈舜,肖云朴,伍德瀛,等,2008. 褐菖鲉网箱养殖试验初报[J]. 海洋科学, 32(8):5-8.
费鸿年,张诗全,1990. 水产资源学[M]. 北京:中国科学技术出版社.
郭显光,1998. 如何用SPSS软件进行主成分分析[J]. 统计与信息论坛, (2):60-64.
金鑫波,2006. 中国动物志:硬骨鱼纲:鲉形目[M]. 北京:科学出版社.
李朝文,王凯,程晓鹏,等,2018. 马鞍列岛海洋牧场褐菖鲉和小黄鱼营养生态位差异[J]. 应用生态学报, 29(5):1489-1493.
李龙,徐胜勇,张辉,等,2014. 中日褐菖鲉群体耳石形态学比较分析[J]. 集美大学学报(自然科学版), 19(4):247-252.
陆文泽,顾钱洪,王景龙,等,2020. 淮河流域似鯿不同群体的形态差异分析[J]. 水生态学杂志, 41(3):101-106.
麦杨娟,张旭光,郭弘艺,等,2019. 褐菖鲉发声肌形态的雌雄差异[J]. 上海海洋大学学报, 28(5):716-723.
孙文静,2018. 苯并[a]芘(Bap)对褐菖鮋(Sebasticus marmoratus)毒性效应的研究[D]. 舟山:浙江海洋大学.
王志铮,吴一挺,杨磊,等,2011. 日本沼虾(Macrobrachium nipponensis)形态性状对体重的影响效应[J]. 海洋与湖沼, 42(4):612-618.
韦璐,宋佳坤,潘连德,等,2014. 褐菖鲉和松江鲈侧线形态的比较[J]. 上海海洋大学学报, 23(6):801-809.
吴常文,1999. 浙江舟山近海褐菖鲉(Sebastiscus marmoratus)生物学研究[J]. 浙江海洋学院学报, 18(3):185-191.
吴建平,2017. 不同省域近岸海域水质比较研究[J]. 武夷学院学报, 36(9):28-34.
严银龙,袁新程,施永海,等,2019. 盐度对褐菖鲉幼苗生长耗氧率和排氨率的影响[J]. 大连海洋大学学报, 34(4):545-551.
杨慧荣,欧阳徘徊,李桂峰,等,2014. 长江常熟江段似鳊的生长特征及其形态特性[J]. 大连海洋大学学报, 29(4):397-402.
杨慧荣,欧阳徘徊,李桂峰,等,2016. 珠江流域3个野生大眼鳜群体的形态差异[J]. 中国水产科学, 23(2):447-457.
杨佳喆,齐闯,徐善良,2019. 褐菖鲉仔、稚鱼消化系统发育的组织下观察[J]. 热带海洋学报, 38(2):58-66.
杨军山,陈毅峰,2004. 副沙鳅属的多变量形态分析[J]. 动物分类学报,29(1):10-16.
杨小勇,2013. 方差分析法浅析—单因素的方差分析[J]. 实验科学与技术,11(1):23-25.
郑微云,李伦平,1988. 褐菖鲉视网膜感受系统及其适应特性研究[J]. 厦门大学学报:自然科学版, 27(3):328-332.
朱岚倩,林彦均,杨天燕,等,2019. 不同地理群体少鳞鱚形态差异比较研究[J]. 浙江海洋大学学报(自然科学版), 38(2):107-112.
Allendorf F W, 1988. Conservation biology of fishes[J]. Conservation Biology, 2(2):145-148.
Bookstein F L, 1982. Foundation of Morphomertrics[J]. Review of Ecology and Systematics, 13:451-470.
Cadrin S X, 2000. Advances in morphometric identification of fishery stocks[J]. Reviews in Fish Biology and Fisheries, 10(1):91-112.
Frederich B, Liu S V, Dai C F, 2012. Morphological and genetic divergences in a coral reef damselfish,Pomacentrus coelestis[J]. Evolutionary Biology, 39(3):359-370.
Garcia-Berthou E, 2001. On the misuse of residuals in ecology:testing regression residuals vs. the analysis of covariance[J]. Journal of Animal Ecology, 70(4):708-711.
Gibson A R, Baker A J, Moeed P, 1984. Morphometric variation in introduced populations of the common myna (Acridotheres tristis):An application of the jackknife to principal component analysis[J]. Systematic Zoology, 33(4):408-42l.
Liu Q, Liu L, Song N, et al, 2019b. Genetic structure in the marbled rockfish (Sebastiscus marmoratus) across most of the distribution in the northwestern Pacific[J]. Journal of Applied Ichthyology, 35(6):1249-1259.
Mamuris Z, Apostolidis A P, Panagiotaki P, et al, 1998. Morphological variation between red mullet populations in Greece[J]. Journal of Fish Biology, 52(1):107-117.
Mayr E, Linsley E G, Usinger R L, 1953. Methods and Principles of Systematic Zoology[M]. New York: McGraw-Hill.
Moore G A, 1950. The cutaneous sense organs of barbeled minnows adapted to life in the waters of the Great Plains region[J]. Transactions of the American Microscopical Society, 69(1):69-95.
Nakabo T,2013. Fishes of Japan:with pictorial keys to the species[M]. Tokyo: Tokai University Press.
Takahashi R, Watanabe K, Nishida M, et al,2007. Evolution of feeding specialization in Tanganyikan scale-eating cichlids:a molecular phylogenetic approach[J]. BMC Evolutionary Biology, 7(2):195-205.
Turan C, 1999. A note on the examination of morphometric differentiation among fish populations: the truss system[J]. Turkish Journal of Zoology, 23(3):259-263.
Voss R S, Marcus L F, Escalante P, 1990. Morphological evolution in muroid rodents I. Conservative patterns of craniometric covariance and their onto-genetic basis in the Neotropical genus Zygodontomys[J]. Evolution,44(6):156-158.
West-Eberhard M J, 2003. Phenotypic plasticity and the origins of diversity[J]. Annual Review of Ecology & Sys-tematics, 20(1):249-278.
(责任编辑 万月华)
Comparison of Morphological Characteristics of Marbled Rockfish
(Sebastiscus marmoratus) Among Different Geographic Populations
LIU Lu1, ZHOU Yong‐dong2, GAO Tian‐xiang3
(1. Naval Architecture and Port Engineering College, Shandong Jiaotong University, Weihai 264209, P.R. China;
2. Marine Fishery Institute of Zhejiang Province, Key Laboratory of Sustainable Utilization
of Technology Research for Fishery Resource of Zhejiang Province, Zhoushan 316021, P.R. China;
3. Fishery College, Zhejiang Ocean University, Zhoushan 316021, P.R. China)
Abstract:Sebastiscus marmoratus is a common species in the warm water of bottom layers in the Northwest Pacific Ocean. It is a commercially valuable fish in China, widely distributed in the Bohai Sea, the Yellow Sea, the East China Sea and the South China Sea. S. marmoratus is also a marine environment indicator and used for monitoring ecological health. Thus, a study of the morphological differences among different S. marmoratus geographic populations and their relationship to habitat is of significance for studying fish biodiversity and resource protection in the offshore waters of China. In this study, we analyzed the morphological differences among four S. marmoratus geographic populations (Zhoushan of Zhejiang Province, Xiamen of Fujian Province, Shantou of Guangdong Province and Beihai of Guangxi Province), and investigated the relationship of morphological variation with habitat using principal component analysis, discriminant analysis, cluster analysis and one-way ANOVA. From January to March of 2016, a total of 112 S. marmoratus specimens were collected from the four areas, and 8 segmented characteristics and 15 measurable parameters of the specimens were measured, combining traditional morphological measurements and multivariable frame measurement methods. Results show that there were no significant differences in countable traits among the different geographic populations, so these traits alone cannot be used to distinguish the four S. marmoratus populations. However, combined with frame characteristics and traditional morphological comparisons, the comprehensive discrimination accuracy of the four groups was 81.5%-96.7%. Principal component analysis shows that the cumulative contribution of the first four principal components was 51.74%, and the morphological characteristics of the Beihai and Zhoushan populations could, to some degree, be differentiated from the other two populations. Compared with the Beihai population, the Xiamen population had a longer tail and smaller head. The relative stability of the habitat differences among the geographic populations has led to adaptive differentiation in morphological characteristics. However, because of the connectivity between the East China Sea and the South China Sea and short-distance migration for feeding and reproduction, there is short term gene exchange that weakens the differentiation of morphological characteristics.
Key words: Sebastiscus marmoratus; geographic population; morphological characteristics; adaptive differentiation

