MEBO对高糖培养的成纤维细胞外泌体分泌的影响
周安邦,徐媛媛,郭小英,周宇,代平平,农丝洁,吴标良
(1.右江民族医学院附属医院内分泌科,广西百色 533000;2.右江民族医学院研究生学院,广西百色 533000)
糖尿病在中国的发病率非常高,共有1.164亿人,2019年有420万糖尿病患者因为其并发症而死亡[1]。糖尿病可以引起多种并发症,如肾衰竭、视网膜病变、神经病变、糖尿病足(diabetic foot,DF)等。DF是糖尿病慢性创面常见的一种类型,患者会因治疗或护理不当最终导致截肢,并且愈合不良。美宝湿润烧伤膏(moist exposed burn ointment, MEBO)在治疗糖尿病慢性创面的临床和基础研究方面已经得到证明,最近更是在细胞因子和信号通路方面取得一些成果[2]。成纤维细胞能促进创面修复,并且可以分泌大量外泌体(exosomes)。外泌体参与调节细胞的增殖、凋亡、迁移、促进血管形成等生物学活动[3],现已显示外泌体在细胞间通讯中起着至关重要的作用。目前根据研究表明,在创面修复过程中外泌体起着非常重要的作用。本研究通过观察MEBO对高糖培养成纤维细胞分泌外泌体的影响,从而探讨其对创面再生修复的机制。
1 材料与方法
1.1 材料
1.1.1 动物本实验采用SPF级Wistar大鼠,由长沙天勤生物技术有限公司提供,公司的许可证号为SCXK(湘)2014-0011。该实验经右江民族医学院动物伦理委员会批准。
1.1.2 主要试剂与耗材胰蛋白酶:美国Gibco公司生产;DMEM高糖培养液:美国Gibco公司生产;PBS:北京索莱宝科技有限公司生产;南美胎牛血清:乌拉圭ExCELL公司生产;外泌体提取试剂盒:美国SBI公司生产;MEBO:汕头市美宝制药有限公司生产;超速离心管:美国Thermo Fisher Scientific公司生产;超滤管:美国MILLIPORE公司生产;青链霉素混合液(100×):北京索莱宝科技有限公司生产。
1.2 实验方法
1.2.1 不同浓度MEBO培养液的制备根据课题组前期研究,将MEBO药膏通过二甲基亚砜(DMSO)配置成1 g/L母液。然后将母液加入培养液配置成低(20 g/L)、中(40 g/L)、高(80 g/L)三个浓度。
1.2.2 大鼠成纤维细胞的分离、培养及分组取刚出生的Wistar大鼠的表皮组织,于无菌超净台中取出,清洗血液、脂肪等残留组织后,通过酶消化法分离出原代成纤维细胞,等到细胞长满后,用胰蛋白酶消化传代,此细胞为P1代,当细胞传代到P4时,平均分为四组(每组3个样本):正常培养组(对照组)、MEBO低浓度组(20 g/L)、MEBO中浓度组(40 g/L)、MEBO高浓度组(80 g/L)。
1.2.3 收集上清并提取外泌体通过超速离心去除胎牛血清的外泌体配置培养基。P4代成纤维细胞贴壁后,等细胞达到视野的80%,更换为6 mL不同浓度(20 g/L、40 g/L、80 g/L)的MEBO培养液。培养72 h后收集细胞上清,然后用超滤管进行浓缩,最后用SBI外泌体试剂盒提取沉淀后用PBS重悬。
1.2.4 BCA法检测外泌体总蛋白浓度使用BCA试剂盒,在37 ℃孵育箱中静置30 min。用酶标仪在562 mm波长检测各个孔的吸光值。检测后根据标准品绘制标准曲线,测量出各样本外泌体蛋白浓度。
1.2.5 Western blotting检测外泌体标记蛋白CD81、TSG101的表达裂解外泌体悬液得到蛋白并通过BCA检测其蛋白浓度,制胶后进行电泳,然后在甬道上样。电泳后根据分子量大小选取凝胶带进行转膜。转膜后用5%BSA溶液室温封闭1 h。用抗体稀释液以1∶5000的比例配置CD81、TSG101溶液,4 ℃过夜孵育,再加入1∶5000的二抗孵育1 h。一抗、二抗孵育后均用TBST洗涤三次,每次10 min。CD81、TSG101一抗来源于兔,二抗为山羊抗兔。最后进行显影。
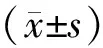
2 结 果
2.1 Western blotting检测外泌体标记蛋白CD81、TSG101的表达MEBO组和对照组均能表达外泌体标记蛋白CD81、TSG101。见图1。
2.2 MEBO对成纤维细胞分泌外泌体的影响MEBO各浓度组外泌体分泌量均高于对照组,差异有统计学意义(P<0.05),MEBO低浓度组(20 g/L)与MEBO高浓度组(80 g/L)之间差异无统计学意义(P>0.05)。中浓度组分泌外泌体最多,与低浓度组、高浓度组相比差异均有统计学意义(P<0.01)。见表1。

A:对照组;B:MEBO低浓度组;C:MEBO中浓度组;D:MEBO高浓度组
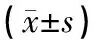
表1 不同浓度MEBO对成纤维细胞分泌外泌体的影响
3 讨 论
糖尿病是一种代谢紊乱疾病,已经成为一种主要的全球卫生流行病,在我国糖尿病的死亡率呈现逐年上升趋势[4]。其中糖尿病慢性创面易造成预后不良和截肢,并且治愈后复发率也高达30%,因此提高糖尿病慢性创面的治疗水平非常重要。但因为其治疗困难,临床上以预防为主治疗为辅。治疗前检测溃疡性质来制订合适方案,控制和降低血糖的同时,通过改善血液循环、控制感染、彻底清创、高压氧疗等多学科协同治疗来促进创面愈合[5]。
成纤维细胞功能活动旺盛,细胞质嗜弱碱性,具有明显的蛋白质合成和分泌活动,在创面修复过程中起到重要作用[6]。受损部位成纤维细胞可与新生毛细血管结合,形成肉芽组织[7]。研究表明,成纤维细胞在生长过程中通过分泌大量外泌体来传递生物学信息,调控细胞的生长[8]。
另外有研究结果表明,外泌体可以促进创面愈合[9]。在炎性期,过度的炎症反应会影响创面的愈合,甚至会导致多器官衰竭,慢性皮肤损伤中,巨噬细胞(macrophages,Mφs)积聚,促炎因子释放增加[10],Mφs可分为M1型和M2型,M1型释放各种促炎因子,M2型可以下调炎症反应[11],并且促进创面愈合。目前研究发现外泌体可以促使M1型Mφs向M2型Mφs转变[12],同时还能分泌多种细胞因子抑制淋巴细胞,从而减轻炎症反应。外泌体可以诱导血管的生成,外泌体中的miRNA-125a可以抑制血管生成抑制因子的表达,这些在血管生成中发挥非常重要的作用,通过改善血液循环来促进慢性创面的愈合。同样研究表明,外泌体中许多效应分子miRNA也参与到修复过程。微小 RNA(miRNA)作为内源性调控性RNA,广泛参与细胞增殖、分化、凋亡等病理生理过程。其中miR-21是人类癌症和其他疾病中最频繁上调的miR,其可以促进细胞增殖、分化、迁移、凋亡和上皮向间质转化。根据研究表明miR-21通过基质金属蛋白酶-1(MMP-1)和MMP-3的上调来促进成纤维细胞的增生[13],外泌体在瘢痕修复中也起到重要作用,可以抑制瘢痕胶原纤维的增生,通过医疗技术进展甚至可以做到无瘢痕修复[14]。
最近20年来,在治疗糖尿病慢性创面,皮肤再生医疗技术(MEBO/MEBT)已经成为比较成熟的医疗技术。在本次实验中,通过MEBO干预成纤维细胞,收集上清液提取外泌体。Western blotting检测到外泌体标记蛋白TSG101、CD81在各组中均有表达,初步证明提取的确实是外泌体悬液,而在BCA实验中,MEBO干预后的成纤维细胞分泌的外泌体含量增加,中浓度组和对照组相比有显著差异。
本实验的研究表明,MEBO可以促进成纤维细胞分泌外泌体,对慢性创面的愈合起到积极的作用,但MEBO促进成纤维细胞分泌外泌体的机制尚未阐明,仍然需要进一步的研究。

