贝伐珠单抗联合化疗对晚期非鳞非小细胞肺癌患者免疫功能及血清CEA、CA125、CYFRA21-1水平的影响
周宗远,容世健
(广西钦州市浦北县人民医院a.肿瘤血液内科,b.药剂科,广西浦北 535300)
肺癌是一种发生于肺组织的恶性肿瘤,其早期的表现为食欲不振、咳嗽、胸痛,后期患者出现消瘦、恶病质表现[1]。非小细胞肺癌是肺癌较为常见的一种类型,其包括鳞癌、腺鳞癌、腺癌等病理类型。现阶段,临床治疗晚期非鳞非小细胞肺癌的标准治疗方案是紫杉醇、卡铂化疗方案及常规对症治疗,可有效阻止肿瘤细胞的增殖,进而在一定程度上缓解患者的临床症状,控制病情进展,但其在临床应用中疗效欠佳。贝伐珠单抗是一种单克隆抗体,其可对血管内皮生长因子(VEGF)发挥较高的亲和力,并与之结合,临床常用于治疗卵巢癌、晚期转移性结直肠癌等疾病[2]。血清糖类抗原125(CA125)、癌胚抗原(CEA)、细胞角蛋白19片段抗原(CYFRA21-1)作为临床常用的血清肿瘤标志物,不仅可用于评估疾病的严重程度,在患者治疗效果及预后评估中也有重要意义。基于此,本研究旨在探讨贝伐珠单抗联合化疗对晚期非鳞非小细胞肺癌患者免疫功能及血清CEA、CA125、CYFRA21-1水平的影响。
1 资料与方法
1.1 一般资料选取2019年1月至2020年1月我院收治的65例晚期非鳞非小细胞肺癌患者,按照随机数字表分成对照组(32例)和观察组(33例)。对照组男22例,女10例;年龄35~73岁,平均(55.31±3.23)岁;TNM分期:Ⅳ期16例,Ⅲb期12例,Ⅲa期4例;病理分型:腺癌25例,其他7例;转移15例,未转移17例;转移部位:脑10例,骨5例。观察组男23例,女10例;年龄36~74岁,平均(55.52±3.17)岁;TNM分期:Ⅳ期18例,Ⅲb期11例,Ⅲa期4例;病理分型:腺癌27例,其他6例;转移16例,未转移17例;转移部位:脑11例,骨5例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:符合《中华医学会肺癌临床诊疗指南(2019版)》[3]中的诊断标准;经过病理学检查确诊者;病历资料齐全者;有晚期非鳞非小细胞肺癌临床症状者等。排除标准:合并有其他恶性肿瘤者;有化疗禁忌证者;伴免疫功能障碍者;肺癌驱动基因阳性者等。本研究均经医院伦理委员会批准且所有患者及家属已签署知情同意书。
1.2 方法两组患者予以常规对症治疗:抗感染、营养支持、止痛等。对照组予紫杉醇联合卡铂化疗方案:紫杉醇注射液(规格:5 mL∶30 mg,注册证号H20171227,美国百时美施贵宝制药公司)静脉滴注,175 mg/(m2·次),1次/21 d,卡铂注射液(规格:10 mL∶50 mg,国药准字H20020181,齐鲁制药有限公司)溶于250~500 mL5%的葡萄糖溶液中进行静脉滴注,0.3~0.4 g/(m2·次),1次/21 d。在对照组的基础上,观察组予贝伐珠单抗注射液(规格:4 mL∶100 mg,注册证号S20170035,罗氏制药〔瑞士〕有限公司)进行静脉滴注,15 mg/(kg·次),1次/21 d。两组均以1个周期21 d为准,共连续治疗4个周期。
1.3 观察指标①临床疗效:治疗后,依据《实体瘤治疗疗效评价标准-RECIST》[4]中的诊断标准评估两组临床疗效。完全缓解(CR):治疗后患者病灶均完全消失,且保持时间>1个月;部分缓解(PR):病灶最大层面面积缩小>50%,且保持时间>1个月;稳定(SD):病灶最大层面面积缩小50%及以下或增大<25%,且无新病灶出现;进展(PD):病灶最大层面面积增大25%及以上,且有新病灶出现。临床总有效率为完全缓解率与部分缓解率及稳定率之和。②细胞生长因子:治疗前后,抽取两组空腹静脉血5 mL,并待其凝固后,以3000 r/min离心10 min取血清,血清碱性纤维细胞因子(bF-GF)、VEGF含量检测采用酶联免疫吸附法。③肿瘤标志物:采血、血清制备的具体方法与②一致,治疗前后血清CA125、CEA、CYFRA21-1含量检测采用放射免疫法。④免疫功能:采血的具体方法与②一致,治疗前后外周血CD4+、CD8+、CD4+/CD8+水平检测采用免疫分析仪。⑤不良反应:于治疗期间,统计两组发生胃肠道反应、皮肤不良反应、骨髓抑制、高血压等不良反应情况。⑥无进展生存期(PFS)、总生存期(OS):统计两组患者PFS、OS情况,其中PFS:从开始治疗到疾病进展的时间;OS:从开始治疗到患者死亡的时间。

2 结 果
2.1 临床疗效治疗后观察组患者临床总有效率为90.91%,高于对照组的71.87%,差异有统计学意义(P<0.05)。见表1。
2.2 细胞生长因子与治疗前相比,治疗后两组患者血清bF-GF、VEGF含量均降低,其中观察组下降幅度大于对照组(P<0.001)。见表2。
2.3 肿瘤标志物与治疗前相比,治疗后两组患者血清CA125、CEA、CYFRA21-1含量均降低,其中观察组下降幅度明显大于对照组(P<0.001)。见表3。
2.4 免疫功能与治疗前相比,治疗后对照组外周血CD4+、CD4+/CD8+水平降低,而观察组则升高,且观察组高于对照组,对照组外周血CD8+水平升高,观察组降低,且观察组低于对照组(P<0.001)。见表4。
2.5 不良反应治疗期间观察组胃肠道反应、皮肤不良反应、骨髓抑制、高血压的发生率与对照组相比,差异无统计学意义(P>0.05)。见表5。
2.6 PFS、OS情况观察组患者PFS、OS分别为(10.58±1.26)个月、(26.85±2.24)个月,均长于对照组的(8.27±1.41)个月、(20.34±2.13)个月(t=6.970,12.000,均P<0.001)。
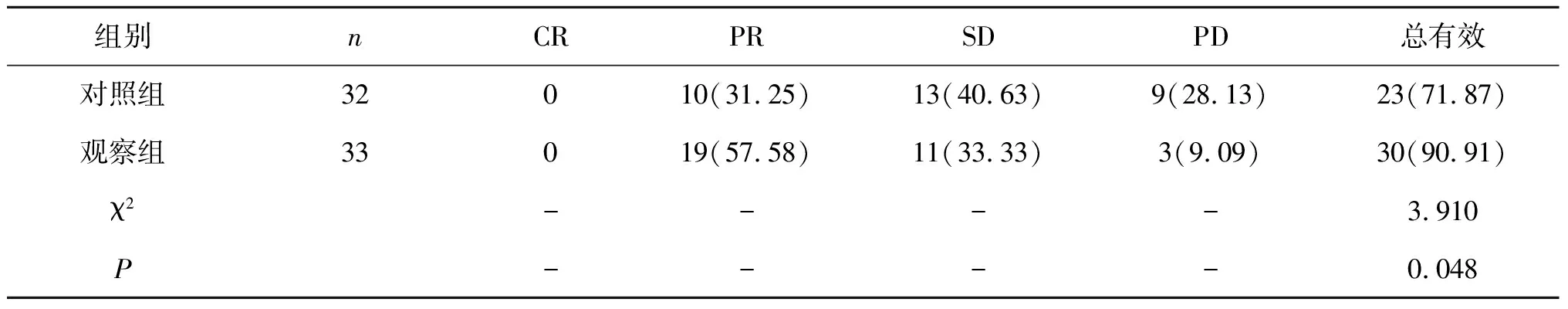
表1 两组治疗后临床疗效比较[n(%)]

表2 两组细胞生长因子含量比较
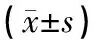
表3 两组患者肿瘤标志物含量比较

表4 两组患者免疫功能比较
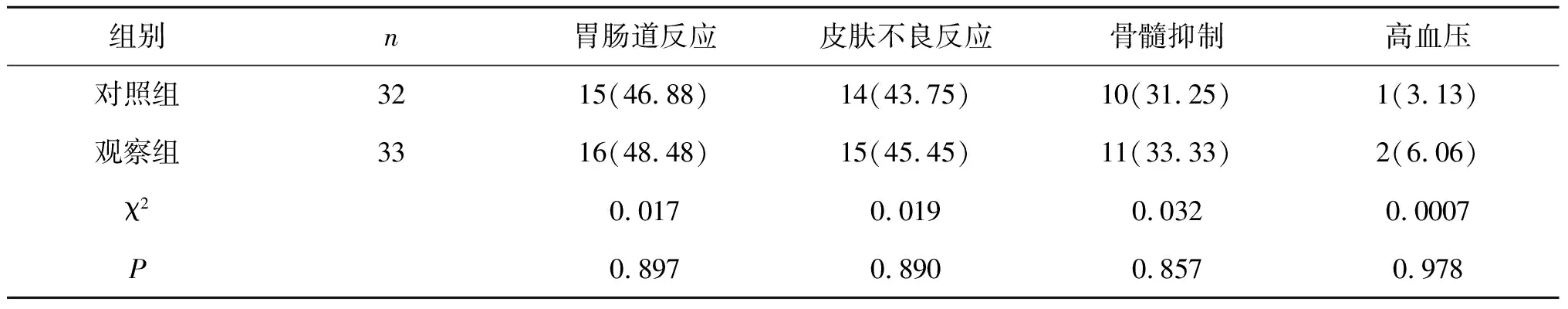
表5 两组不良反应比较[n(%)]
3 讨 论
非小细胞肺癌是由大气污染、吸烟等因素导致肺泡上皮、支气管黏膜上皮等部位生长恶性肿瘤的一种病症,非鳞非小细胞肺癌在肺癌中的占比可达80%,且多数患者在临床确诊时病情已发展至晚期[5]。紫杉醇、卡铂化疗方案及常规对症治疗主要是通过抑制细胞有丝分裂、破坏细胞DNA、促进微管聚合成团块和束状、抑制微管网的正常重组等途径,进而抑制肿瘤增长,缩小肿瘤,控制病情进展,但其在临床应用中安全性较低。
贝伐珠单抗是通过与癌组织分泌的VEGF产生竞争性结合,进而抑制癌组织血管新生,阻碍肿瘤细胞增殖,同时其可改善异常血管的功能、结构、微环境等,促进药物集中于癌组织,进而获得良好的治疗效果[6]。免疫功能在恶性肿瘤患者的疾病进展过程中发挥着重要作用,当患者罹患肿瘤后,癌细胞会削弱机体的正常免疫功能,加上化疗药物在应用期间所产生的一系列毒副作用,也会破坏机体的免疫系统,导致患者免疫力降低,进而使得外周血CD4+、CD4+/CD8+水平降低,外周血CD8+水平升高[7]。贝伐珠单抗与化疗药的协同作用,其机制可能在于贝伐珠单抗能够诱导肿瘤血管正常化,从而改善肿瘤间质的高压状态,提高肿瘤杀灭效果,解除非鳞非小细胞肺癌对免疫功能的抑制,进而减小化疗对机体免疫功能的影响,维持T细胞亚群水平稳定,对机体起到保护作用[8]。本研究结果显示,治疗后观察组临床总有效率、外周血CD4+、CD4+/CD8+水平高于对照组,外周血CD8+、血清bF-GF、VEGF含量低于对照组,观察组治疗期间胃肠道反应、皮肤不良反应、骨髓抑制、高血压的发生率与对照组相比无明显差异,观察组患者PFS、OS长于对照组,表明贝伐珠单抗联合化疗治疗晚期非鳞非小细胞肺癌可有效缓解患者的临床症状,抑制血管新生,改善免疫功能,延长生命周期,且安全性高,与陶虹等人[9]的研究结果相符。血清CA125、CEA、CYFRA21-1均为机体肿瘤标志物,其水平的升高可促进患者肿瘤细胞增长,进而缩短病程。贝伐珠单抗主要是通过改善异常血管,并于肿瘤部位聚集化疗药物,进而拮抗肿瘤生长,降低血清肿瘤标志物[10]。随着病情进展,患者在新生血管形成、胸膜通透性增加的影响下,多合并恶性胸腔积液。有研究表明[11],贝伐珠单抗与常规化疗药物联合使用,能够有效控制恶性胸腔积液。此外,贝伐珠单抗通过静脉给药途径,在控制胸腔积液的同时减少了胸腔内注射的必要性,进而降低胸膜局部的副反应,提高患者生活质量。本研究结果显示,治疗后观察组血清CA125、CEA、CYFRA21-1低于对照组,表明贝伐珠单抗联合化疗治疗晚期非鳞非小细胞肺癌可有效降低患者的肿瘤标志物,控制病情进展,与宋琳等人[12]的研究结果相符。
综上,贝伐珠单抗联合化疗治疗晚期非鳞非小细胞肺癌可有效缓解患者的临床症状,抑制血管新生,改善免疫功能,降低血清肿瘤标志物,提高临床疗效,延长生命周期,且安全性高,值得临床推广应用。

