GSDMB和GSDMD在皮肤黑色素瘤中的表达及其与预后和免疫浸润的相关性分析
聂刚 亓俊华


摘 要:基于生物信息学探讨GSDMB和GSDMD在皮肤黑色素瘤(SKCM)中的表达及其与预后及免疫浸润的相关性。通过GEPIA2和cBioportal数据库分析GSDMB和GSDMD在SKCM中的表达和变异情况。通过GEPIA2数据库分析GSDMB和GSDMD对SKCM的预后价值。通过GSCA数据库分析SKCM中GSDMB和GSDMD表达水平与肿瘤相关通路活性的相关性。通过TIMER数据库分析SKCM中GSDMB和GSDMD表达水平与免疫细胞浸润水平的关系。结果显示,SKCM组织中GSDMB的表达水平较正常组织显著降低,而GSDMD的表达水平较正常组织显著升高。363例SKCM样本中GSDMB和GSDMD总变异率为9.64%,以突变为主(4.96%)。GSDMB和GSDMD的高表达水平与SKCM患者较高的总生存率显著相关。GSDMB在SKCM中可能激活了细胞凋亡通路,而GSDMD在SKCM中可能激活了Hormone ER通路以及细胞凋亡通路。GSDMB和GSDMD的表达水平与多种免疫细胞的浸润水平正相关。本研究表明,在SKCM患者中,GSDMB和GSDMD高表达与较高的免疫浸润细胞水平和总生存率相关,GSDMB和GSDMD有望成为SKCM免疫细胞浸润和预后相关的生物学标志物。
关键词:皮肤黑色素瘤;GSDM;预后;免疫浸润;生物信息学
中图分类号:R739.5 文獻标志码:ADOI:10.3969/j.issn.1007-7146.2023.03.011
The Expression of GSDMB and GSDMD in Skin Cutaneous Melanoma and Its Correlation with Prognosis and Immune Infiltration
NIE Ganga, QI Junhuab*
(The Seventh Affiliated Hospital, Sun Yat-sen University a. Department of Dermatology; b. Department of Clinical Medical Laboratory, Shenzhen 518107, China)
Abstract: To investigate the expression of GSDMB and GSDMD in skin cutaneous melanoma (SKCM) and their correlation with prognosis and immune infiltration based on bioinformatics. The expression and variation of GSDMB and GSDMD in SKCM were analyzed by GEPIA2 database and cBioportal database. The prognostic value of GSDMB and GSDMD on SKCM was analyzed by GEPIA2 database. The GSCA database was used to analyze the correlation between the expression level of GSDMB and GSDMD in SKCM and the activity of tumor-related pathways. The TIMER database was used to analyze the relationship between the expression level of GSDMB and GSDMD in SKCM and the infiltration level of immune cells. The results showed that the expression level of GSDMB in SKCM tissue was significantly lower than that in normal tissue, while the expression level of GSDMD was significantly higher than that in normal tissue. In 363 SKCM samples, the total variation rate of GSDMB and GSDMD was 9.64%, with mutations predominating (4.96%). The high expression level of GSDMB and GSDMD was significantly associated with the higher overall survival rate of SKCM patients. GSDMB may activate apoptosis pathway in SKCM, while GSDMD may activate Hormone ER pathway and apoptosis pathway in SKCM. The expression level of GSDMB and GSDMD was positively correlated with the infiltration level of various immune cells. This study shows that the high expression of GSDMB and GSDMD in SKCM patients is related to the higher infiltration level of immune cells and overall survival rate. GSDMB and GSDMD are expected to become biomarkers related to immune cell infiltration and prognosis of SKCM.
Key words: skin cutaneous melanoma; gasdermin; prognosis; immune infiltration; bioinformatics
(Acta Laser Biology Sinica, 2023, 32(3): 282-288)
皮肤黑色素瘤(skin cutaneous melanoma,SKCM)是一种源于黑素细胞的恶性肿瘤,其恶性程度在皮肤恶性肿瘤中居首位。SKCM转移率高、预后差[1]。据报道,转移性SKCM患者中位生存期<6个月,5年生存率<5%[2]。深入认识SKCM发生、发展相关的分子机制,可望为其诊治提供新的生物靶点和思路。
消皮素(gasdermin,GSDM)基因家族主要表达于皮肤和胃肠道的上皮组织,参与了上皮细胞的发育、凋亡、炎症和癌变等多个生理和病理过程[3-4]。截止到目前,在人类中发现了6个GSDM基因家族成员,包括GSDMA、GSDMB、GSDMC、GSDMD、GSDME(DFNA5)和PJVK(DFNB59)[3-4]。既往研究表明,GSDM家族作为关键调控因子,直接或间接影响乳腺癌[5]、胃癌[6]、卵巢癌[7]等多种肿瘤的进展。然而,目前关于GSDM基因家族与SKCM之间的研究较少。本研究拟通过生物信息学方法挖掘分析GSDMB、GSDMD在SKCM組织中的表达、基因突变、预后价值及可能的调控机制,为进一步研究GSDMB、GSDMD在SKCM中的作用和临床应用价值提供理论基础。
1 材料与方法
1.1 GEPIA2数据库分析
GEPIA2数据库(http://gepia2.cancer-pku.cn/#index)包含TCGA和GTEx项目的8 587个正常样本和9 736个肿瘤样本的RNA表达测序数据,可用于差异分析、生存分析和相关性分析[8]。本研究通过GEPIA2数据库分析GSDMB、GSDMD在SKCM组织和正常组织中的表达差异以及GSDMB、GSDMD表达水平与SKCM患者总生存率的相关性。
1.2 cBioportal数据库分析
cBioPortal数据库(http://cbioportal.org)的数据来源于TCGA、GDAC、UCSC、ICGC、IGV、Oncomine等多个数据库,可用于体细胞突变、DNA拷贝数改变、mRNA和microRNA表达以及DNA甲基化分析[9]。本研究通过cBioPortal数据库分析SKCM中GSDMB、GSDMD的突变情况。
1.3 GSCA数据库分析
GSCA数据库(http://bioinfo.life.hust.edu.cn/GSCA/#/)整合了来自TCGA的33种癌症类型的10 000多个多维基因组数据,以及来自GDSC数据库(https://www.cancerrxgene.org/)和CTRP数据库(https://portals.broadinstitute.org/ctrp/)的750多个小分子药物,是基因组、药物基因组和免疫基因组癌症分析的集成平台。本研究利用GSCA数据库分析SKCM中GSDMB和GSDMD的表达水平与肿瘤相关通路活性的相关性。
1.4 TIMER数据库分析
TIMER数据库(https://cistrome.shinyapps.io/timer/)包括来自TCGA的32种癌症类型的10 897个样本,可用于分析不同癌症类型中免疫细胞浸润的丰度[10]。本研究通过TIMER数据库分析SKCM组织中GSDMB和GSDMD的表达水平与6种免疫细胞(B 细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞)浸润水平的相关性。
1.5 统计学方法
应用各在线数据库系统默认的统计学方法分析,以P<0.05为有统计学差异。
2 结果与分析
2.1 GSDMB和GSDMD在SKCM组织中的表达分析
GEPIA2数据库中收录了来自TCGA项目中的461例SKCM组织样本的mRNA表达水平,以及TCGA和GTEx项目中共558例正常皮肤组织样本的mRNA表达水平。通过GEPIA2数据库分析SKCM组织中GSDMB和GSDMD的表达水平,结果显示,SKCM组织中GSDMB的表达水平较正常组织显著降低(P<0.05)(图1a),而GSDMD的表达水平较正常组织显著升高(P<0.05)(图1b)。
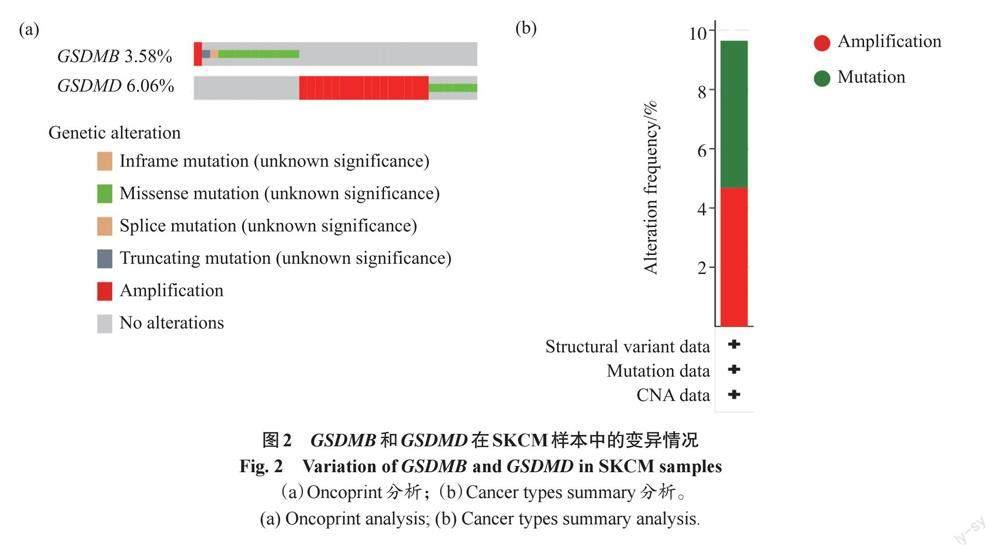
2.2 GSDMB和GSDMD在SKCM中的变异情况
为了进一步研究GSDMB和GSDMD在SKCM中的作用,通过cBioportal数据库分析GSDMB和GSDMD在SKCM中的变异情况。结果显示:在363例SKCM样本中,GSDMB和GSDMD的变异率分别为3.58%、6.06%(图2a);总变异率为9.64%,其中突变18例(4.96%),扩增17例(4.68%)(图2b)。
2.3 GSDMB和GSDMD表达水平与SKCM患者
预后的相关性分析
GEPIA2数据库分析结果显示,GSDMB和GSDMD与SKCM患者的无病生存率无明显相关性(P>0.05)(图3a~3b),但是GSDMB和GSDMD的高表达水平与SKCM患者较高的总生存率显著相关(P<0.05)(图3c~3d)。
2.4 SKCM中GSDMB和GSDMD表达水平与肿瘤相关通路活性的相关性
为了进一步研究GSDMB和GSDMD在SKCM中的调控机制,通过GSCA数据库分析SKCM中GSDMB和GSDMD表达水平与Apoptosis、Cell Cycle、DNA Damage、EMT、Hormone AR、Hormone ER、PI3K-AKT、RAS-MAPK、RTK、TSC-mTOR等10条肿瘤相关通路活性的相关性。结果显示,GSDMB在SKCM中可能激活了细胞凋亡通路,GSDMD在SKCM中可能激活了Hormone ER通路以及细胞凋亡通路(表1)。
2.5 SKCM中GSDMB和GSDMD表达水平与免疫细胞浸润水平的相关性分析
GSDMB的表达水平与CD8+T细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞的浸润水平正相关(图4a~4b)。GSDMD的表达水平与B 细胞、CD8+T细胞、CD4+T细胞、中性粒细胞和树突状细胞的浸润水平正相关(图4c~4d)。
3 讨论
本研究全面分析了GSDMB和GSDMD在SKCM中的表达和临床预后价值。研究发现,GSDMB和GSDMD在SKCM中显著差异表达。GSDMB在SKCM组织中的表达较正常组织显著降低,而GSDMD的表达较正常组织显著升高。此外,SKCM基因组学分析发现,GSDMB和GSDMD在SKCM样本中存在较高频率的基因变异。由此说明,GSDMB和GSDMD在SKCM中可能扮演着重要的角色。预后分析发现,GSDMB和GSDMD的高表达与SKCM患者较高的总生存率显著相关,表明GSDMB和GSDMD具有作为预测SKCM患者预后的生物标志物的潜力。
GSDMB的N端结构域与硫化物有明显的联系,而硫化物的过表达往往与癌症的进展有关,因此,GSDMB可能在癌细胞的转移和迁移中具有重要作用[11-13]。GSDMB在某些癌症中表达上调,如乳腺癌、胃癌和结肠癌细胞[14]。有人认为GSDMB可能作为一种致癌基因,促进肿瘤进展和转移[15-16]。GSDMD是目前已知的最常见、研究最深入的细胞焦亡相关蛋白,它参与了细胞焦亡的经典和非经典途径[17]。细胞焦亡与肿瘤的发生、发展及肿瘤对药物治疗的耐药性密切相关[18]。为了进一步研究GSDMB和GSDMD在SKCM中的调控机制,我们分析了SKCM中GSDMB和GSDMD表达水平与肿瘤相关通路活性的相关性。结果显示,SKCM中GSDMB激活了细胞凋亡通路,而GSDMD激活了细胞凋亡通路以及Hormone ER通路。越来越多的研究表明,黑色素瘤的发生、发展与雌激素水平有关。此外,ERα和ERβ的比例失调也影响黑色素瘤的发生、发展过程。ERα可能通过表观遗传学失活促进肿瘤的增殖,而ERβ通过抑制PIK/Akt 通路而发挥抗癌作用[19-20]。在黑色素瘤恶化过程中ERβ处于低水平表达状态,并且ERβ的表达水平与黑色素瘤的恶性程度呈负相关[21]。结合文献报道及本研究结果,我们推测,GSDMB高表达的SKCM患者总生存率较高的原因可能与GSDMB激活细胞凋亡通路有关,而GSDMD高表达的SKCM患者总生存率较高的原因可能与GSDMD激活细胞凋亡通路及Hormone ER通路有关。
肿瘤微环境中免疫细胞浸润影响肿瘤的发生、发展,也是影响免疫治疗的疗效和临床预后的一个重要因素[22-24]。肿瘤微环境中的肿瘤浸润淋巴细胞是多种癌症预后和免疫治疗疗效的独立预测因子[25]。我们的研究表明,GSDMB和GSDMD的表达水平与多种免疫细胞浸润水平之间存在显著关联。GSDMB的表达水平与B 细胞、CD4+T细胞、CD8+T细胞、中性粒细胞、巨噬细胞和树突状细胞的浸润水平呈正相关。GSDMD的表达水平与B 细胞、CD4+T细胞、CD8+T细胞、中性粒细胞和树突状细胞的浸润水平呈正相关。这表明,GSDMB和GSDMD的高表达可能与SKCM肿瘤微环境中较高的免疫活性有关,可能通过上调免疫浸润细胞水平改善SKCM患者的生存状况。关于GSDMB和GSDMD对SKCM免疫微环境影响的具体机制仍有待研究。
本研究表明,在SKCM患者中GSDMB和GSDMD高表达与较高的免疫浸润细胞水平和总生存率相关。GSDMB和GSDMD有望成为SKCM免疫细胞浸润和預后相关的生物学标志物。本研究结果为进一步研究GSDMB和GSDMD在SKCM中的作用和临床应用价值提供了一定的理论基础。值得注意的是,本研究的结果是基于公共数据库进行挖掘分析得出的,需要进一步的研究证实。
参考文献(References):
[1] SCHADENDORF D, VAN AKKOOI A C J, BERKING C, et al. Melanoma [J]. Lancet, 2018, 392(10151): 971-984.
[2] FECHER L A, CUMMINGS S D, KEEFE M J, et al. Toward a molecular classification of melanoma [J]. Journal of Clinical Oncology, 2007, 25(12): 1606-1620.
[3] TAMURA M, SHIROISHI T. GSDM family genes meet autophagy [J]. Biochemical Journal, 2015, 469(2): e5-e7.
[4] LIU X, XIA S, ZHANG Z, et al. Channelling inflammation: gasdermins in physiology and disease [J]. Nature Reviews Drug Discovery, 2021, 20(5): 384-405.
[5] ZHANG Z, ZHANG H, LI D, et al. Caspase-3-mediated GSDME induced pyroptosis in breast cancer cells through the ROS/JNK signalling pathway [J]. Journal of Cellular and Molecular Medicine, 2021, 25(17): 8159-8168.
[6] WANG W J, CHEN D, JIANG M Z, et al. Downregulation of gasdermin D promotes gastric cancer proliferation by regulating cell cycle-related proteins [J]. Journal of Digestive Diseases, 2018, 19(2): 74-83.
[7] BERKEL C, CACAN E. Differential expression and copy number variation of gasdermin (GSDM) family members, pore-forming proteins in pyroptosis, in normal and malignant serous ovarian tissue [J]. Inflammation, 2021, 44(6): 2203-2216.
[8] TANG Z, LI C, KANG B, et al. GEPIA: a web server for cancer and normal gene expression profiling and interactive analyses [J]. Nucleic Acids Research, 2017, 45(W1): W98-W102.
[9] CERAMI E, GAO J, DOGRUSOZ U, et al. The cBio cancer genomics portal: an open platform for exploring multidimensional cancer genomics data [J]. Cancer Discovery, 2012, 2(5): 401-404.
[10] LI T, FU J, ZENG Z, et al. TIMER2.0 for analysis of tumor-infiltrating immune cells [J]. Nucleic Acids Research, 2020, 48(W1): W509-W514.
[11] SUCHANSKI J, GRZEGRZOLKA J, OWCZAREK T, et al. Sulfatide decreases the resistance to stress-induced apoptosis and increases P-selectin-mediated adhesion: a two-edged sword in breast cancer progression [J]. Breast Cancer Research, 2018, 20(1): 133.
[12] MERTEN M, BEYTHIEN C, GUTENSOHN K, et al. Sulfatides activate platelets through P-selectin and enhance platelet and platelet-leukocyte aggregation [J]. Arteriosclerosis Thrombosis and Vascular Biology, 2005, 25(1): 258-263.
[13] GARCIA J, CALLEWAERT N, BORSIG L. P-selectin mediates metastatic progression through binding to sulfatides on tumor cells [J]. Glycobiology, 2007, 17(2): 185-196.
[14] LUTKOWSKA A, ROSZAK A, LIANERI M, et al. Analysis of rs8067378 polymorphism in the risk of uterine cervical cancer from a polish population and its impact on gasdermin B expression [J]. Molecular Diagnosis Therapy, 2017, 21(2): 199-207.
[15] FENG S, FOX D, MAN S M. Mechanisms of gasdermin family members in inflammasome signaling and cell death [J]. Journal of Molecular Biology, 2018, 430(18 Pt B): 3068-3080.
[16] KOMIYAMA H, AOKI A, TANAKA S, et al. Alu-derived cis-element regulates tumorigenesis-dependent gastric expression of GASDERMIN B (GSDMB) [J]. Genes Genetic Systems, 2010, 85(1): 75-83.
[17] CHEN S, MEI S, LUO Y, et al. Gasdermin family: a promising therapeutic target for stroke [J]. Translational Stroke Research, 2018, 9(6): 555-563.
[18] QIU S, LIU J, XING F. ‘Hints in the killer protein gasdermin D: unveiling the secrets of gasdermins driving cell death [J]. Cell Death Differentiation, 2017, 24(4): 588-596.
[19] RAJABI P, BAGHERI M, HANI M. Expression of estrogen receptor alpha in malignant melanoma [J]. Advanced Biomedical Research, 2017, 6: 14.
[20] BERK-KRAUSS J, BIEBER A K, CRISCITO M C, et al. Melanoma risk after in vitro fertilization: a review of the literature [J]. Journal of the American Academy of Dermatology, 2018, 79(6): 1133-1140.
[21] LIU M, DU Y, LI H, et al. Cyanidin-3-O-glucoside pharmacologically inhibits tumorigenesis via estrogen receptor beta in melanoma mice [J]. Frontiers in Oncology, 2019, 9: 1110.
[22] BINNEWIES M, ROBERTS E W, KERSTEN K, et al. Understanding the tumor immune microenvironment (TIME) for effective therapy [J]. Nature Medicine, 2018, 24(5): 541-550.
[23] XIE F, ZHOU X, FANG M, et al. Extracellular vesicles in cancer immune microenvironment and cancer immunotherapy [J]. Advanced Science, 2019, 6(24): 1901779.
[24] VARN F S, WANG Y, MULLINS D W, et al. Systematic pan-cancer analysis reveals immune cell interactions in the tumor microenvironment [J]. Cancer Research, 2017, 77(6): 1271-1282.
[25] AZIMI F, SCOLYER R A, RUMCHEVA P, et al. Tumor-infiltrating lymphocyte grade is an independent predictor of sentinel lymph node status and survival in patients with cutaneous melanoma [J]. Journal of Clinical Oncology, 2012, 30(21): 2678-2683.

