可溶性髓样细胞触发受体-1和白介素-10在烧伤脓毒血症诊断中的应用价值
赵威云 胡小倩
脓毒血症是指起因于感染,发病率普遍较高的全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS)。随着人口的迅速增长,其病死率逐渐升高,甚至高达55%。脓毒血症是由感染引起的,发生后其发生发展遵循其自身的病理过程和规律。究其根本,机体对感染性因素的反应最终导致了脓毒血症。严重烧伤患者由于创面的存在、内源性感染、免疫功能低下及炎性反应失控等因素极其容易引起脓毒血症、败血症、感染性休克等对机体造成严重后果的并发症,最终导致死亡[1]。有文献报道,严重烧伤感染患者中,脓毒血症发生率非常高,大约占44%,是最主要的死亡原因[2]。目前,临床脓毒血症早期诊断多依靠炎性指标和特异性临床症状,尚不能对脓毒血症造成的严重后果甚至于死亡风险进行有效的早期预判,延误了早期的有效干预。因此,寻找有效的生物学标记对早期诊断烧伤患者脓毒血症及判断预后具有重要意义。本研究回顾性分析邢台市人民医院150 例烧伤脓毒血症患者可溶性髓样细胞触发受体-1(soluble myeloid cell trigger receptor-1,sTREM-1)及白介素-10(Interleukin -10,IL-10)水平,探讨早期诊断上述两项检查指标的价值,判断两者与病情发展之间的联系。
1 资料与方法
1.1 一般资料
选取2019 年10 月—2022 年8 月邢台市人民医院烧伤科收治的150 例脓毒血症患者为观察组。纳入标准:(1)烧伤脓毒血症的诊断标准按照《烧伤感染的诊断标准与治疗指南》进行判断,符合者纳入[3]。(2)经临床检查及病原学检验均为确诊病例。(3)年龄18 ~65 岁。(4)致伤源明确,为热水或火焰。(5)平均烧伤面积超过30%。排除标准:(1)合并严重的心、肝、肺及肾功能不全。(2)凝血功能减退,恶性肿瘤的发生。(3)怀孕和哺乳妇女。(4)临床一般资料不全者。其中男性77 例,女性73 例,年龄18 ~65 岁,平均(37.25±6.33)岁。对照组选择同时期的健康体检者150 例。其中男性75 例,女性75例,年龄20 ~68 岁,平均(38.72±6.15)岁。两组年龄、性别等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。
1.2 方法
分别采集对照组体检当天的空腹静脉血5 mL,并于第1、3、5、7 天采集入院后的烧伤脓毒血症患者的空腹静脉血5 m L,室温条件下静置3 0 m i n,3 000 r/min 离心15 min,取离心后上清液,于-80 ℃冰箱中保存,待测。采用定量酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA) 检 测 对 照 组 及观察组血清中的sTREM-1 水平(试剂采购于上海沪峰生物科技有限公司,酶标仪为美国Bio Rad 公司产品)。同时采集3 mL 抗凝静脉血用于IL-10 检测(试剂采购于赛基生物技术有限公司,流式细胞仪型号为BeckmanCoulter-FC500)。按照仪器标准化流程及试剂盒说明书实施检测步骤的操作。
1.3 观察指标
(1)比较两组第1、3、5、7 天sTREM-1 和IL-10 水平。(2)根据烧伤脓毒血症患者治疗28 d 疾病转归情况分为恶化组和好转组。恶化标准:患者死亡或者无明显好转。比较两组患者第1、3、5、7 天sTREM-1 和IL-10 水平,来分析sTREM-1 和IL-10 水平对患者预后的影响。
1.4 统计学方法
采用SPSS 21.0 统计软件进行数据的统计学分析,计量资料用(±s)表示,采用t检验;利用Spearman 相关分析分析sTREM-1 和IL-10 水平与患者预后的关系。P<0.05为差异有统计学意义。
2 结果
2.1 观察组与对照组两组患者不同时间血清中sTREM-1 水平比较
观察组第1、3、5、7 天血清sTREM-1 水平均较对照组显著升高,且两组比较差异有统计学意义(P<0.05)。见表1。
表1 两组患者血清sTREM-1 水平比较(ng/L,±s)
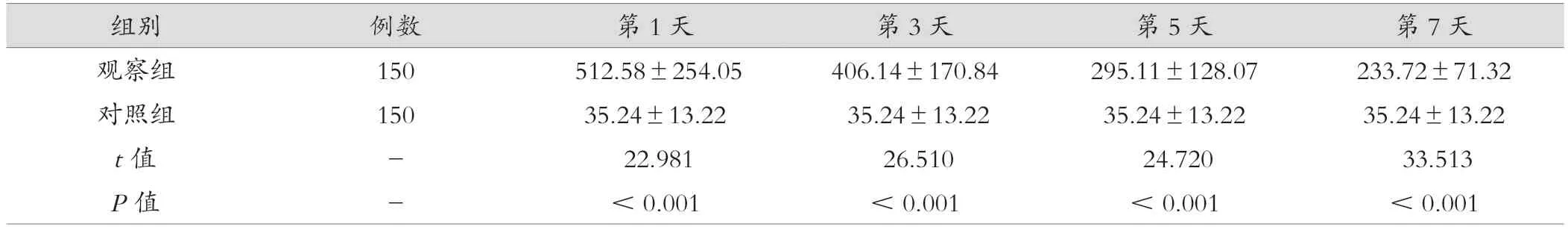
表1 两组患者血清sTREM-1 水平比较(ng/L,±s)
组别 例数 第1 天 第3 天 第5 天 第7 天观察组 150 512.58±254.05 406.14±170.84 295.11±128.07 233.72±71.32对照组 150 35.24±13.22 35.24±13.22 35.24±13.22 35.24±13.22 t 值 - 22.981 26.510 24.720 33.513 P 值 - <0.001 <0.001 <0.001 <0.001
2.2 两组患者不同时间IL-10 水平比较
观察组第1、3、5、7 天内的IL-10 水平均较对照组显著升高,两组比较差异有统计学意义(P<0.05)。见表2。
表2 观察组、对照组患者IL-10 水平比较(pg/mL,±s)
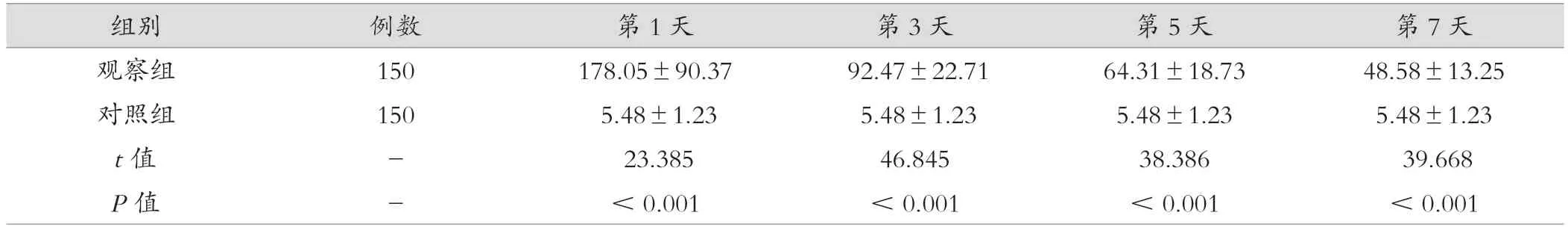
表2 观察组、对照组患者IL-10 水平比较(pg/mL,±s)
组别 例数 第1 天 第3 天 第5 天 第7 天观察组 150 178.05±90.37 92.47±22.71 64.31±18.73 48.58±13.25对照组 150 5.48±1.23 5.48±1.23 5.48±1.23 5.48±1.23 t 值 - 23.385 46.845 38.386 39.668 P 值 - <0.001 <0.001 <0.001 <0.001
2.3 sTREM-1 表达水平与烧伤脓毒血症患者的预后关系
恶化组血清第1、3、5、7 天sTREM-1 水平较好转组明显偏高,两组之间的比较差异有统计学意义(P<0.05)。见表3。
表3 血清sTREM-1 表达水平与烧伤脓毒血症患者病情发展及预后的关系(ng/L,±s)
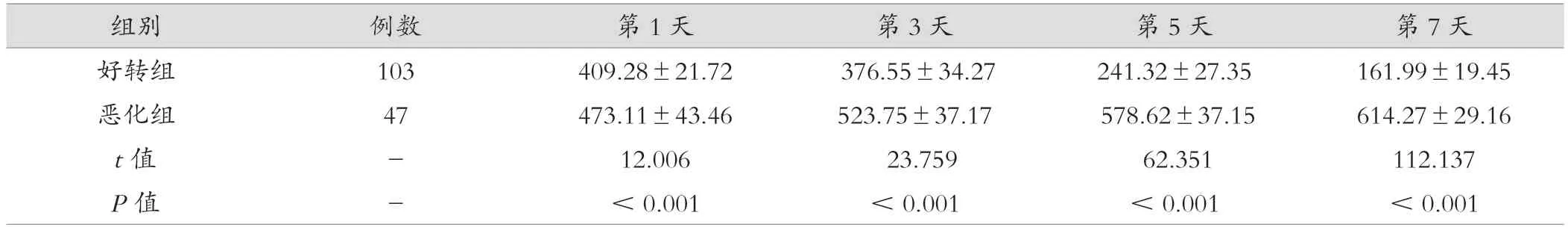
表3 血清sTREM-1 表达水平与烧伤脓毒血症患者病情发展及预后的关系(ng/L,±s)
组别 例数 第1 天 第3 天 第5 天 第7 天好转组 103 409.28±21.72 376.55±34.27 241.32±27.35 161.99±19.45恶化组 47 473.11±43.46 523.75±37.17 578.62±37.15 614.27±29.16 t 值 - 12.006 23.759 62.351 112.137 P 值 - <0.001 <0.001 <0.001 <0.001
2.4 IL-10 表达水平与烧伤脓毒血症患者的预后关系
恶化组血清第3、5、7 天IL-10 水平较好转组明显提高,两组相比差异有统计学意义(P<0.05)。见表4。
表4 IL-10 表达水平与烧伤脓毒血症患者病情发展及预后的关系(mg/L,±s)
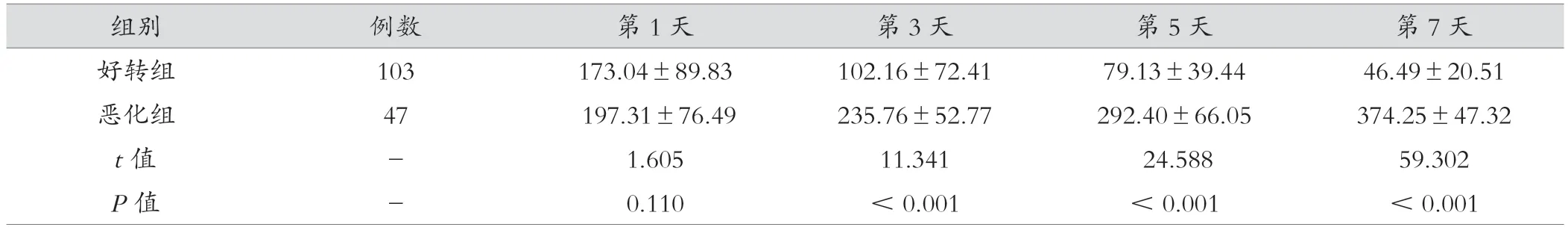
表4 IL-10 表达水平与烧伤脓毒血症患者病情发展及预后的关系(mg/L,±s)
组别 例数 第1 天 第3 天 第5 天 第7 天好转组 103 173.04±89.83 102.16±72.41 79.13±39.44 46.49±20.51恶化组 47 197.31±76.49 235.76±52.77 292.40±66.05 374.25±47.32 t 值 - 1.605 11.341 24.588 59.302 P 值 - 0.110 <0.001 <0.001 <0.001
2.5 烧伤脓毒血症组患者sTREM-1 和IL-10 水平与患者预后的相关性分析
根据烧伤脓毒血症患者治疗28 d 疾病转归情况分为恶化组和好转组,比较并分析不同时间点的两组病患血清中sTREM-1 和IL-10 的浓度。结果显示,烧伤脓毒血症组患者血清sTREM-1 总体水平与患者预后呈正相关(r=0.487 ,P=0.025);烧伤脓毒血症组患者IL-10 水平与患者预后呈正相关(r=0.529,P=0.008)。
3 讨论
烧伤患者特别是重度烧伤,其机体的免疫系统紊乱、抗炎系统异常是由于患者皮肤损伤面积较大,大量的炎性递质由机体产生,内毒素与致病菌的作用再度叠加,最终引发脓毒血症[4-5]。脓毒血症其发生发展过程中有多种炎症介质参与,是一种较为严重的感染性、多器官损伤疾病,常见于危重症患者,具有高致死率、病情险恶的特点。就临床症状考虑,脓毒血症的临床表现和烧伤后体内发生的SIRS 很相似,因此,仅依据症状很难将二者进行鉴别[6],从而错失最佳治疗时机。血培养是诊断脓毒血症的金标准,但血培养的不足之处是检出阳性率低,而且培养时间较长,因而迫切需要寻找准确、有效的血液学炎症指标用于脓毒血症的早期诊断、指导临床用药。
sTREM-1 是一种新型的炎症激发受体,是免疫球蛋白超家族中的成员,其主要在巨噬细胞、单核细胞和中性粒细胞等髓样细胞膜表面表达,对重要脏器的浸润损伤主要通过其诱导下游趋化因子或者炎症细胞因子的积累;同时加速中性粒细胞、单核细胞等对内脏器官的作用,导致炎症反应过度进行,最终引起免疫损伤导致患者感染性病情的进展[7-8]。sTREM-1 属于炎症介质,主要作用体现在脓毒血症炎症反应的触发、最终启动及增强级联放大的过程中[9]。sTREM-1 在炎症反应的发生和级联放大过程中起重要作用,可以加速脓毒血症的进一步发展。sTREM-1 通过调控炎性因子,并诱导单核细胞、中性粒细胞等细胞分泌促炎因子TNF-α、IFN、IL-6 等的合成与释放;通过细胞凋亡机制和免疫细胞如NF-κB的活化,促进其核内转移,诱导活性氧的产生,参与破坏血管内皮细胞,升高各种炎性因子水平,最终促使脓毒血症进一步发展[10]。有研究表明,血清sTREM-1 水平升高与脓毒血症患者的不良预后存在相关性[11]。本研究结果显示,观察组血清sTREM-1 水平在第1、3、5、7 天均显著高于对照组,恶化组第1、3、5、7 天血清sTREM-1 水平较好转组显著升高;说明烧伤脓毒血症患者血清sTREM-1 水平明显增高,烧伤脓毒血症的病理过程中有血清sTREM-1 参与的可能性;可用其对脓毒血症病情的严重程度进行评估,并可以通过动态监测sTREM-1 变化水平对烧伤脓毒血症病患疾病进展及预后进行预测。
IL-10 是一种在免疫细胞及炎症细胞的生物调节中起重要作用的抗炎因子,主要由Th2 细胞产生,在多种疾病中具有降低炎症反应、拮抗炎性介质的作用,如感染性疾病、自身免疫性疾病等[12]。在T 辅助细胞的帮助下,IL-10 可以通过调节宿主的反应来避免IL-6 的过度表达,同时在抗炎介质过度的情况下也会造成免疫功能的抑制[13]。正常情况下,人体中含有较低水平的IL-10,其可防止机体炎症反应导致的组织损伤。但大量的IL-10 可造成机体持续的免疫抑制,降低机体清除病原体的能力,导致机体受到外界感染的风险增大[14]。依据本次研究数据分析结果,第1、3、5、7 天的观察组病患血清IL-10 水平均显著高于对照组,恶化组第3、5、7 天血清IL-10 水平均较好转组显著提高。有研究指出,IL-10的显著升高会随着病情加重而持续升高,可能的原因是脓毒血症所致血管内皮损伤导致IL-6 失控性释放,破坏了炎症-抗炎因子动态平衡[15]。病毒、细菌等致病菌入侵机体后,机体受到刺激,通过激活大量中性粒细胞、单核细胞及巨噬细胞等来释放炎性因子。同时,炎性因子的级联效应组成复杂的调节网络,导致全身炎症反应综合征在促炎因子水平过高时发生紊乱和失控;严重者,可使严重的炎性反应也发生在离感染灶较远的的重要器官,最终导致多器官功能衰竭[16]。因此,在临床上对脓毒血症患者病情严重程度及预后正确评估方面,IL-10 可发挥相应作用。
Spearman 相关分析显示,烧伤脓毒血症患者血清sTREM-1 及IL-10 总体水平与患者预后均呈正相关。这也说明了上述炎性指标水平越高,患者病情越严重、炎性反应越剧烈;并且随着病情的加重,患者发生失控性爆发性炎性反应可能性越大,预后越差。因此,在临床治疗脓毒血症的过程中,医生应加强患者炎性介质的动态监测,早期诊断、早期治疗。
考虑以上因素,sTREM-1 与IL-10 水平随烧伤脓毒血症患者病情波动而发生变化,可反映早期烧伤脓毒血症患者病情。在烧伤脓毒血症患者病情预后方面,sTREM-1 与IL-10 水平有良好的预示作用,且具有一定的相关性,可以为临床诊断提供一定参考依据。此研究可为烧伤伴脓毒血症患者的早期诊断及治疗相关标准的制定提供临床支持。本研究样本量较少,且观察周期较短,尚需要扩大样本量进一步研究,以获得更加客观的临床依据。

