CircWHSC1调节miR-107/CLOCK轴对卵巢癌细胞增殖、凋亡和顺铂耐药性的影响*
高秀娟,庄新荣,张雅丽,张桂香
(承德医学院附属医院妇科,承德 067000)
卵巢癌(ovarian cancer,OC)是常见的妇科恶性肿瘤之一,复发和转移率高[1]。目前晚期OC患者的标准治疗是细胞减灭术联合以铂类药物为基础的化疗[2]。然而,尽管手术和化学治疗取得了进展,但晚期OC患者的5年生存率仅为35%~40%,这主要是由于顺铂(cisplatin,DDP)耐药的发展[3]。因此,研究DDP耐药相关的分子机制具有重要意义。
微小RNA(microRNAs,miRNA)是由20~25个核苷酸组成的非编码RNA分子,通过与靶基因结合,调控细胞的生长、凋亡和迁移[4]。miR-107是近年来发现的一种新的非编码RNA,可调节癌细胞对化疗药物的敏感性,如miR-107可增强乳腺癌细胞对紫杉醇的敏感性[5],miR-107可逆转胃癌细胞对化疗药物的耐药性[6]。据报道,miR-107表达在OC患者和细胞系中显著降低,其过表达可诱导细胞周期停滞,抑制OC细胞增殖,在OC中充当肿瘤抑制因子[7-8]。生物钟循环输出蛋白(circadian locomotor output cycles kaput,CLOCK)为DDP耐药基因,在多药耐药中发挥重要作用[9]。研究显示,沉默DDP耐药OC细胞中的CLOCK后,DDP处理能显著抑制DDP耐药OC细胞增殖并诱导细胞凋亡[10]。另有报道称,miR-107是一种调节昼夜节律系统的miRNA,CLOCK为miR-107的靶基因,miR-107与CLOCK基因结合导致细胞昼夜节律失调[11]。然而,miR-107可否通过CLOCK调节OC细胞对DDP的敏感性仍有待研究。
大量研究表明,环状RNA (circular RNA,circRNA)影响癌症进展[12-13]。circRNAs调控肿瘤进展的主要方式是充当miRNAs的海绵,进而进一步调控下游mRNAs表达[12]。CircWHSC1是一种新型circRNA,来源于WHSC1基因的外显子反向剪接,在多种癌症的发展中发挥致癌作用。据报道,CircWHSC1在宫颈癌组织和细胞系中表达上调,其高表达与宫颈癌患者的存活率呈负相关[14]。高表达circWHSC1的三阴性乳腺癌患者预后较差,CircWHSC1沉默可减少三阴性乳腺癌细胞在体内的生长,并在体外抑制三阴性乳腺癌细胞的增殖、迁移和侵袭[15]。最近研究显示,CircWHSC1在OC中被上调,充当致癌基因[16],CircWHSC1过表达可加剧OC细胞生长和转移[13],但具体机制尚不完全清楚。生物信息分析显示,CircWHSC1与miR-107存在结合位点。CircWHSC1能否通过调控miR-107/CLOCK轴影响OC细胞增殖、凋亡和DDP耐药性尚不明确。因此,本研究主要探究CircWHSC1对OC细胞增殖、凋亡和DDP耐药性的影响及其作用的分子机制。
1 材料与方法
1.1 细胞来源 人正常卵巢上皮细胞IOSE80、卵巢癌细胞系SKOV3、HO-8910、A2780及卵巢癌DDP耐药株SKOV3/DDP均购自上海烜雅生物公司。
1.2 主要试剂 CircWHSC1小干扰RNA(si-CircWHSC1)及其阴性对照(si-NC)、miR-107模拟物(miR-107 mimic)及其阴性对照(mimic NC)、miR-107抑制物(miR-107 inhibitor)及其阴性对照(inhibitor NC)均购自上海艾博思生物公司;MTT试剂盒购自上海歌凡生物公司;Annexin V-FITC/PI荧光双染细胞凋亡检测试剂盒购自上海富雨生物公司;兔源一抗CLOCK、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、半胱氨酰天冬氨酸特异性蛋白酶-3(caspase-3)、多药耐药基因(multidrug resistance gene,MDR1)、GAPDH及羊抗兔IgG二抗均购自英国Abcam公司。
1.3 实验方法
1.3.1 细胞培养 将IOSE80、SKOV3、HO-8910、A2780、SKOV3/DDP细胞培养在含10%胎牛血清的DMEM培养基中。
1.3.2 qRT-PCR检测细胞中CircWHSC1、miR-107表达 使用TRIzol试剂提取细胞中总RNA。将RNA逆转录为cDNA,以cDNA为模板进行荧光定量PCR反应。U6、GAPDH分别作为miR-107、CircWHSC1的内参,通过2-ΔΔCt法测定基因的相对表达量。引物序列:GAPDH正向5'-TGACTTCAACAGCGACACCCA-3',反向5'-CACCCTGTTGCTGTAGCCAAA-3';CircWHSC1正向5'-CGATGTTAAGCGTCCGGG-3',反向5'-GGAAAGATGATGCGCTGTGT-3';U6正向5'-CTCGCTTCGGCAGCACA-3',反向5'-AACGCTTCACGAATTTGCGT-3';miR-107正向5'-AGCAGCATTGTACAGGGCTATCA-3',反向5'-GCGAGCACAGAATTAATACGAC-3'。
1.3.3 双荧光素酶报告基因实验 构建CircWHSC1野生型质粒(CircWHSC1-WT)和突变型质粒(CircWHSC1-MUT),将CircWHSC1-WT和CircWHSC1-MUT分别与mimic NC或miR-107mimic共转染于SKOV3细胞,48h后检测荧光素酶活性。构建CLOCK野生型质粒(CLOCK-WT)和突变型质粒(CLOCK-MUT),将CLOCK-WT和CLOCK-MUT分别与mimic NC或miR-107mimic共转染于SKOV3细胞,48h后评估荧光素酶活性变化。
1.3.4 细胞分组 取对数生长期SKOV3细胞,将si-NC、si-CircWHSC1、mimic NC、miR-107 mimic、si-CircWHSC1+inhibitor NC、si-CircWHSC1+miR-107 inhibitor分别转染于SKOV3细胞,命名为si-NC组、si-CircWHSC1组、mimic NC组、miR-107 mimic组、si-CircWHSC1+inhibitor NC组、si-CircWHSC1+miR-107 inhibitor组。另取正常培养的SKOV3细胞作为Ct组,转染48h后用于检测SKOV3细胞增殖、凋亡的变化。
取对数生长期SKOV3/DDP细胞,将si-NC、si-CircWHSC1、mimic NC、miR-107 mimic、si-CircWHSC1+inhibitor NC、si-CircWHSC1+miR-107 inhibitor分别转染于SKOV3/DDP细胞48h,加2μg/mL DDP处理24h,命名为DDP+si-NC组、DDP+si-CircWHSC1组、DDP+mimic NC组、DDP+miR-107 mimic组、DDP+si-CircWHSC1+inhibitor NC组、DDP+si-CircWHSC1+miR-107 inhibitor组。另取仅用2μg/mL DDP处理24h的SKOV3/DDP细胞作为DDP组,用于检测SKOV3/DDP细胞DDP耐药性变化。
1.3.5 MTT法检测DDP IC50及细胞活力 将SKOV3、SKOV3/DDP细胞分别按5×103细胞/孔接种于96孔板,分别用1、2、4、8、16、32μg/mL DDP处理24h,每孔中加15μL MTT试剂,孵育4h,弃培养液,每孔加150μL DMSO,酶标仪检测490nm处的OD值,计算细胞活力和DDP IC50值。细胞活力(%)=DDP处理细胞OD490nm/对照细胞OD490nm×100%。
将各组细胞按5×103细胞/孔接种于96孔板,孵育48h,每孔中加15μL MTT试剂,培养4h,弃培养液,每孔加150μL DMSO,酶标仪检测490nm处的OD值,计算细胞增殖抑制率。细胞增殖抑制率(%)=(1-DDP处理的细胞OD490nm/对照细胞OD490nm)×100%。
1.3.6 流式细胞术检测细胞凋亡 将1 × 105个细胞悬浮在100μL结合缓冲液,加5μL FITC Annexin V 和 5μL PI,室温孵育15min,通过流式细胞仪分析细胞凋亡情况。
1.3.7 Western blot法检测CLOCK、PCNA、Bax、Caspase-3、MDR1蛋白表达 用RIPA裂解缓冲液提取细胞总蛋白,将总蛋白经定量、电泳、转膜、封闭,将膜与一抗CLOCK(1∶2000)、PCNA(1∶2000)、Bax(1∶1000)、Caspase-3(1∶1000)、MDR1(1∶2000)、GAPDH(1∶2000)4℃过夜孵育,再与二抗(1∶3000)室温孵育2h。使用ECL试剂观察蛋白质显色情况,并使用Quantity-One软件量化蛋白灰度值。
2 结 果
2.1 CircWHSC1、miR-107、CLOCK蛋白在不同细胞中的表达以及细胞对DDP敏感性的检测 与IOSE80细胞比较,SKOV3、HO-8910、A2780细胞中CircWHSC1、CLOCK蛋白表达升高,miR-107表达降低(P<0.05),且SKOV3细胞中CircWHSC1、CLOCK蛋白表达量最高,miR-107表达量最低,因此,选SKOV3细胞为研究对象。见图1和表1。MTT检测结果显示,与SKOV3细胞比较,SKOV3/DDP细胞的IC50明显升高[(28.41±2.05)μg/mL vs(6.75±0.46)μg/mL,P<0.05],见图2。与SKOV3细胞比较,SKOV3/DDP细胞中CircWHSC1、CLOCK蛋白表达升高,miR-107表达降低(P<0.05),见图1和表1。提示CircWHSC1、miR-107、CLOCK可能与卵巢癌DDP耐药相关。

图1 Western blot法检测细胞中CLOCK蛋白表达
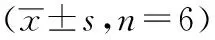
表1 CircWHSC1、miR-107、CLOCK蛋白在>细胞中的表达
2.2 CircWHSC1靶向调控miR-107/CLOCK轴 starbase预测CircWHSC1与miR-107、miR-107与CLOCK的结合位点,见图3。与mimic NC和WHSC1-WT共转染组比较,miR-107 mimic和WHSC1-WT共转染组的荧光素酶活性降低(P<0.05);与mimic NC和WHSC1-MUT共转染组比较,miR-107 mimic和WHSC1-MUT共转染组荧光素酶活性无显著变化(P>0.05)。与mimic NC和CLOCK-WT共转染组比较,miR-107 mimic和CLOCK-WT共转染组的荧光素酶活性降低(P<0.05);与mimic NC和CLOCK-MUT共转染组比较,miR-107 mimic和CLOCK-MUT共转染组荧光素酶活性变化差异无统计学意义(P>0.05),见表2。提示CircWHSC1可能通过靶向miR-107调控CLOCK表达。

图2 DDP对SKOV3细胞和SKOV3/DDP细胞活力的影响

图3 starbase预测CircWHSC1与miR-107、miR-107与CLOCK的结合位点A:starbase预测CircWHSC1与miR-107的结合位点;B:starbase预测miR-107与CLOCK的结合位点
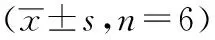
表2 荧光素酶活性比较
2.3 沉默CircWHSC1或过表达miR-107对SKOV3细胞中CircWHSC1、miR-107、CLOCK蛋白表达的影响 与Ct组、si-NC组比较,si-CircWHSC1组CircWHSC1、CLOCK蛋白表达降低,miR-107表达升高(P<0.05);与Ct组、mimic NC组比较,miR-107 mimic组CircWHSC1表达变化差异不显著(P>0.05),CLOCK蛋白表达降低,miR-107表达升高(P<0.05);与si-CircWHSC1组、si-CircWHSC1+inhibitor NC组比较,si-CircWHSC1+miR-107 inhibitor组CircWHSC1表达量变化差异不显著(P>0.05),miR-107表达降低,CLOCK蛋白表达升高(P<0.05),见图4和图5。结果提示沉默CircWHSC1可上调miR-107表达,抑制CLOCK表达。
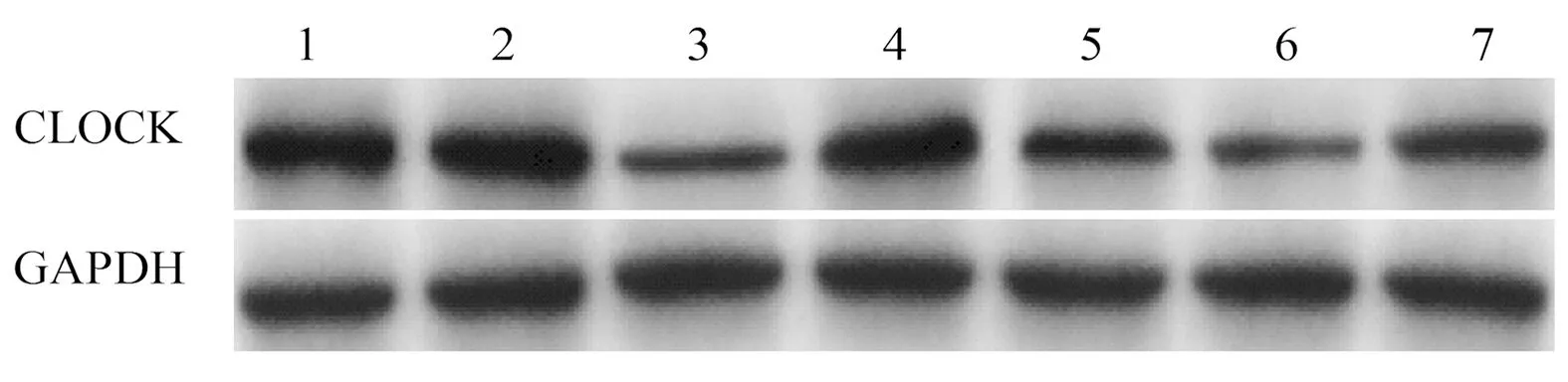
图4 Western blot检测SKOV3细胞中CLOCK蛋白表达1:Ct组;2:si-NC组;3:si-CircWHSC1组;4:mimic NC组;5:miR-107 mimic组;6:si-CircWHSC1+inhibitor NC组;7:si-CircWHSC1+miR-107 inhibitor组
2.4 沉默CircWHSC1或过表达miR-107对SKOV3细胞活力、凋亡的影响 与Ct组、si-NC组比较,si-CircWHSC1组SKOV3细胞增殖抑制率、细胞凋亡率升高(P<0.05);与Ct组、mimic NC组比较,miR-107 mimic组SKOV3细胞增殖抑制率、细胞凋亡率升高(P<0.05);与si-CircWHSC1组、si-CircWHSC1+inhibitor NC组比较,si-CircWHSC1+miR-107 inhibitor组SKOV3细胞增殖抑制率、细胞凋亡率降低(P<0.05),见图6。结果提示沉默CircWHSC1或过表达miR-107可降低SKOV3细胞活力,诱导细胞凋亡。

图5 CircWHSC1、miR-107、CLOCK蛋白在SKOV3细胞中的表达
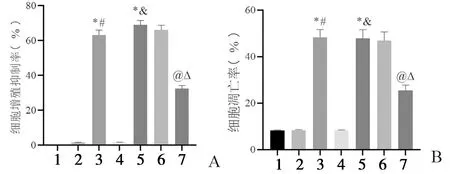
图6 沉默CircWHSC1或过表达miR-107对SKOV3细胞增殖抑制率、细胞凋亡率的影响A:细胞增殖抑制率;B:细胞凋亡;1:Ct组;2:si-NC组;3:si-CircWHSC1组;4:mimic NC组;5:miR-107 mimic组;6:si-CircWHSC1+inhibitor NC组;7:si-CircWHSC1+miR-107 inhibitor组;*P<0.05 vs Ct组;#P<0.05 vs si-NC组; &P<0.05 vs mimic NC组;@P<0.05 vs si-CircWHSC1组;ΔP<0.05 vs si-CircWHSC1+inhibitor NC组;n=6
2.5 沉默CircWHSC1或过表达miR-107对SKOV3细胞中增殖、凋亡相关蛋白表达的影响 与Ct组、si-NC组比较,si-CircWHSC1组SKOV3细胞中PCNA蛋白表达降低,Bax、caspase-3蛋白表达升高(P<0.05);与Ct组、mimic NC组比较,miR-107 mimic组SKOV3细胞中PCNA蛋白表达降低,Bax、caspase-3蛋白表达升高(P<0.05);与si-CircWHSC1组、si-CircWHSC1+inhibitor NC组比较,si-CircWHSC1+miR-107 inhibitor组SKOV3细胞中PCNA蛋白表达升高,Bax、caspase-3蛋白表达降低(P<0.05),见图7。结果提示沉默CircWHSC1或过表达miR-107可降低SKOV3细胞中PCNA蛋白表达,升高Bax、caspase-3蛋白表达。

图7 Western blot检测SKOV3细胞中PCNA、Bax、Caspase-3蛋白表达1:Ct组;2:si-NC组;3:si-CircWHSC1组;4:mimic NC组;5:miR-107 mimic组;6:si-CircWHSC1+inhibitor NC组;7:si-CircWHSC1+miR-107 inhibitor组;*P<0.05 vs Ct组;#P<0.05 vs si-NC组; &P<0.05 vs mimic NC组;@P<0.05 vs si-CircWHSC1组;ΔP<0.05 vs si-CircWHSC1+inhibitor NC组;n=6
2.6 沉默CircWHSC1或过表达miR-107对SKOV3/DDP细胞DDP耐药性的影响 与DDP组、DDP+si-NC组比较,DDP+si-CircWHSC1组SKOV3/DDP细胞增殖抑制率、细胞凋亡率升高(P<0.05);与DDP组、DDP+mimic NC组比较,DDP+miR-107 mimic组SKOV3/DDP细胞增殖抑制率、细胞凋亡率升高(P<0.05);与DDP+si-CircWHSC1组、DDP+si-CircWHSC1+inhibitor NC组比较,DDP+si-CircWHSC1+miR-107 inhibitor组SKOV3/DDP细胞增殖抑制率、细胞凋亡率降低(P<0.05),见图8。结果提示沉默CircWHSC1或过表达miR-107可降低SKOV3/DDP细胞活力,诱导细胞凋亡,增强SKOV3/DDP细胞对DDP的敏感性。
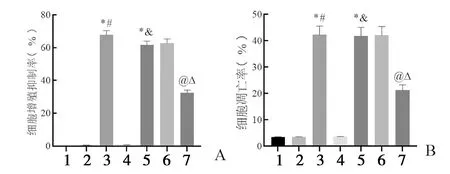
图8 沉默CircWHSC1或过表达miR-107对SKOV3/DDP
2.7 沉默CircWHSC1或过表达miR-107对SKOV3/DDP细胞中CircWHSC1、miR-107、CLOCK蛋白、MDR1蛋白表达的影响 与DDP组、DDP+si-NC组比较,DDP+si-CircWHSC1组CircWHSC1、CLOCK蛋白、MDR1蛋白表达降低,miR-107表达升高(P<0.05);与DDP组、DDP+mimic NC组比较,DDP+miR-107 mimic组CircWHSC1表达变化差异不显著(P>0.05),CLOCK、MDR1蛋白表达降低,miR-107表达升高(P<0.05);与DDP+si-CircWHSC1组、DDP+si-CircWHSC1+inhibitor NC组比较,DDP+si-CircWHSC1+miR-107 inhibitor组CircWHSC1表达量变化差异不显著(P>0.05),miR-107表达降低,CLOCK、MDR1蛋白表达升高(P<0.05),见图9、10。结果提示沉默CircWHSC1或过表达miR-107可降低SKOV3/DDP中CLOCK、MDR1蛋白表达,增强SKOV3/DDP细胞对DDP的敏感性。

图9 CircWHSC1、miR-107、CLOCK蛋白、MDR1蛋白在SKOV3/DDP细胞中的表达A、B:qRT-PCR检测细胞中CircWHSC1、miR-107表达;C、D:Western blot检测细胞中CLOCK、MDR1蛋白表达;1:DDP组;2:DDP+si-NC组;3:DDP+si-CircWHSC1组;4:DDP+mimic NC组;5:DDP+miR-107 mimic组;6:DDP+si-CircWHSC1+inhibitor NC组;7:DDP+si-CircWHSC1+miR-107 inhibitor组;*P<0.05 vs DDP组;#P<0.05 vs DDP+si-NC组;&P<0.05 vs DDP+mimic NC组;@P<0.05 vs DDP+si-CircWHSC1组;ΔP<0.05 vs DDP+si-CircWHSC1+inhibitor NC组;n=6
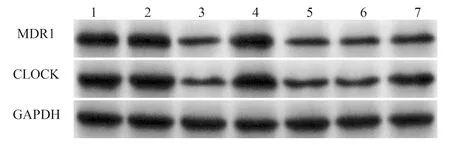
图10 Western blot检测SKOV3/DDP细胞
3 讨 论
多数OC患者确诊时已为晚期,尽管肿瘤细胞减灭术辅以铂类为基础的联合化疗是有效的治疗选择,但OC很少能治愈,最终由于获得性耐药,导致疾病进展。研究表明,CircRNA在OC治疗中发挥重要作用[17]。一些CircRNA与OC细胞恶性生物学行为以及DDP耐药性有关,但仅在其中少数CircRNA中阐明了相应的分子机制。
CircWHSC1是一种新发现的circRNA。据报道,CircWHSC1过表达促进子宫内膜癌细胞的增殖,减少细胞凋亡[18];circWHSC1在乳腺癌组织中上调,过表达circWHSC1可促进乳腺癌细胞增殖[19]。表明circWHSC1在子宫内膜癌、乳腺癌等肿瘤中可促进肿瘤细胞的恶性生物学行为。OC中CircWHSC1呈高表达[16],且在中、低分化OC组织中的表达高于高分化OC组织,过表达circWHSC1可促进OC细胞增殖、迁移和侵袭,并抑制细胞凋亡,沉默circWHSC1则产生相反效果[13]。关于CircWHSC1对肿瘤细胞DDP耐药性的影响尚未见报道。本研究显示,CircWHSC1在OC细胞SKOV3、HO-8910、A2780中高表达,且SKOV3细胞中CircWHSC1表达量最高,降低SKOV3细胞中CircWHSC1表达后,细胞增殖抑制率和凋亡率增加,这与以往研究结果[13]一致。因此,选择SKOV3细胞为研究对象。本研究发现,SKOV3/DDP细胞的IC50及CircWHSC1表达明显高于SKOV3细胞,沉默CircWHSC1可降低SKOV3/DDP细胞的耐药性。同时Western blot结果显示,沉默CircWHSC1可抑制SKOV3细胞中PCNA蛋白表达,促进SKOV3细胞中Bax、caspase-3蛋白表达,并抑制SKOV3/DDP细胞中MDR1蛋白表达,再次证实沉默CircWHSC1抑制SKOV3细胞恶性生物学行为,降低DDP耐药性。
CircRNA可通过海绵化miRNA调控肿瘤进展。本研究通过starbase网站预测发现CircWHSC1与miR-107存在结合位点。研究表明,miR-107 在OC患者组织和细胞系中表达降低,过表达miR-107可抑制OC细胞增殖[8];过表达miR-107促进喉鳞状细胞癌细胞凋亡,并增强细胞对DDP的敏感性[20],表明上调miR-107可抑制OC、喉鳞状细胞癌等肿瘤细胞的恶性生物学行为以及增强细胞对DDP的敏感性。这与本研究结果一致, miR-107在SKOV3和SKOV3/DDP细胞中低表达,且miR-107在SKOV3/DDP细胞中的表达量明显低于SKOV3细胞,上调miR-107可抑制SKOV3细胞增殖,促进细胞凋亡并降低了SKOV3/DDP细胞的耐药性。此外,双荧光素酶报告基因实验证实了CircWHSC1与miR-107存在靶向调控关系,且沉默CircWHSC1可上调SKOV3和SKOV3/DDP细胞中miR-107表达,推测沉默CircWHSC1可能通过上调miR-107表达抑制SKOV3细胞增殖、促进细胞凋亡并降低细胞对DDP的耐药性。为了验证该推测,本研究在沉默CircWHSC1基础上用miR-107 inhibitor干预SKOV3或SKOV3/DDP细胞,结果显示miR-107 inhibitor减弱了沉默CircWHSC1对SKOV3细胞增殖、凋亡以及DDP耐药性的影响,表明CircWHSC1可能通过上调miR-107参与卵巢癌的恶性生物学行为。
miRNA主要通过负向下调基因表达来调节基因功能。为了进一步探究CircWHSC1/miR-107轴对SKOV3细胞增殖、凋亡以及DDP耐药性影响的分子机制,本研究通过生物信息学分析发现miR-107可靶向结合CLOCK。CLOCK为核心生物节律基因,可调控细胞周期[21]。据报道,CLOCK在甲状腺乳头状癌组织中高表达,其高表达与甲状腺乳头状癌的发生、肿瘤的侵袭和转移关系密切[22]。本研究显示,CLOCK蛋白在SKOV3和SKOV3/DDP细胞中高表达,且CLOCK蛋白在SKOV3/DDP细胞中的表达量明显高于SKOV3细胞,沉默CircWHSC1后,SKOV3或SKOV3/DDP细胞中miR-107表达上调,CLOCK表达下调;过表达miR-107后,SKOV3或SKOV3/DDP细胞中CLOCK表达降低;miR-107 inhibitor减弱了沉默CircWHSC1对SKOV3或SKOV3/DDP细胞中CLOCK蛋白表达的抑制作用,且双荧光素酶实验证实了miR-107靶向调控CLOCK表达,表明沉默CircWHSC1可能通过海绵化miR-107下调CLOCK表达,进而抑制SKOV3细胞增殖,促进细胞凋亡,降低细胞对DDP的耐药性。
综上所述,沉默CircWHSC1可能通过海绵化miR-107下调CLOCK表达,进而抑制SKOV3细胞增殖,促进细胞凋亡,降低细胞对DDP的耐药性。CircWHSC1/miR-107/CLOCK轴可能成为治疗OC的新靶点。

