基于miR-124-3p/IL-6信号通路的槲皮素和表儿茶素协同调节炎症相关性结直肠癌研究
张 磊,罗 霄,刘明靓,陈叶梓,袁成福,何毓敏,刘朝奇,周永芹
三峡大学 基础医学院,湖北 宜昌 423000
结直肠癌是消化内科疾病中发病率最高的恶性肿瘤性疾病,近年来其发病年龄越来越趋于年轻化,且发病率逐年稳步上升,且发现晚[1]。慢性炎症已被公认为多种癌症的重要危险因素,癌变发生的各个阶段都受到炎症反应的影响,肠道炎症是已知的结直肠癌危险因素,炎症过程在结直肠癌的发展中起着重要的作用,且患有结肠炎的患者患上结肠癌的风险更高[2-4]。肠道组织中的细胞因子网络是组织稳态和炎症的关键介质,白细胞介素(interleukin,IL)在结直肠癌的发生机制中发挥中介作用[5]。炎症相关性结直肠癌(colitis associated cancer,CAC)是与炎症性肠病(inflammatory bowel disease,IBD)相关的结直肠癌亚型,由长期反复的肠道炎症所引起[6-7]。
氧化偶氮甲烷(azoxymethane,AOM)/葡聚糖硫酸钠(dextran sodium sulfate,DSS)模型是一种可重复性高且相对便宜的CAC 动物模型。AOM 是一种致癌物,它可以通过细胞色素P450(cytochrome P450,CYP)以及同工酶CYP2E1 代谢,转化为甲基苯丙醇,这是一种高活性的烷基化物种,可诱导DNA 产生O6-甲基鸟嘌呤化合物导致G→A 转变[8],在排入胆汁后,可被结肠上皮细胞所吸收并诱发DNA 损伤。DSS 是一种类似肝素的多糖,可对结肠上皮细胞造成损伤,并诱发结肠炎,从而模仿IBD的病理特征[9]。AOM/DSS 模型的主要特点是造模时间短和对CAC 的精确建模,肿瘤的发展可以在短至10 周内发生。此外,AOM/DSS 诱导的肿瘤组织病理学能很好地模拟人类CAC 的发生发展过程,如远端肿瘤及浸润性腺癌[10-13]。
近年的研究表明中医药干预结直肠癌具有一定的效果,也有越来越多的中草药应用于结直肠癌的研究。槲皮素和表儿茶素为常见的类黄酮,二者具有结构相似性,存在多种中药中,具有抗氧化、抗炎及抗肿瘤功效。文献报道槲皮素和表儿茶素联用有很好的协同抗氧化、抗炎等作用[14-17]。本研究旨在通过研究槲皮素和表儿茶素协同作用及机制,以期为临床结直肠患者的用药及治疗提供新方向。
1 材料
1.1 动物
SPF 级C57BL/6 小鼠50 只,雌雄各半,体质量(20±2)g,购自三峡大学实验动物中心,实验动物生产许可证号SCXK(鄂)2017-0012,动物实验伦理审核编号2019010T。动物分笼饲养,温度及湿度适宜,光照条件正常,自由进食饮水,适应性饲养1 周。
1.2 药品与试剂
槲皮素(批号 PCS-220201,质量分数为99.44%)、表儿茶素(批号PCS0077,质量分数为98.94%)购自成都植标化纯生物技术有限公司;AOM(批号0218397180)、DSS(批号0216011090)购自广州威佳科技有限公司;磷酸化信号转导与转录活化因子3(phosphorylated signal transducer and activator of transcription 3,p-STAT3)抗体(批号WLP2412)、IL-6 抗体(批号WL02841)购自沈阳万类生物科技有限公司;β-actin(批号AC026)购自Abclonal 公司;羊抗鼠IgG 二抗(批号115-035-003)购自Jackson Immunoresearch;羊抗兔IgG 二抗(批号152203)购自武汉科瑞生物技术有限公司;Trizol、RT 逆转录试剂盒、SYBR 购自南京诺维赞生物科技有限公司;PCR 引物由上海生物工程(武汉)股份有限公司合成;RIPA 裂解缓冲液(批号G2002)、ECL 化学发光液(批号G2014-50ML)购自Servicebio 公司;蛋白定量试剂盒(批号G2026-200T)、蛋白上样缓冲液购自Solarbio 公司(批号P1040);PVDF 膜(批号R9SA26534)购自MilliPore 公司。
1.3 仪器
ChemiScope series 型全自动凝胶成像分析仪(上海欧翔科学仪器有限公司);1658001 型垂直式蛋白电泳仪器、1703935 型蛋白转印仪器(美国Bio-Rad公司);Biometra TOne 96G 型PCR 仪(德国Analytik JenaAG 公司);qTOWER3G 型qRT-PCR 仪(德国Analytik JenaAG 公司)。DYCP-31DN 型水平电泳槽(北京六一仪器厂);CR21GII型高速离心机(日本日立公司);TS100-F 型显微镜(日本Nikon 公司)。
2 方法
2.1 CAC 小鼠模型的建立、分组及给药
50 只SPF 级C57BL/6 小鼠随机分为对照组、模型组、槲皮素(35 mg/kg)组、表儿茶素(40 mg/kg)组和槲皮素(35 mg/kg)联合表儿茶素(40 mg/kg)组,每组10 只。对照组ip 生理盐水,其余各组小鼠ip AOM(12.5 mg/kg),给予普通饮食饮水5 d 后,给予2.5% DSS 饮用5 d,然后给予普通饮食饮水2周。接下来再重复2 次2.5% DSS 饮水,然后普通饮食饮水喂养至93 d。第1 轮2.5% DSS 饮用结束即第12 天,各给药组开始ig 相应药物,对照组ig等体积生理盐水,直到整个周期结束。
2.2 结直肠形态学观察
造模结束后,用颈椎脱臼法处死小鼠,解剖小鼠,先找到阑尾位置,根据盲肠位置取出全部结直肠组织,用生理盐水清洗干净肠腔的残留物,纵形剖开部分结直肠,观察肿瘤浸润情况,将其放于白色背景下直尺旁拍照。
2.3 结直肠组织苏木素-伊红(HE)染色
取各组小鼠结直肠组织,于4%多聚甲醛中固定,脱水后包埋于石蜡中,切片,进行HE 染色,于显微镜下观察组织病理变化。
2.4 结直肠组织总RNA 提取以及qRT-PCR 检测
按照试剂盒说明书提取结直肠组织中总RNA并合成cDNA,进行qRT-PCR 分析。引物序列见表1,将U6作为miR-124-3P内参,将β-actin 作为Toll 样受体4(Toll-like receptor 4,TLR4)、IL-1β、IL-17、IL-6、血管内皮生长因子(vascular endothelial growth factor,VEGF)和c-myc内参。

表1 引物序列Table 1 Primer sequences
2.5 Western blotting 检测结直肠组织p-STAT3 和IL-6 蛋白表达
取各组小鼠结直肠组织,剪碎后,加入裂解液匀浆提取蛋白,采用BCA 法检测蛋白浓度,加入蛋白上样缓冲液混匀后,100 ℃加热10 min 使蛋白变性。蛋白样品经12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,加入5%脱脂牛奶封闭1 h,分别加入p-STAT3 抗体(1∶1000)、IL-6 抗体(1∶1000)和β-actin 抗体(1∶10 000),4 ℃孵育过夜;次日用TBST 洗膜3 次,每次10 min,加入二抗(1∶8000),孵育1 h,用TBST 洗膜3 次,每次10 min,使用化学发光剂显影进行曝光,以β-actin 作为内参,应用Image J 软件分析条带灰度值。
2.6 生物信息学预测
通过TargetScan 数据库(https://www.targetscan.org/vert_72/)查找miR-124-3p的靶基因,预测miR-124-3p与靶基因IL-6的靶向调节关系[18]。
2.7 统计学分析
使用SPSS 22.0 和GraPhPad Prism 8.0 软件进行统计学分析,每组数据均进行3 次独立重复实验,得到的计量资料以±s表示,采用单因素方差分析及独立样本t检验。
3 结果
3.1 槲皮素联合表儿茶素对CAC 小鼠模型结直肠组织形态学的影响
如图1-A所示,与对照组比较,模型组小鼠结直肠纵面可看出具有大量肿瘤浸润;与模型组比较,单独给药组小鼠结肠纵形剖面肿瘤浸润个数减少,联合给药组结肠无肿瘤浸润。如图1-B所示,与对照组比较,模型组肿瘤数量明显升高(P<0.001);与模型组比较,各给药组肿瘤数量均显著减少(P<0.01、0.001)。如图1-C所示,各给药组小鼠结直肠长度无统计学差异。

图1 槲皮素联合表儿茶素对CAC 小鼠模型结直肠组织形态(A)、肿瘤数量(B)和结肠长度(C)的影响(±s,n = 10)Fig.1 Effects of quercetin combined with epicatechin on colorectal tissue morphology(A),tumor number(B)and colon length(C)in CAC mice model(±s,n = 10)
3.2 槲皮素联合表儿茶素对CAC 小鼠模型结直肠组织病理变化的影响
如图2所示,对照组小鼠肠道黏膜平整,各层组织分界清楚,结构规则,黏膜隐窝结构中可见大量杯状细胞;模型组小鼠结直肠组织结构不规则,没有正常的结构分层,有大量异形细胞浸润,细胞核变大,核深染,腺体结构不规则,杯状细胞减少甚至消失,炎性细胞浸润明显;各给药组结直肠异形细胞少量浸润,炎性细胞较模型组少,肠黏膜结构不完整。

图2 槲皮素联合表儿茶素对CAC 小鼠模型结直肠组织病理变化的影响Fig.2 Effects of quercetin combined with epicatechin on pathological changes of colorectal tissue in CAC mice model
3.3 槲皮素联合表儿茶素对CAC 小鼠模型结直肠组织炎症相关基因表达的影响
如图3所示,与对照组比较,模型组小鼠结直肠组织中TLR4、IL-1β、IL-17、IL-6的mRNA 表达水平均显著升高(P<0.05);与模型组比较,槲皮素组IL-1β和IL-17的mRNA 表达水平均显著降低(P<0.05、0.01),联合给药组和表儿茶素组TLR4、IL-1β、IL-17、IL-6的mRNA 表达水平均显著降低(P<0.05、0.01),且联合给药组较单独给药组作用更为显著。

图3 槲皮素联合表儿茶素对CAC 小鼠模型结直肠组织TLR4、IL-1β、IL-6 和IL-17 mRNA 表达的影响(±s,n = 10)Fig.3 Effects of quercetin combined with epicatechin on TLR4,IL-1β,IL-6 and IL-17 mRNA expressions in colorectal tissue of CAC mice model(±s,n = 10)
3.4 槲皮素联合表儿茶素对CAC 小鼠模型结直肠组织肿瘤相关基因表达的影响
如图4所示,与对照组比较,模型组小鼠结直肠组织中VEGF和c-myc的mRNA 表达水平显著升高(P<0.05);与模型组比较,槲皮素组、联合给药组和表儿茶素组c-myc的mRNA 表达水平显著降低(P<0.05),联合给药组和表儿茶素组VEGF的mRNA 表达水平均显著降低(P<0.05),且联合给药组较单独给药组作用更为显著。

图4 槲皮素联合表儿茶素对CAC 小鼠模型结直肠组织VEGF 和c-myc mRNA 表达的影响(±s,n = 10)Fig.4 Effects of quercetin combined with epicatechin on VEGF and c-myc mRNA expressions in colorectal tissue of CAC mice model(±s,n = 10)
3.5 槲皮素联合表儿茶素对CAC 小鼠模型结直肠组织miR-124-3p/IL-6信号通路的调控作用
为了探究槲皮素和表儿茶素防治CAC 的协同作用是否与结肠组织中miR-124-3p表达相关,通过生物学信息预测miR-124-3p的靶基因,预测的结果提示miR-124-3p可以靶向IL-6的3’-UTR,靶向序列见图5-A。采用qRT-PCR 检测结直肠组织中miR-124-3p的表达,如图5-B所示,与对照组比较,模型组miR-124-3p的表达明显降低(P<0.05);与模型组比较,各给药组miR-124-3p的表达均明显升高(P<0.05)。采用Western blotting 检测结直肠组织中IL-6 和p-STAT3 蛋白表达,如图5-C所示,与对照组比较,模型组IL-6 和p-STAT3 蛋白表达水平均显著升高(P<0.01);与模型组比较,各给药组IL-6蛋白表达水平显著降低(P<0.05、0.01),联合给药组p-STAT3 蛋白表达水平显著降低(P<0.05),且联合给药组较单独给药组作用更为显著。
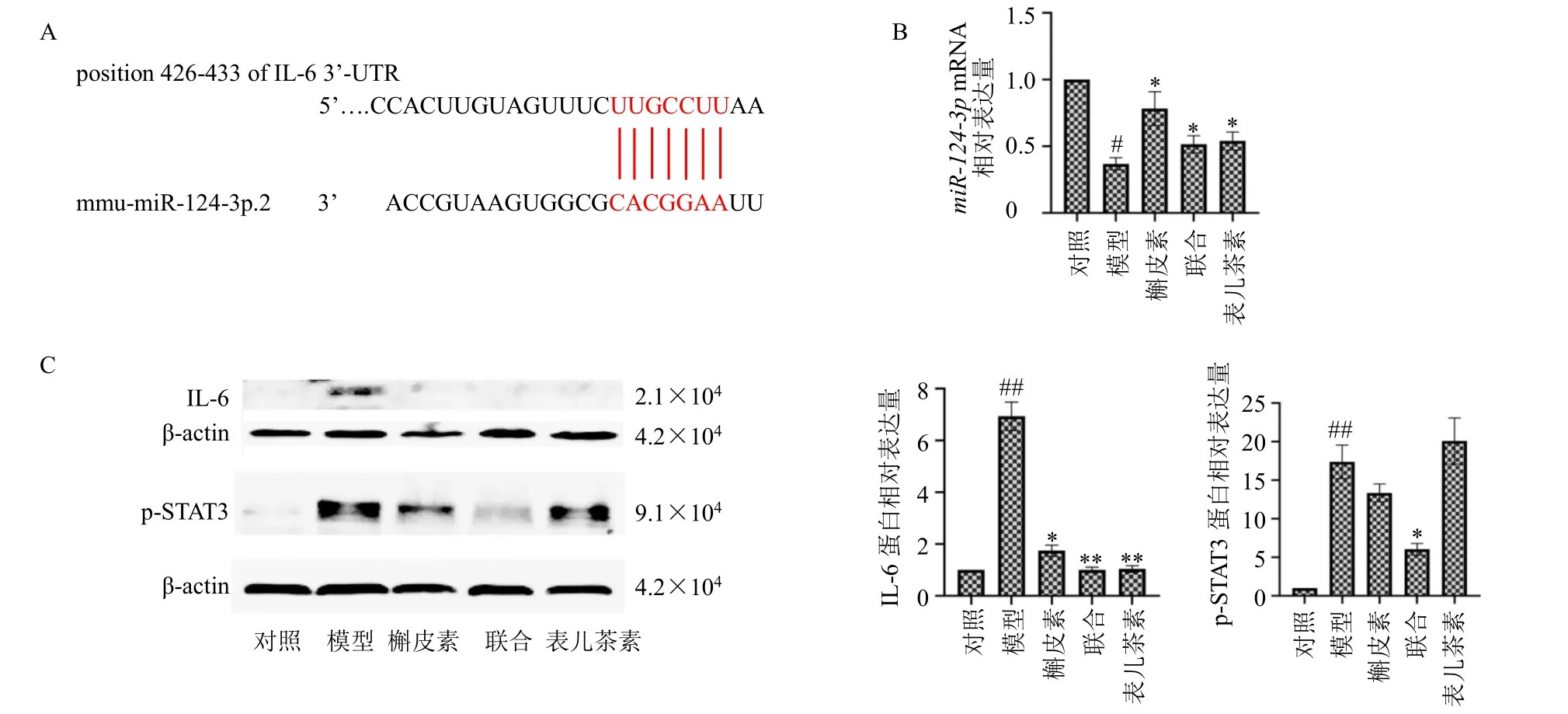
图5 槲皮素联合表儿茶素对CAC 小鼠模型结直肠组织中miR-124-3p/IL-6信号通路的调控作用Fig.5 Regulation of quercetin combined with epicatechin on miR-124-3p/IL-6 signaling pathway in colorectal tissue of CAC mice model
4 讨论
IBD 与结直肠癌的发生发展密切相关,IBD 患者比正常人群高出2~3 倍的风险患结直肠癌,CAC是由长期肠道炎症引起的一种常见结直肠癌,促炎因子和炎性细胞因子可促进其发生发展[19-20]。AOM是一种化学致癌物,AOM 和DSS 的联合作用可诱导炎症和结肠肿瘤的发生,本研究表明,肿瘤相关标志物VEGF、c-myc在AOM/DSS 诱导的CAC 模型小鼠结直肠组织中表达明显升高,提示CAC 模型小鼠肠道已经发生了癌变,而单独给药组和联合给药组结直肠组织中肿瘤相关标志物表达较模型组显著降低,且联合给药组肿瘤标志物降低程度明显低于单独给药组。表明槲皮素和表儿茶素协同作用可以抑制结直肠肿瘤的形成。为了评估肠道炎症反应在癌变过程中的作用,进一步检测炎症相关基因TLR4、IL-1β、IL-17的mRNA 表达水平,以明确槲皮素及表儿茶素的抗肿瘤作用是否与其抑制结直肠道炎症相关。本研究结果显示,与对照组比较,CAC模型小鼠肠道炎症相关因子表达增加;与模型组比较,各给药组炎症因子表达明显减少,且联合给药组炎症因子低于单独给药组。表明槲皮素及表儿茶素可以抑制结直肠道的炎症反应。
IL-6 在结直肠癌的肠上皮细胞中过度表达,在慢性炎症发展为肿瘤疾病的过程中起着关键的作用,可通过作用于下游STAT3 途径参与调控结直肠癌的增殖和转移[21-23]。IL-6 能直接作用于肿瘤细胞,诱导下游STAT3 表达,进而促进肿瘤增殖或存活,STAT3 还可以诱导促进血管生成因子的表达,造成肿瘤侵袭、转移以及免疫抑制[24-25]。miRNA 可以通过特异性mRNA 结合来沉默特异性mRNA,诱导翻译抑制。研究表明,miRNA 在不同类型的癌症中充当抑制肿瘤因子,具有成为癌症的生物标志物以及化疗靶标的潜在用途[26]。miR-124-3p被作为胃癌、肝细胞癌、膀胱癌等肿瘤发生进展的肿瘤抑制因子[27]。研究表明,miR-124-3p通过靶向IL-4Rα 缓解过敏性鼻炎中的炎症反应[28]。本研究通过生物学信息学网站TargetScan 预测,IL-6为miR-124-3p的靶基因,同时通过检测结肠组织中miR-124-3p、IL-6 和p-STAT3 的表达,发现与对照组比较,模型组IL-6、p-STAT3 蛋白表达水平明显增加,miR-124-3pmRNA 表达水平明显降低;与模型组比较,各给药组IL-6、p-STAT3 蛋白表达水平明显降低,miR-124-3pmRNA 表达水平明显升高,且联合给药组较单独给药组作用更为显著。提示槲皮素和表儿茶素协同作用可能通过上调miR-124-3p表达进而抑制结直肠组织中IL-6 和p-STAT3 的表达,抑制结直肠黏膜炎症细胞浸润,减少结直肠道炎症反应,抑制CAC小鼠的疾病进程。
利益冲突所有作者均声明不存在利益冲突

