胸水细胞蜡块在肺腺癌诊断及EGFR/ALK/ROS1基因突变检测中的应用
林日旭,李易达,林义,王芳,蒋磊,李剑敏
1.温州医科大学附属第一医院 病理科,浙江 温州 325015;2.温州医科大学 第二临床医学院,浙江温州 325035;3.温州医科大学附属温岭医院 病理科,浙江 台州 317500;4.温州医科大学附属第一医院 中心实验室,浙江 温州 325015
肺癌是一种多步骤、多因素的疾病,具有多种组织学亚型,是全球新发癌症病例和死亡的主要原因。中国肺癌负担最重,占全球病例的36.98%和死亡人数的39.21%[1]。其中,非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)占肺癌的85%,其中肺腺癌(lung adenocarcinoma,LUAD)占据比例最高。近年来,肺癌的总体病死率已经下降,这种下降主要是驱动基因的靶向治疗显著提高携带相应驱动突变的患者的生存率。表皮生长因子受体(epidermal growth factor receptor,EGFR)、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、ROS1癌基因受体酪氨酸激酶(ROS protooncogene 1 receptor tyrosine kinase,ROS1)是主要驱动突变因子,其突变状态与靶向药物的预后紧密相关,为晚期NSCLC指导治疗和判断预后提供重要指标[2-4]。然而,多数肺癌患者往往在晚期被确诊,但是获取足够的肿瘤组织用于分子诊断是相当困难的,因此寻求有效的替代样本用于分子诊断。恶性胸腔积液(malignant pleural effusion,MPE)被定义为在癌症中排列在肺外部和胸腔壁的薄薄组织层(胸膜)之间的液体,常见于多种恶性肿瘤,包括肺癌、乳腺癌和淋巴瘤,但最常见于肺癌。对于许多NSCLC患者,MPE可以安全且重复地获得,并可作为分子分析的替代标本,特别是晚期和不可切除的NSCLC患者[5-6]。因此,本研究将采用LUAD患者的MPE中分别制成细胞涂片和细胞蜡块,进行病理诊断及基因突变检测,为实时监测疾病进展及靶向治疗提供分子病理学依据。
1 资料和方法
1.1 样本来源 收集2017年1月至2021年12月在温州医科大学附属第一医院经苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色及免疫组化明确诊断为LUAD的胸水标本41例,男23例,女18例,年龄37~93(66.7±13.0)岁。纳入标准:①无法手术或获取组织蜡块的LUAD患者;②具有充足的胸腔积液用于细胞蜡块和细胞HE涂片制作;③可通过医院诊疗系统统计年龄、性别、临床分期、吸烟史等完善临床信息。排除标准:①具有高血压等心血管疾病和其他合并症、脑转移患者;②无配对的MPE细胞蜡块或细胞学HE涂片。所有研究对象的临床病理特征见表1。本研究经温州医科大学附属第一医院临床研究伦理委员会审批(批件号:2022第R071号)。

表1 LUAD患者临床病理特征[n=41,例(%)]
1.2 胸水涂片及细胞蜡块制备 收集LUAD患者胸水,进行常规细胞涂片后HE染色。另将涂片剩余的胸水进行离心(12 000 r/min,5 min),弃上清液后获取胸水细胞沉淀;加入4%中性甲醛溶液静置、固定30 min;弃上清液,细胞倒入擦镜纸并加入不同浓度乙醇进行脱水;将包好细胞的擦镜纸块放入4%中性甲醛溶液固定,制成细胞蜡块,进行切片及HE染色。
1.3 细胞蜡块DNA获取及突变检测方法 准备收集好的胸水细胞涂片样本及细胞蜡块样本,采用核酸DNA/RNA提取试剂盒(厦门艾德生物技术有限公司,ADx-FF03,注册号:闽厦械备20150082号)提取细胞中DNA/RNA,DNA/RNA纯度A60/A280比值在1.8~2.0之间。
胸水细胞涂片经刮片后,提取DNA/RNA后,采用EGFR/ALK/ROS1/BRAF/KRAS/HER2基因突变检测试剂盒(可逆末端终止测序法,南京世和医疗器械有限公司)及基因测序仪(型号:MiSeqDx,美国Illumina公司)进行下一代测序(next-generation sequencing,NGS)检测EGFR/ALK/ROS1基因突变。反应程序:采用DNA探针捕获技术,首先对提取的核酸(DNA)进行片段化、加接头、PCR扩增等步骤制备文库;其后采用具有特定序列的DNA探针与文库进行杂交,从而特异性捕获来自人类基因组6种基因中的部分外显子与内含子区域,之后通过磁珠法富集被探针捕获的目标区域DNA片段。在对捕获富集后的文库进行定量与质控后,采用基因测序仪(型号:MiSeqDx,美国Illumina公司)进行高通量测序。对于测序数据,采用生物信息学软件判读6种靶基因中是否存在来自肿瘤的变异。
胸水细胞蜡块经脱蜡后,提取DNA/RNA后,采用人类EGFR/ALK/ROS1基因突变联合检测试剂盒[突变扩增阻滞法(amplification refractory mutation system,ARMS),厦门艾德生物医药有限公司]及Mx3000P实时荧光定量PCR仪(美国Stratagene公司)进行基因突变检测。反应程序为第一阶段:95 ℃5 min,1 个循环;第二阶段:95 ℃ 25 s,64 ℃20 s,72 ℃ 20 s,15 个循环;第三阶段:93 ℃25 s,60 ℃ 35 s,72 ℃ 20 s,31 个循环,收集FAM及VIC信号,对样本再进行数据分析,根据说明书判读是否存在基因变异。
1.4 预后分析及统计学分析 采用SPSS23.0软件进行统计学分析,计数资料以例和率表示,通过医院电子诊疗系统收集相关临床病理特征信息,通过电话随访得到对应患者的总体生存期(OS)及无进展生存期(PFS)。随访起始时间为2017年1月,终点时间为2021年12月。使用R语言中的“rms”包做预后分析,采用Log-Rank检验比较同一检测方法中突变和未突变两组生存率,使用survminer包画出K-M曲线。P<0.05为差异有统计学意义。
2 结果
2.1 HE染色结果 胸水细胞HE涂片见大量核大深染异型细胞(见图1A),细胞胸水蜡块显示见数团异型细胞(见图1B);胸水细胞HE涂片结果显示,37个阳性,4个阴性,癌细胞鉴定敏感性为90.2%,假阴性率为9.8%;胸水细胞蜡块结果显示,41个阳性,0个阴性,癌细胞鉴定敏感性为100%,假阴性率为0,4个不一致。见表2。

图1 胸水细胞涂片及胸水细胞蜡块癌细胞HE染色结果
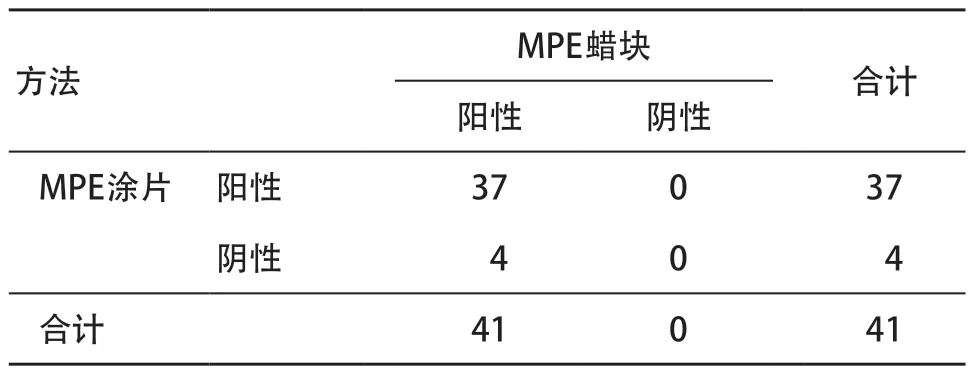
表2 MPE细胞蜡块和细胞涂片癌细胞比较(n=41,例)
2.2 突变检测比较及ARMS检测结果 MPE细胞涂片EGFR突变、ALK及ROS1融合检测结果显示,阳性患者29例,阴性患者12例,突变率为70.7%;MPE细胞蜡块EGFR、ALK及ROS1基因突变检测结果显示,阳性30例,阴性11例,阳性率为73.2%。其中,MPE细胞蜡块样本中有28例EGFR突变,突变率为68.3%(28/41);1例ALK融合,融合基因检出率为2.4%(1/41);2例ROS1融合,融合基因检出率为4.9%(2/41)。MPE细胞涂片样本中有25例EGFR突变,突变率为61.0%(25/41);3例ALK融合,融合基因检出率为7.3%(3/41);6例ROS1融合,融合基因检出率为14.6%(6/41),见表3。
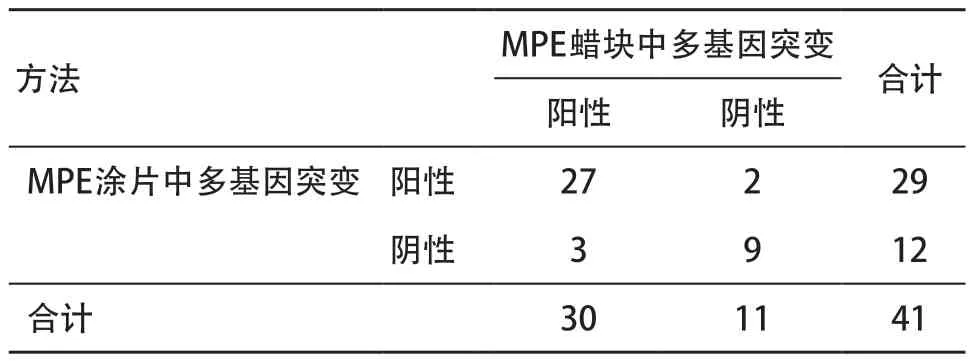
表3 MPE细胞蜡块和涂片中EGFR突变、ALK及ROS1融合状态比较(n=41,例)
2.3 预后比较 41例LUAD患者预后结果显示,相比EGFR/ALK/ROS1未突变阴性患者,胸水细胞涂片及胸水细胞蜡块的EGFR/ALK/ROS1突变阳性患者的总生存率显著增加(HR=0.35,P=0.020;HR=0.11,P<0.001;见图2A、图2B),无进展生存率也显著增加(HR=0.25,P=0.005;HR=0.19,P=0.002;见图2C、图2D)。
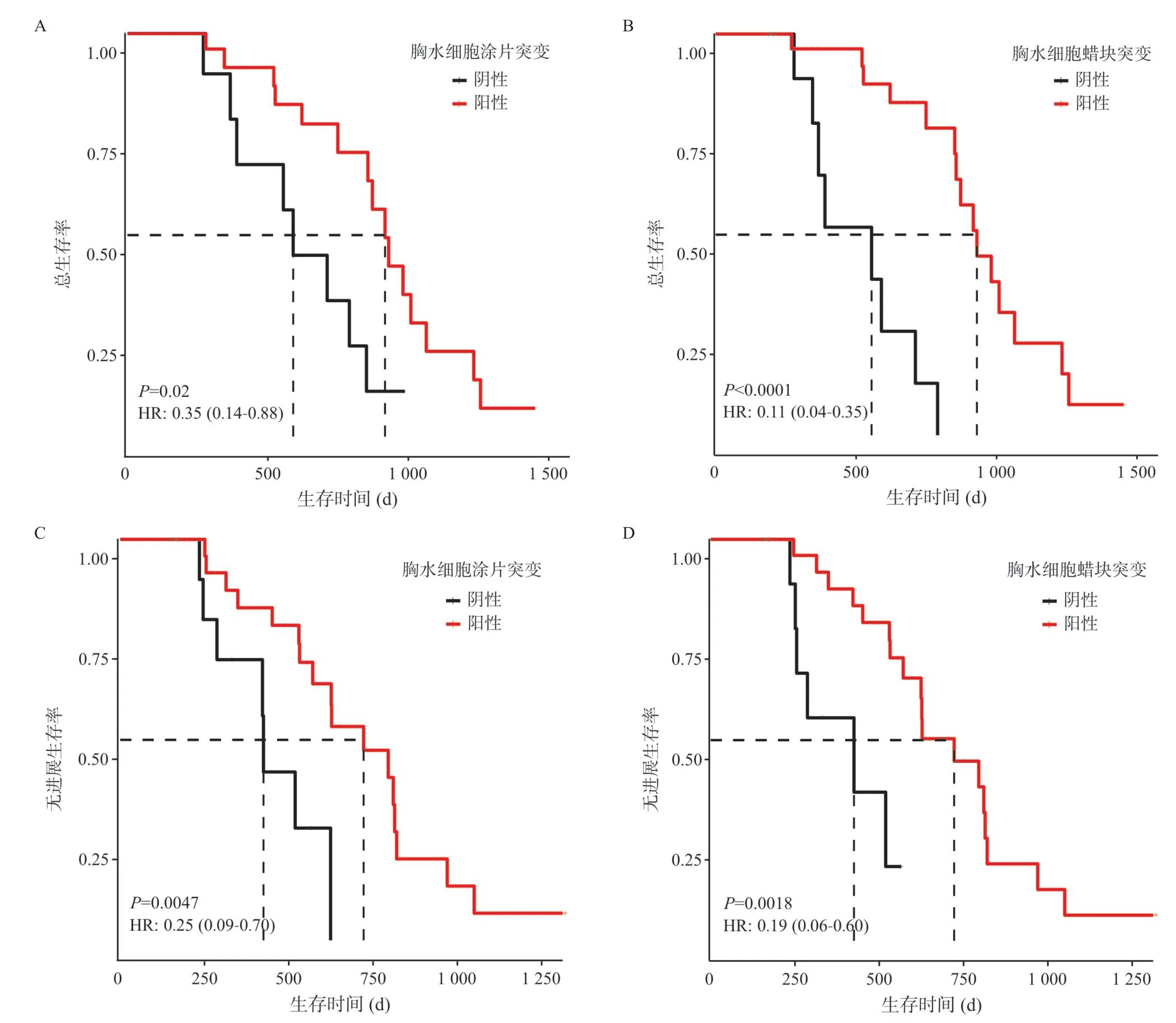
图2 胸水细胞涂片及胸水细胞蜡块中EGFR/ALK/ROS1 突变患者预后比较分析
2.4 治疗效果比较 MPE细胞涂片EGFR/ALK/ROS1突变阳性的29 例患者中,治疗后疾病进展(progressive disease,PD)的患者有15例,部分缓解(partial response,PR)或病变稳定(stable disease,SD)的患者有13例,其余1例未复查CT导致无法评估治疗效果,因此,疾病控制率(disease control rate,DCR)为46.43%(13/28);12例EGFR/ALK/ROS1未突变阴性患者中,PD的患者有5例,PR或SD的患者有4 例,3 例患者无法评估治疗效果,DCR为44.44%(4/9),见表4。

表4 MPE细胞涂片突变状态(n=41,例)
MPE细胞蜡块EGFR/ALK/ROS1突变阳性的30例患者中,治疗后PD的患者有15例,PR或SD的患者有13 例,其余2 例未复查CT导致无法评估治疗效果,因此,DCR为46.43%(13/28);11例EGFR/ALK/ROS1未突变阴性患者中,PD的患者有5例,PR或SD的患者有4例,2例患者无法评估治疗效果,DCR为44.44%(4/9),见表5。

表5 MPE细胞蜡块突变状态(n=41,例)
3 讨论
NSCLC靶向治疗的快速发展使得优化和实施用于分子检测的细胞学标本成为当务之急。多达70%的NSCLC患者被诊断为晚期,通常无法进行组织活检[7]。尽管细胞学样本为分子检测提供了高质量的材料,但分子细胞病理学尚未广为人知或广泛使用。MPE是肿瘤诊断的主要手段,具有更少的侵入性和重复性,部分可在原位灶前被发现,是临床检查中一个潜在的候选者,对于肺癌患者精准诊断、分子检测、预后分析、个性化治疗有非常重要的意义。研究表明,细胞涂片的在常规分子检测方面优于组织活检[7]:①细胞涂片可以风干或在乙醇中固定;②简单、快速现场评估;③DNA易于提取,即使长时间存档也能提供高质量的DNA。然而,细胞涂片不均匀、细胞量较少及背景颜色深容易造成误诊,并且无法进行免疫组化进行复诊。与胸水细胞涂片相比,胸水细胞蜡块切片不仅能提供较多样本且容易保存,可以进行HE染色及免疫组化,对于肿瘤诊断更为准确。本研究结果显示MPE肿瘤细胞蜡块诊断提高了细胞涂片诊断阳性率,应用价值更高,这与之前研究[8]结果类似。因此,如果有足够的MPE可用,肿瘤学家可以尝试细胞蜡块分析。
同时,精准医学的一个重要目标是应用分子分型来为癌症患者提供准确的诊断和个性化的治疗策略。本研究也发现,MPE细胞蜡块EGFR突变率(68.3%)高于涂片EGFR突变率(61.0%),优于之前文献报道的54.5%与55%[8-9];MPE细胞蜡块ALK融合基因检出率(2.4%)和ROS1融合基因检出率(4.9%)分别低于细胞涂片ALK融合基因检出率(7.3%)及ROS1融合基因检出率(14.6%),但是与其他研究相比,ALK融合基因检出率低于之前文献报道的9.1%与11.9%,而ROS1融合基因检出率高于其他文献报道的4.5%与2.6%[9-11],这可能是由于样本量低,肿瘤异质性、检测试剂盒不一样导致的。最后,本研究结果表明,与EGFR/ALK/ROS1未突变LUAD患者相比,MPE细胞涂片与MPE细胞蜡块中EGFR突变、ALK融合与ROS1融合的LUAD患者的总生存率、无进展生存率显著增加,这可能是由于突变患者可以通过靶向治疗获益,这与之前的研究类似:发生融合突变患者比未发生融合的患者具有更好的治疗反应[12]。同时,41例LUAD患者接受治疗后,发现EGFR/ALK/ROS1突变的LUAD患者的DCR较高于未突变的野生型患者,这也是EGFR/ALK/ROS1突变LUAD患者预后更好的原因,与之前研究报道的类似:HER2突变LUAD患者化疗后的DCR均高于HER2野生型患者[13]。因此,本研究也进一步说明化疗或靶向治疗对于EGFR/ALK/ROS1突变LUAD患者具有更大的临床获益。
综上所述,虽然MPE胸水细胞也会存在局限性,但是肿瘤细胞蜡块作为侵入性较小且可重复的替代标本可用于病理诊断及分子检测。

