Cu-ATSM保护内皮细胞糖氧剥夺再灌注损伤的机制
孟伟阳,吴芳芳,金灿,陈大庆
温州医科大学附属第二医院育英儿童医院 急诊医学科,浙江 温州 325203
糖氧剥夺再灌注损伤(oxygen glucose deprivation/reperfusion,OGD/R)是创伤性颅脑损伤进展的重要机制之一。线粒体对于维持细胞生长发育、细胞稳态、维护正常能量代谢、细胞内钙离子稳定起着重要作用。线粒体损伤后内皮细胞的通透性增加、网络结构破坏、ATP产生障碍,随着线粒体膜破裂,凋亡蛋白被释放到胞质中,激活凋亡信号通路导致细胞死亡[1-3]。因此,有效地保护线粒体功能能够减少OGD/R损伤后的内皮细胞凋亡。自噬在细胞生长发育、分化增殖、稳态中起到重要作用。自噬能够清除损伤的细胞器和蛋白质促进内皮细胞存活,且自噬会造成细胞过度的自我消化导致自噬性死亡[4]。研究表明OGD/R损伤后能够导致自噬水平显著上升。PENG等[5]发现抑制ATG3基因能够抑制自噬,减轻OGD/R损伤后脑微血管内皮细胞的损伤,也能减少OGD/R损伤后炎症反应。LI等[6]发现使用雷帕霉素或碳酸锂激活自噬后能够修复OGD/R损伤后脑微血管内皮细胞的屏障。铜-二乙酰-2(N4-甲基氨基硫脲)[copper-diacetyl-2(N4-methylthiosemicarourea),Cu-ATSM],因其能够在缺氧的组织中聚集的特点被作为正电子发射断层显像剂,应用于检测各种缺血性疾病,如心肌缺血、脑卒中、肿瘤等[7-9]。有研究表明Cu-ATSM具有改善帕金森动物模型的运动和认知功能,减少黑质细胞的丢失,增加多巴胺代谢等作用[10],但至今仍鲜见报道其对OGD/R损伤后内皮细胞的保护作用。本研究拟探讨Cu-ATSM对内皮细胞OGD/R损伤后线粒体功能的保护作用及其潜在的分子机制。
1 材料和方法
1.1 细胞处理及分组 人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs,h055,上海Sciencell公司)使用高糖完全培养基(含10% FBS、100 U/mL青霉素和100 U/mL链霉素)37 ℃,5% CO2培养。待细胞密度长至80%~90%时,使用0.02% EDTA的胰酶消化细胞进行铺板后分别按照对照组(Control组),糖氧剥夺再灌注模型组(OGD/R组)、给药组(OGD/R+Cu-ATSM组)进行相应的处理。OGD/R模型是当细胞密度达到70%~80%时将培养基换成HBSS溶液,随后将细胞放置0.2% O2的培养箱中培养24 h,随后复糖复氧12 h。OGD/R+Cu-ATSM组提前2 h给予Cu-ATSM 1 μmol/L,Control组细胞完全培养在37 ℃、5% CO2培养箱36 h,间隔30 min观察细胞形态。
1.2 药品及试剂 Cu-ATSM(68341-09-3)购于上海默克有限公司,CCK-8(C0037)试剂、JC-1(C2006)购于上海碧云天生物技术有限公司,MitoTracker®Red线粒体红色荧光探针(40741ES50)购于上海翊圣生物科技有限公司,ATG5(12994T)、Beclin1(3495T)、LC3I/II(12741T)均购于美国CST公司。
1.3 流式细胞术检测细胞凋亡 将HUVECs(5×105个细胞/孔)铺板于6 孔板中,各组进行相应处理后,使用PBS洗涤,2 000 r/min离心10 min,5 μL V-FITC黑暗中孵育15 min。在流式分析前将5 μL碘化丙啶加入管中。使用BD FACS Calibur流式细胞仪(购于美国BD公司)进行流式细胞术分析,并通过Flowjo软件进行分析。每个样品每次含有3个复孔,实验重复3次。
1.4 线粒体膜电位测定 细胞长满后,按照5×105个细胞/孔的密度将HUVECs悬液加入到共聚焦培养皿中,进行相应的实验处理后加入适量的JC-1染色工作液,37 ℃,孵育20 min,然后用JC-1染色缓冲液(×1)洗涤后加入适量细胞培养基,用荧光显微镜采集相应的图像。各组实验重复3次。
1.5 线粒体形态染色 以5×105个细胞/孔的密度将HUVECs细胞悬液铺到6孔板中,进行相应的处理后,加入含有MitoTracker®Red工作液的新鲜培养基,37 ℃,避光孵育30 min后,PBS清洗,4%多聚甲醛溶液常温固定30 min,PBS清洗,0.2% Triton X-100破膜15 min,PBS清洗,含有DAPI的抗荧光猝灭剂封片,用激光共聚焦显微镜采集相应的图像。各组实验重复3次。
1.6 Western blot检测自噬相关信号通路 提取各组蛋白运用BCA法测定蛋白浓度,配置上样总量为40 μg的蛋白体系,-20 ℃保存。选取12%的凝胶体系进行SDS-PAGE电泳,待溴酚蓝跑至底部时,结束电泳。取出凝胶,PVDF用甲醇活化后,300 mA,90 min进行电转。随后进行5%脱脂牛奶中,室温摇床封闭90 min。4 ℃摇床过夜孵育一抗,随后孵二抗,最后采用曝光机曝光相应的条带,使用Image Lab 5.2分析各自的灰度值。各组实验重复3次。
1.7 细胞荧光检测 以5×105个细胞/孔的密度将HUVECs悬液铺到6孔板中,进行相应的处理后,PBS清洗,4%多聚甲醛溶液常温固定30 min,PBS清洗,0.2% Triton X-100破膜15 min,PBS清洗,5% BSA封闭,37 ℃,30 min,相应一抗4 ℃过夜,PBST清洗,相应二抗37 ℃避光敷育1 h,PBST清洗,含有DAPI的抗荧光猝灭剂封片,用激光共聚焦显微镜采集相应的图像。各组实验重复3次。
1.8 统计学处理方法 采用SPSS21.0统计软件进行统计学处理。计量资料用±s表示,多组间比较用单因素方差分析,组间两两比较用LSD-t法。P<0.05为差异有统计学意义。
2 结果
2.1 各组HUVECs的凋亡情况比较 与Control组比,OGD/R组损伤后HUVECs凋亡细胞数目明显增多,而OGD/R+Cu-ATSM组HUVECs凋亡细胞数目减少,差异均有统计学意义(均P<0.05),见图1。

图1 流式细胞术检测各组HUVECs的凋亡情况
2.2 各组线粒体染色及其膜电位的情况比较Control组线粒体形态以细丝状为主,而OGD/R组损伤后线粒体形态从高度相互连接的细丝状线粒体变成点状,而OGD/R+Cu-ATSM组处理后线粒体重新恢复成线状,比较各组丝状线粒体数量,差异有统计学意义(均P<0.05),见图2。各组HUVECs进行JC-1染色测定膜电位,Control组的线粒体染色以红色为主,提示线粒体为聚集体,OGD/R组损伤后JC-1染色主要以单体(绿色)的形态存在,即Control组的聚集体(红色)转化为单体(绿色),线粒体膜电位下降,提示线粒体损伤;OGD/R+Cu-ATSM组JC-1染色主要以聚集体(红色)的形态存在,即OGD/R组单体(绿色)到聚集体(红色)转化,提示线粒体损伤好转,差异均有统计学意义(均P<0.05),见图3。

图2 Mito-tracker检测各组处理后线粒体染色情况

图3 JC-1检测各组处理后线粒体膜电位情况
2.3 各组自噬相关蛋白的表达情况比较 与Control组比,OGD/R组损伤后HUVECs中的ATG5、Beclin1、LC3II蛋白表达量显著上升,差异有统计学意义(均P<0.05);而OGD/R+Cu-ATSM组治疗后这些蛋白的表达量较OGD/R组显著下降,差异有统计学意义(均P<0.05),见图4A-D。与Control组比,OGD/R组LC3II蛋白表达增多,表现为胞浆处绿色荧光增多,而OGD/R+Cu-ATSM组LC3II蛋白表达减少,胞浆处绿色荧光减少,见图4E。
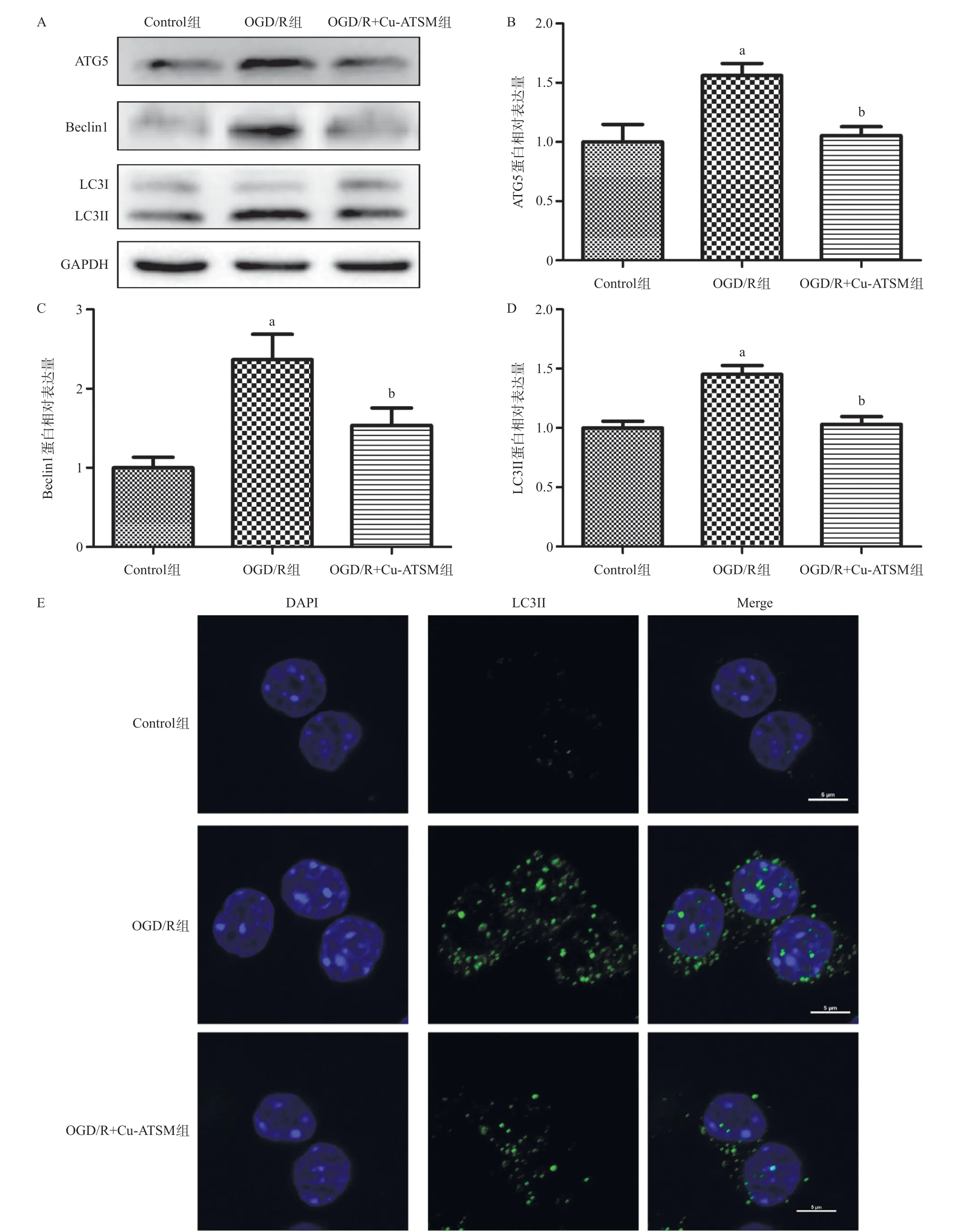
图4 Western blot检测各组处理后ATG5、Beclin1、LC3II的表达情况
3 讨论
脑缺血再灌注损伤是创伤性颅脑损伤的重要发病机制之一[11]。脑微血管内皮细胞在缺血再灌注损伤后细胞间的连接蛋白受到破坏,血脑屏障开放造成有害物质进入脑组织导致继发性损伤[12]。与此同时,有研究表明创伤性颅脑损伤急性期细胞的凋亡数目与患者的神经功能的恢复有关[12]。因此,早期有效抑制内皮细胞凋亡是治疗创伤性颅脑损伤重要手段。本研究采用OGD/R模拟脑缺血再灌注损伤,采用HUVECs模拟血脑屏障中的人脑微血管内皮细胞。
线粒体作为胞内重要的细胞器之一,在能量代谢、电子的传递、细胞稳态起着至关重要的作用[13]。近年来,线粒体功能的研究是缺血再灌注损伤的热点之一。脑缺血再灌注损伤后线粒体功能障碍,线粒体膜电位紊乱,能量产生减少,钙离子超载,活性氧释放等最终都会导致凋亡信号通路激活从而造成细胞的凋亡[14]。因此,保护线粒体功能是减少缺血再灌注损伤后细胞凋亡的重要途径之一。
线粒体功能的紊乱会诱发细胞发生自噬清除受损的细胞器,而OGD/R损伤后自噬水平的升高与神经功能的恢复密切相关[14]。自噬又称为II型程序性细胞死亡,指在饥饿、缺氧、衰老等应激情况下细胞依赖溶酶体降解、选择性清除再循环利用受损或老化的细胞器。越来越多的研究表明自噬在脑损伤中扮演着重要的角色,适度的自噬在一定程度上促进细胞的存活,维持细胞稳态,而过度的自噬会激活TRAIL导致自噬性细胞死亡[15]。研究表明在脑损伤后,神经元中出现典型的自噬性坏死,主要表现为GFP-LC3II和p62免疫荧光的增多[16]。XIE等[17]发现在新生儿小鼠脑损伤模型中,ATG7 基因敲除后,其神经元的凋亡减少。Cu-ATSM最早作为乏氧显像剂,近年来的研究也越来越广泛[8]。YOSHII等[18]研究发现64Cu-ATSM能够抑制U87MG胶质母细胞瘤肿瘤的生长并延长了生存期。HUNG等[10]研究发现Cu-ATSM能够减少ONOO-2诱导损伤的α-突触核蛋白聚集从而改善帕金森模型的认知功能。本研究探讨了Cu-ATSM对OGD/R损伤后HUVECs的作用。
研究发现Cu-ATSM能够通过保护线粒体形态,维持线粒体膜电位,从而减少HUVECs细胞凋亡。Mito-tracker染色结果显示Cu-ATSM能够使OGD/R损伤后的点状线粒体重新恢复成丝带状,JC-1染色结果显示Cu-ATSM能够使得线粒体从OGD/R损伤后的单体到聚集体转化,维持线粒体膜电位。流式细胞结果显示Cu-ATSM能够大大减少OGD/R损伤后的内皮细胞凋亡。由此可见,Cu-ATSM能够通过保护线粒体功能从而减少内皮细胞的凋亡。XU等[19]发现NaHS能够通过抑制PI3K/Akt/mTOR信号通路抑制OGD/R损伤后的自噬水平从而保护线粒体功能稳定。JU等[20]发现葫芦素I能够通过抑制自噬水平的激活减少OGD/R损伤后的氧化应激水平从而减少神经元凋亡。本研究Western blot结果显示Cu-ATSM能够降低OGD/R损伤后自噬相关蛋白如ATG5、Beclin1、LC3II的表达。因此,得出结论Cu-ATSM能够减少OGD/R损伤内皮细胞的凋亡,并且以上作用极有可能是通过抑制损伤后的自噬水平导致的。当然本研究也有很有不足之处,尚未引用自噬激活剂或自噬抑制剂反向验证结果自噬是否为其潜在机制,并未深入讨论氧化应激、炎症、PI3K/Akt通路、Nrf2通路等水平的变化,尚未从动物模型中验证药物的治疗效果等,均有待后续进一步研究。

