原生质体形成及融合因素分析
常玉广,金 露
(南京晓庄学院 环境科学学院,江苏 南京 211171)
在微生物细胞融合技术中,原生质体可以经过溶菌酶处理而制备,在高渗条件下通过聚乙二醇(PEG)促融,使具有不同优良性状的2株菌通过破壁、促融,将2个优良性状集中于一种微生物内[1]。其中原生质体产率是一个重要指标,如何让原生质体再生的细胞,在普通的培养基上生长繁殖也是重要一环,不同微生物的原生质体最适再生条件存在着一定差异。另外,原生质体具有再生成细胞的活力才可以使它的子代进行遗传。测定原生质体形成率和再生率可以作为检验、改善原生质体分离和再生条件的影响因素[2],也是分析融合实验结果、改善融合条件的一个衡量指标。
细胞融合技术不仅为基因调控、遗传互补、肿瘤发生、基因定位、衰老控制等理念领域的研究提供了有力的手段,而且在遗传学、免疫医学以及医药、食品、环保等方面都有广泛的应用价值。从1974年发现的高效融合剂(聚乙二醇)使不同科属的植物原生质体之细胞融合技术开始,PEG在细胞融合领域取得了可喜的成绩,具有重要的实用性意义[3]。本研究在已有的高效絮凝菌研究基础上[4],利用细胞融合技术,期望获得具有更高絮凝能力的新型絮凝菌,以此作为后续絮凝菌絮凝性状的基础研究。
1 实验部分
1.1 实验材料
絮凝菌主要来源于含油废水处理单元曝气池中的水样,芽孢杆菌属(Bacillussp.),两例菌均为哈尔滨工业大学环境生物技术实验室开发[5],菌种生理及生化特征参见文献[6]。
1.2 实验方法
1.2.1 原生质体形成及再生的培养
1.2.1.1 溶菌酶处理前总菌数的测定
挑取青霉素处理后具有抗性单菌落于液体培养基中振荡培养至光密度(OD)值0.3~0.5[7];取活化的菌液0.5 mL,用生理盐水稀释成10-5、10-6、10-7的菌液,各取1 mL稀释液(每个稀释度做3个重复),涂布于完全培养基上,于30 ℃培养24 h,计数溶菌酶处理前的菌数,即为原菌计数。
1.2.1.2 溶菌酶处理后剩余菌数的测定
将溶菌酶处理后的含原生质体悬浮液1 mL,用无菌水稀释,使原生质体裂解死亡,取稀释成10-2、10-3、10-4的菌液各0.1 mL,涂布于完全培养基平板上。于30 ℃培养48 h,计算酶解后未形成原生质体的数量。
1.2.1.3 原生质体再生菌数的测定
双层培养法:先倒高渗再生固体培养基在培养皿底层,取1 mL溶菌酶处理后的含原生质体悬液,用高渗溶液作稀释剂,稀释成10-3、10-4、10-5的菌液各取1 mL,加入底层平板中央,再倒入高渗再生半固体培养基混合。于30 ℃培养48 h,计数原生质体形成数量和未形成原生质体的菌数之和。
1.2.2 原生质体形成率及再生率
将原生质体形成率与再生率作为融合子形成率的衡量尺度,具体计算公式如下:
原生质体形成率=(A-B)/A×100%
(1)
原生质体再生率=(C-B)/(A-B)×100%
(2)
其中:A为溶菌酶处理前的菌数,即为原菌计数;B为未形成原生质体的菌落数;C为形成的原生质体与未形成原生质体的菌数之和[8];A-B原生质体形成数;C-B原生质体再生数。
1.2.3 原生质体的融合时间筛选
取制备好的原生质体,进行原生质体融合实验[9-10],以此来确定原生质体融合PEG的最佳浓度和作用时间。
2 结果与讨论
2.1 溶菌酶处理前总菌数的测定
测定溶菌酶处理前的菌液数量,通过计算原生质体形成率以及再生率,检测菌液的生长活性。因为菌液的活性直接影响制备的原生质体生长活性,同时影响原生质体的再生能力。所以,菌液的活性是原生质体再生的一个重要因素。从表1可知,稀释不同浓度的菌液的细菌总数测定趋于一致,F2菌种的总平均数为1680×105个,F6菌种的总平均数为1835×105个。说明在同一条件下,絮凝菌的生长状况较稳定,有利于在溶菌酶的作用下形成良好的原生质体。
2.2 溶菌酶处理后剩余菌数的测定
细胞通过溶菌酶处理后,存在原生质体和未形成原生质体的细胞。通过对剩余菌落数量的测定,来确定融合处理时的原生质体浓度,剩余细胞数量相对少,则原生质体形成率高,说明溶菌酶的作用效果相对较好。因此,分析溶菌酶处理后剩余菌数,形成原生质体形成率的一个指标,精准判断细胞融合率。由表2可知,溶菌酶处理后的细胞数量相对菌液细胞数量少,F2总平均数为462×102个,F6总平均数为662×102个,表明溶菌酶处理细胞后得到的原生质体细胞数量相对多。鉴于对溶菌酶处理的菌体细胞形态分析,溶菌酶的处理效果较好,因此,以上数据反应了较好的处理效果。
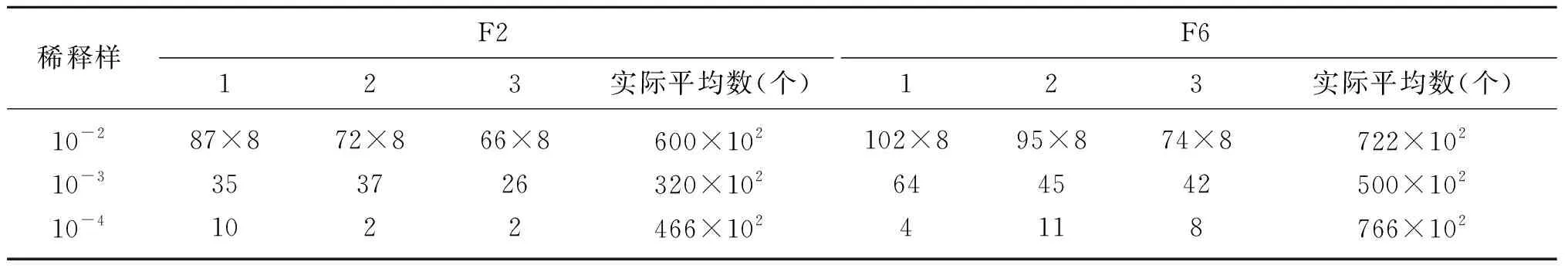
表2 F2和F6溶菌酶处理后剩余细胞总数
2.3 原生质体再生数的测定
将溶菌酶处理后的溶液再经过纯化后的原生质体涂布于再生培养基上,观察发现原生质体再生成菌落的速度相对较慢,一般菌株在30 ℃下培养,需1~2 d能够生长出菌落,而原生质体再生至少需要3~5 d才能长出菌落,一周左右细胞能够成熟,这是原生质体再生过程的延缓现象。
测定原生质体再生数目,是检测细胞活性、原生质体活性、细胞再生能力的重要参考因素,有利于判断在该条件下的原生质体细胞融合的能力。由表3可知,F2的原生质体与未形成原生质体再生总数约为756×103个,F6的原生质体与未形成原生质体再生总数约为756×103个。该数量完全满足细胞融合的需要,也是细胞融合成功的重要前提条件。
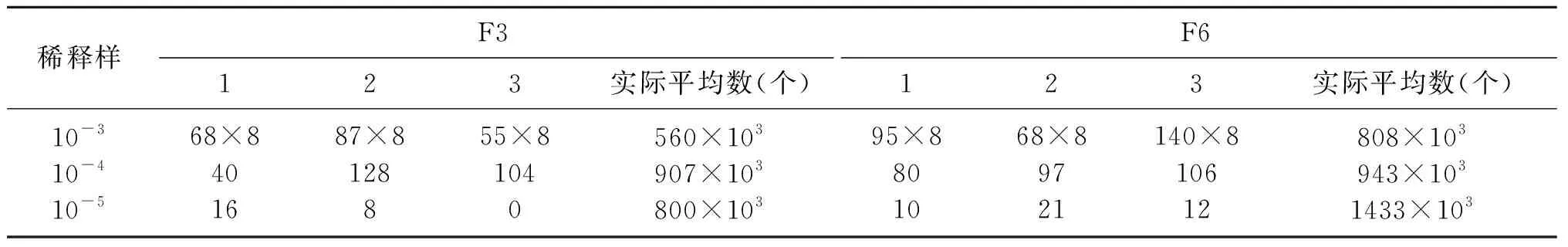
表3 F2和F6的原生质体与未形成原生质体再生总数
根据数据计算可知,F2原生质体的形成率99.97%,F6原生质体形成率99.96%,前期青霉素的预处理效果好,溶菌酶的作用时间与作用量的测定为最佳值[1]。尽管如此,原生质体的再生率相对较低,F2原生质体再生率0.4225%,F6原生质体再生率0.5423%。在本实验中,尽管再生率比率相对低,但再生的细胞数目仍然可观,足够可以进行细胞融合。
2.4 原生质体融合PEG最佳作用浓度和时间
聚乙二醇(PEG)是乙二醇的多聚化合物,存在一系列的不同分子量的多聚体。PEG可与水分子借氢键结合,在高浓度的PEG溶液中自由水消失,导致细胞脱失而发生质膜结构的变化,从而引起细胞融合。为了发挥PEG促进细胞融合效力,必须采用较高浓度(30%~50%,分子量为6000),但PEG在高浓度下,细胞可能因脱水而受到显著的破坏。因此,选择合适的分子质量、浓度及作用时间是PEG融合技术的关键。PEG诱导细胞融合由于具有容易制备和控制、活性稳定、使用方便等特点,在细胞融合领域取得了可喜的成绩,大量研究仍采用此法[11]。
PEG作用的最佳浓度和时间如表4所示。PEG的浓度设置从20%~60%,时间从10~120 min范围,37 ℃条件下反应。由数据显示,在反应10 min时,PEG的浓度为30%和40%融合效果最好,考虑到PEG会引起细胞脱水而受到破坏因素,选择30%浓度为本次实验的最佳值。其次,作用时间对絮凝微生物的原生质体融合具有一定的影响效果,通过显微镜观察,确定PEG最佳作用时间,原生质体在促融剂聚乙二醇作用下促融和,PEG作用时间在20~120 min范围时长出融合子逐渐减少,原因可能是PEG本身有毒性,作用时间过长导致原生质体失活,会影响融合子的生成无法再生,是对细胞有毒害[11]。所以10 min时的促融合效果更好,而且时间短,效率高,是实验的最佳选择。因此,确定了PEG最佳作用时间为10 min。
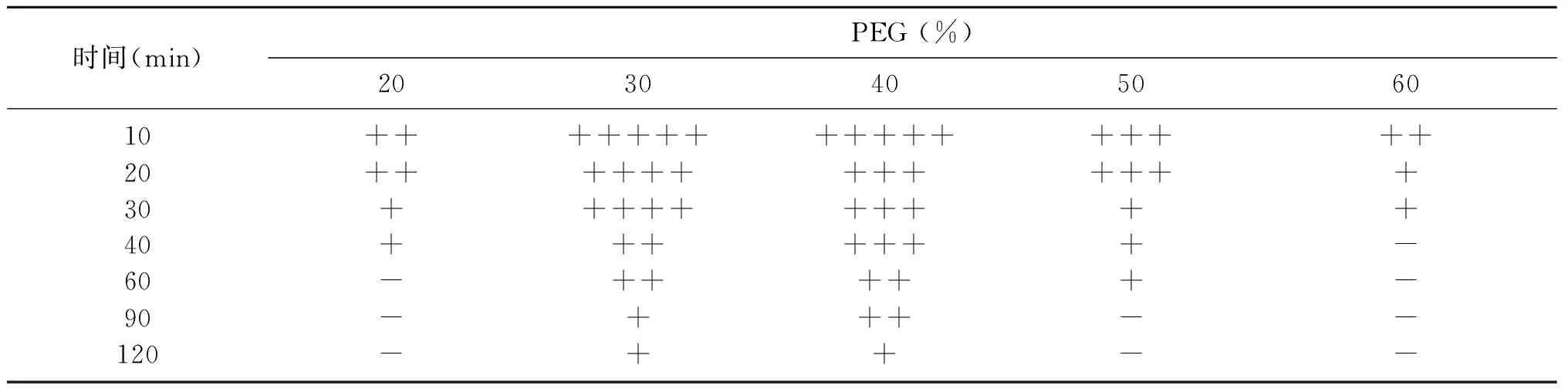
表4 PEG作用浓度和时间的选择试验
3 结 论
通过前期青霉素的预处理、溶菌酶的作用时间与作用量的测定,确定的最佳值得到的原生质体,原生质体的形成率高达99%左右,而原生质体的再生率在0.5%左右,原生质体的再生率相对较低,这种现象在众多的细胞融合实验中是一个很难解决的难题。在本实验中,为了细胞融合达到理想的目标,对原生质体融合PEG最佳浓度和作用时间进行了筛选,PEG最佳浓度是30%,细胞融合的最佳作用时间为10 min。上述实验数据旨在研究絮凝微生物的细胞融合,为改善絮凝微生物在水处理中的絮凝效果,需继续完善细胞融合的研究。

