TBOEP和nano-TiO2联合暴露诱导对土著鲫鱼的复合繁殖毒性效应
赵雪松,黄嘉诚,王琬玥,武 韬,任 新
(吉林师范大学 工程学院, 吉林 四平 136000)
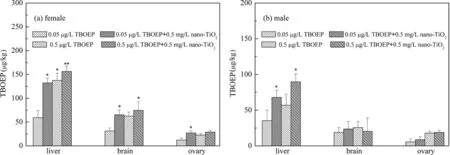
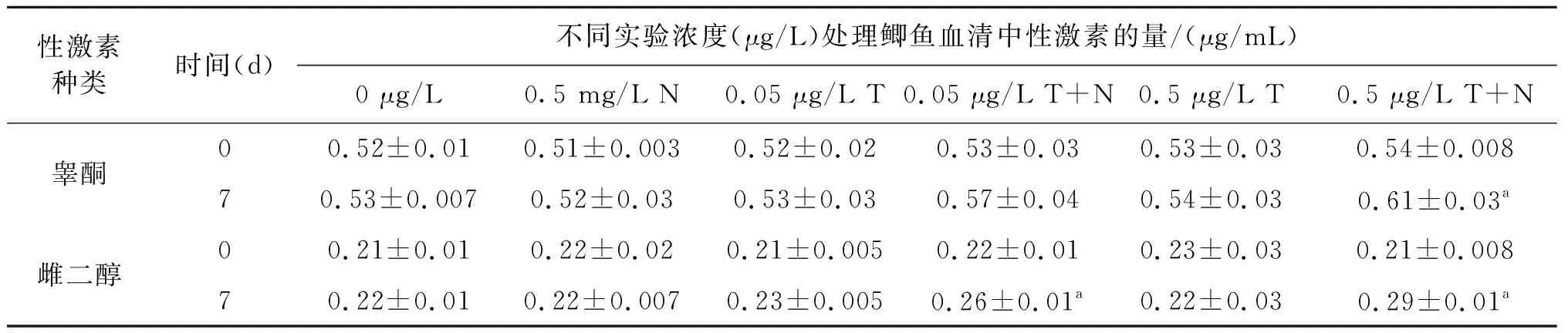
磷酸三-(2-丁氧基)乙酯(TBOEP)一种典型有机磷阻燃剂(OPFRs),在使用过程中TBOEP是以简单的物理方式进行添加,使其极易释放到周围环境中[1,2]。北京地表水TBOEP的浓度为116 ng/L( 吉林省是中国重要的工业基地,加工制造业比较发达,工业门类特色鲜明。在汽车制造、客车制造、电子产业以及石化企业四大支柱产业生产加工中,阻燃剂与纳米材料均占据举足轻重的地位,TBOEP与nano-TiO2在吉林省大量应用势必会造成环境残留,二者在水环境中具有共存的可能性极高。本实验以土著鲫鱼为受试生物来研究通过分析TBOEP单独暴露以及与nano-TiO2联合暴露后幼鱼性激素含量以及下丘脑-垂体-性腺轴(HPG轴)基因表达的变化,建立鲫鱼暴露评价污染物繁殖毒性干扰效应模型,揭示nano-TiO2对TBOEP繁殖毒性影响的机制。本研究具有较高的现实意义,其研究结果将为我省四大支柱产业的生态安全评估与产业的合理布局提供必要的理论依据,同时为完善持久性有毒物质的生物毒理数据库贡献一份力量。 99 %的TBOEP购自Sigma-Aldrich公司,99 %二甲基亚枫(DMSO)购自安耐吉公司,鲫鱼幼苗养殖的培养液用NaHCO3, KCl, MgSO4·7H2O,以及CaCl2·2H2O进行配置,并将10 mg/mL的TBOEP储备液用培养液稀释至0.05 μg/L与0.5 μg/L。90 %的nano-TiO2购自深圳纳米巷有限公司,并用培养液稀释至5 μg/L。 试验用的鲫鱼幼苗购自长春市水产养殖基地,幼苗的体长平均为(12.14±0.87) cm,体质量约为(21.35±3.05) g。实验开始前,将鱼苗驯养一周以上,每天三次投放饵料,养殖液的溶解氧为(5.0±0.98) mg/L,水温控制在(25±5) ℃。暴露实验进行如下:在空白对照组、0.05 μg/L与0.5 μg/L TBOEP暴露组、0.5 mg/L nano-TiO2暴露组以及TBOEP 0.05 μg/L+nano-TiO20.5 mg/L、TBOEP 0.5 μg/L+nano-TiO20.5 mg/L复合暴露组中,每个暴露浓度放置10尾健康活泼的鱼苗,实验设置3组平行实验。暴露实验持续7 d,每天正常投喂三次,更换50 %暴露溶液,并详细记录鱼苗的体态、形态学异常。 鲫鱼和脑、肝脏以及性腺等组织称重后掺入100 ng的d27-TBP作为TBOEP的内标,萃取剂为乙腈。暴露结束后,迅速提取组织样品,匀浆后离心收集上清。反复提取2次后,收集上清液,经氮气吹脱浓缩到1 mL。后经固相萃取,乙腈与甲醇洗脱后,利用液相色谱与质谱连用仪进行定量分析,运行参数详见文献[11]。 鲫鱼血清中性激素睾酮与雌二醇含量采用放射性免疫测定(RIA)方法以γ测定仪进行测定。暴露实验结束后,按照Andrew F. R方法,收集尾静脉的血液样本用于性激素的测定。血清在测定前,需要用二氯甲烷进行萃取(血清与二氯甲烷的体积比为1∶5),结束后将二氯甲烷相取出,挥发去除二氯甲烷后用无水乙醇定容至200 μL。 样品RNA的提取,cDNA合成,荧光定量PCR的方法参见参考文献[12],本实验选定下丘脑、垂体激素相关基因Gnrh2, Gnrh3, Fshβ与Lhβ进行测定,引物序列见表1。 表1 测定基因的引物序列 如图1(a)和(b)可见,TBOEP在鲫鱼体内的累积具有组织差异性,肝脏、脑和性腺器官的蓄积含量逐渐降低。同时,TBOEP的单一暴露组与复合暴露组中,TBOEP在鱼体中累积均存在浓度依赖关系,并且在复合暴露组中TBOEP的累积浓度显著高于单一暴露组,同时雌鱼体内的TBOEP的累积浓度高于雄鱼,其中的原因有可能是由于摄取、代谢、分布 以及清除的能力不同,也可能是由于不同性别对营养需求,摄食行为以及各种生理活动的差异,从而影响了污染物的积累。同时,考虑的TBOEP的相对疏水性,雌性和雄性摄取的差异也可能是由于不同脂质含量引起的。 图1 TBOEP在鲫鱼内累积的组织差异性 (a) 雌鱼;(b) 雄鱼 如表2所示,与空白对照组相比,所有暴露组暴露7 d后的睾酮与雌二醇均高于相同暴露浓度的对照组。 Nano-TiO2暴露组血清中睾酮与雌二醇的含量与对照组没有显著的差别。在TBOEP单独暴露组中,随着TBOEP的暴露浓度从0.05 μg/L增加到0.5 μg/L,睾酮与雌二醇的含量虽然有所增加,但是与对照组相比没有显著的差异。7 d后,在复合暴露组中,0.5 μg/L T+N暴露组睾酮的水平从单一暴露组的0.54±0.03 μg/mL 显著增加至0.61±0.03 μg/mL;0.05 μg/L T+N暴露组雌二醇的水平从单一暴露组的对照组的0.23±0.005 μg/mL显著增加至0.24±0.01 μg/mL,0.5 μg/L T+N暴露组雌二醇的水平从单一暴露组的对照组的0.22±0.03 μg/mL显著增加至0.29±0.01 μg/mL,说明nano-TiO2能够显著增强TBOEP对于鲫鱼性激素的干扰作用,进而加剧TBOEP的生殖毒性。 表2 不同暴露组对鲫鱼性激素水平的影响 本实验测定了HPG关键基因促性腺激素释放激素(Gnrh2和Gnrh3)、卵泡刺激素(Fshβ)以及促黄体激素(Lhβ)相对定量表达。结果如图2所示,0.05 μg/L TBOEP单独暴露组以及0.5 μg/L T+N复合暴露组Gnrh2与Fshβ基因的表达较对照组显著增加;所有暴露组Gnrh3表达虽然较对照组有所增加,但是没有显著差异;Lhβ基因只有在0.05 μg/L T+N以及0.5 μg/L T+N复合暴露组与对照组存在显著差异。复合暴露组Gnrh2、Fshβ与Lhβ基因表达高于单一暴露组。性激素是决定鱼体生殖抑制的重要生物标志物,因为性别激素浓度的变化可能在随后的受精阶段导致生殖功能障碍。促性腺激素释放激素Gnrh2的异常表达必定感染性激素的释放[13]。 同时,在鱼类中,FSH和LH从脑垂体分泌并与其受体结合以刺激类固醇的产生和配子发生。FSH主要控制生长阶段(卵黄发生/精子发生),LH主要控制卵母细胞成熟/精子期[13]。因此,复合暴露组Fshβ与Lhβ异常表达表明,与单一暴露相比,nano-TiO2暴露可能影响卵黄发生和配子发生的进展,导致成年鲫鱼的配子发生和配子成熟功能障碍的恶化。 *p<0.05与**p<0.01表示暴露组与对照组相比差异显著图2 鲫鱼HPG轴基因表达 本研究以土著鲫鱼为受试生物,系统地研究nano-TiO2与TBOEPP复合暴露对鲫鱼生殖系统的影响,研究结果发现TBOEP在鲫鱼体内的累积具有组织差异性,肝脏、脑和性腺器官的蓄积含量逐渐降低,且雌鱼体内的TBOEP的累积浓度高于雄鱼。同时,Nano-TiO2能够显著增强TBOEP对于鲫鱼性激素的扰乱作用,干扰卵黄发生和配子发生,加剧TBOEP的繁殖毒性。1 实验部分
1.1 实验试剂
1.2 暴露实验
1.3 鱼体组织中TBOEP含量的测定
1.4 血清中性激素含量的测定
1.5 基因表达

2 结果与讨论
2.1 Nano-TiO2对TBOEP生物累积的影响
2.2 Nano-TiO2与TBOEP 对鲫鱼性激素水平的影响
2.3 Nano-TiO2与TBOEP对鲫鱼HPG轴基因表达的影响

3 结 论

