circNOLC1靶向miR-485-5p对肝癌细胞紫杉醇耐药性的影响*
刘晓晖 何 勇 符奉川 钟小薇
1.海口市第三人民医院外科 (海南 海口, 571100) 2.海口市第三人民医院检验科
肝癌是常见的恶性肿瘤,其发病率呈增长趋势[1]。紫杉醇是目前较为常用的抗肝癌药物,但长期使用易引起肝癌耐药性,改善肝癌紫杉醇耐药性是当前研究的重要课题。环状RNA(circRNA)和微小RNA(miRNA)是两类非编码RNA,参与调控肿瘤细胞恶性行为及耐药性[2,3]。circNOLC1是近年来新发现的一种circRNA,调控多种肿瘤的发展进程。研究显示,circNOLC1在前列腺癌组织和细胞中过表达,其可通过靶向结合miR-647上调 PAQR4表达促进前列腺癌细胞增殖和迁移,circNOLC1可能是前列腺癌治疗的潜在靶点[4]。circNOLC1在上皮性卵巢癌(EOC)组织中的表达高于正常组织,且其高表达与FIGO分期和肿瘤分化程度密切相关,circNOLC1可能通过结合ESRP1并调节CDK1和RhoA表达来促进EOC的发生和发展[5]。Starbase靶基因在线软件预测显示,circNOLC1可能靶向结合miR-485-5p。研究显示,miR-485-5p在肝癌中表达下调,上调miR-485-5p可削弱肝癌细胞的增殖、侵袭和迁移能力,miR-485-5p可能为肝癌的治疗提供了新靶点[6]。本研究主要观察了circNOLC1和miR-485-5p对紫杉醇耐药肝癌细胞增殖、迁移和侵袭的影响及circNOLC1能否靶向miR-485-5p发挥作用,以期为改善肝癌紫杉醇耐药性提供分子靶点。
1 材料与方法
1.1 细胞和试剂 HCCLM3细胞系购自中国科学院上海细胞库;RNA抽提试剂盒、逆转录试剂盒和PCR试剂盒购自大连宝生物;RPMI 1640培养基、LipofectamineTM 2000试剂盒、Annexin V-FITC/PI试剂盒、BCA蛋白检测试剂盒和双荧光素酶活性检测试剂盒购自北京索莱宝;胎牛血清(FBS)购自杭州四季青;PCR引物、si-circNOLC1、si-NC、miR-485-5p mimics、miR-NC、anti-miR-485-5p、anti-miR-NC及circNOLC1野生型和突变型荧光素酶载体(WT-circNOLC1、MUT-circNOLC1)购自上海生工;蛋白质印迹实验所需抗体购自中国Abcam公司。
1.2 方法
1.2.1 紫杉醇耐药肝癌细胞的建立 用含10% FBS的RPMI 1640培养液培养HCCLM3细胞。参照文献[7]采用浓度梯度间歇刺激法诱导HCCLM3细胞,获得紫杉醇耐药的细胞HCCLM3/Tax。具体方法如下:取对数期HCCLM3细胞,加含0.05 μmol/L紫杉醇和10% FBS的RPMI 1640培养液培养24 h。弃培养液,用磷酸盐缓冲液(PBS)清洗细胞,重新加含10% FBS的RPMI 1640培养液培养24 h,待细胞生长密度至90%时,传代培养。再次用含0.05 μmol/L紫杉醇和10% FBS的RPMI 1640培养液培养24 h,如此反复换液、传代。然后依次用含0.1 、0.15、0.20 μmol/L紫杉醇的培养液干预,每个浓度重复3次,最后获得紫杉醇耐药的人肝癌细胞HCCLM3/Tax。HCCLM3/Tax细胞一直用含低浓度(0.02 μmol/L)紫杉醇的培养液中培养。
1.2.2 紫杉醇对HCCLM3、HCCLM3/Tax的半数抑制浓度 将HCCLM3、HCCLM3/Tax均接种至96孔板中(2.5×104个/孔),分别用含0、0.08、0.16、0.32、0.64、1.28、2.56 μmol/L[7]紫杉醇的培养液培养24 h,加10 μl CCK-8。孵育2 h,酶标仪测光密度(OD)值。细胞增殖抑制率(%)=(OD对照组-OD实验组)/OD对照组×100%。采用GraphPad Prism 7软件计算紫杉醇对HCCLM3、HCCLM3/Tax的半数抑制浓度(IC50值)。
1.2.3 RT-qPCR检测circNOLC1和miR-485-5p表达 将HCCLM3、HCCLM3/Tax均接种至6孔板中(1.0×105个/孔),常规培养液培养24 h后,用RNA抽提试剂盒提取细胞中总RNA,逆转录为cDNA后,行PCR扩增。引物序列:circNOLC1:上游5'-GTACGATAGGCTCGATCGTAC-3',下游5'-CGTCTCTGAGGCTAGCC-3';GAPDH:上游5'-AGAGGCAGGGATGATGTTCTG-3',下游5'-GACTCATGACCACAGTCCAT GC-3′;miR-485-5p:上游5'-CCAAGCTTCACCCATTCCTAACAGGAC-3',下游5'-CGGGATCC GTAGGTCAGTTACATGCATC-3';U6:上游5'-TGCGGGTGCTCGCTTCGGCAGC-3',下游5'-CCAGTGCAGGGTCCGAGGT-3'。2-△△Ct法计算circNOLC1相对GAPDH、miR-485-5p相对U6的表达量。
1.2.4 细胞转染 将HCCLM3/Tax细胞接种至6孔板中(1.0×105个/孔),用含10% FBS的RPMI 1640培养液培养24 h后,弃培养液,换为不含FBS的RPMI 1640培养液。用LipofectamineTM 2000脂质体法,分别转染si-NC、si-circNOLC1、miR-NC、miR-485-5p mimics、共转染si-circNOLC1与anti-miR-NC、si-circNOLC1与anti-miR-485-5p。转染12 h后,弃培养液,重新加含10% FBS的RPMI 1640培养液。培养24 h后,RT-qPCR法检测细胞中circNOLC1或miR-485-5p表达验证转染效果,方法同1.2.3,并收集细胞用于后续实验。
1.2.5 CCK-8法检测细胞增殖抑制率 取96孔板,接种转染si-NC、si-circNOLC1、miR-NC、miR-485-5p mimics、共转染si-circNOLC1与anti-miR-NC、si-circNOLC1与anti-miR-485-5p后的HCCLM3/Tax细胞(2.5×104个/孔),用含0.16 μmol/L紫杉醇的培养液培养24 h,依次标记为Tax+si-NC组、Tax+si-circNOLC1组、Tax+miR-NC组、Tax+miR-485-5p 组、Tax+si-circNOLC1+anti-miR-NC组、Tax+si-circNOLC1+anti-miR-485-5p组。加10 μl CCK-8,孵育2 h,酶标仪测光密度(OD)值。细胞增殖抑制率(%)=(OD对照组-OD实验组)/OD对照组×100%。
1.2.6 克隆形成实验检测细胞克隆形成能力 取6孔板,接种转染后的HCCLM3/Tax细胞(1.0×105个/孔),用含0.16 μmol/L紫杉醇的培养液培养,并按照上述1.2.5标记分组。每2天更换一次培养液,培养10~14 d后,弃培养液。用4%多聚甲醛固定30 min,0.4%结晶紫染色15 min,显微镜观察并统计细胞克隆数。
1.2.7 划痕实验检测细胞迁移 取6孔板,接种转染后的HCCLM3/Tax细胞(1.0×105个/孔),用常规培养液培养12 h后,弃培养液。用200 μl移液器枪头在培养板底部划两条平行线,并PBS除去划痕间细胞,测量划痕间距(d),记为d0 h。然后用含0.16 μmol/L紫杉醇的培养液培养24 h,并按照上述1.2.5标记分组。弃培养液,再次测量细胞间间距,记为d24 h。划痕愈合率(%)=(d0 h-d24 h)/d0 h×100%。
1.2.8 Transwell实验检测细胞侵袭 取6孔板,接种转染后的HCCLM3/Tax细胞(1.0×105个/孔),用含0.16 μmol/L紫杉醇的培养液培养24 h,并按照上述1.2.5标记分组。培养后,收集各组细胞,并调整密度为1.0×105个/ml。将Transwell小室上室铺Matrigel基质胶,自然晾干后,加100 μl各组细胞悬液,另取500 μl培养液加至Transwell下室。培养24 h后,弃培养液,用多聚甲醛固定,结晶紫染色,显微镜观察,随机取5个视野,记数。
1.2.9 蛋白质印迹法检测MMP-2和MMP-9蛋白表达 取6孔板,接种转染后的HCCLM3/Tax细胞(1.0×105个/孔),用含0.16 μmol/L紫杉醇的培养液培养24 h,并按照上述1.2.5标记分组。培养后,用RIPA试剂提取细胞中总蛋白。经BCA法测蛋白浓度、SDS-PAGE电泳、转膜和封闭后,于4℃冰箱中分别用MMP-2(1∶500)、MMP-9(1∶500)和GAPDH(1∶1 000)一抗孵育过夜。洗膜后,再于37℃摇床中用山羊抗兔二抗(1∶2 000)孵育2 h。最后加显影液,避光显影,曝光拍照,Image J软件分析MMP-2、MMP-9相对GAPDH的表达量。
1.2.10 双荧光素酶报告基因实验 取6孔板,接种HCCLM3/Tax细胞(1.0×105个/孔),用含10 % FBS的RPMI 1640培养液培养24 h后,弃培养液,换为不含FBS的RPMI 1640培养液。用LipofectamineTM 2000脂质体法,分别共转染WT-circNOLC1与miR-485-5p mimics或miR-NC、MUT-circNOLC1与miR-485-5p mimic或miR-NC。转染12 h后,更换为含10% FBS的RPMI 1640培养液。再培养24 h,弃培养液。加细胞裂解液,充分裂解后,离心(3 500 r/min、5 min)。取上清液,检测荧光素酶活性,结果以萤火虫与海肾的荧光强度比值表示。

2 结果
2.1 紫杉醇对HCCLM3细胞和HCCLM3/Tax细胞抑制率的影响 紫杉醇对HCCLM3、HCCLM3/Tax细胞的抑制率随着其浓度的增加逐渐升高。与HCCLM3细胞比较,相同浓度的紫杉醇对HCCLM3/Tax细胞的抑制率降低(P<0.05)。紫杉醇对HCCLM3、HCCLM3/Tax细胞的IC50值分别为(0.40±0.06)μmol/L、(2.71±0.37)μmol/L。见表1。
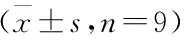
表1 紫杉醇对HCCLM3细胞和HCCLM3/Tax细胞抑制率的影响
2.2 circNOLC1和miR-485-5p在HCCLM3和HCCLM3/Tax细胞中的表达 与HCCLM3细胞比较,HCCLM3/Tax细胞中circNOLC1的表达升高(P<0.05),而miR-485-5p的表达降低(P<0.05)。见表2。
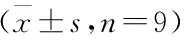
表2 circNOLC1和miR-485-5p在HCCLM3细胞和HCCLM3/Tax细胞中的表达
2.3 敲减circNOLC1联合紫杉醇对HCCLM3/Tax细胞增殖、迁移和侵袭的影响 与转染si-NC的HCCLM3/Tax细胞比较,转染si-circNOLC1的HCCLM3/Tax细胞中circNOLC1的表达量显著降低(0.18±0.03比1.00±0.00,t=82.000,P<0.05)。与Tax+si-NC组比较,Tax+si-circNOLC1组HCCLM3/Tax细胞抑制率升高(P<0.05),克隆形成数、划痕愈合率和侵袭数均降低(P<0.05),迁移和侵袭相关蛋白MMP-2和MMP-9表达降低(P<0.05)。见图1、表3。
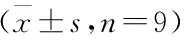
表3 敲减circNOLC1联合紫杉醇对HCCLM3/Tax细胞增殖、迁移和侵袭的影响
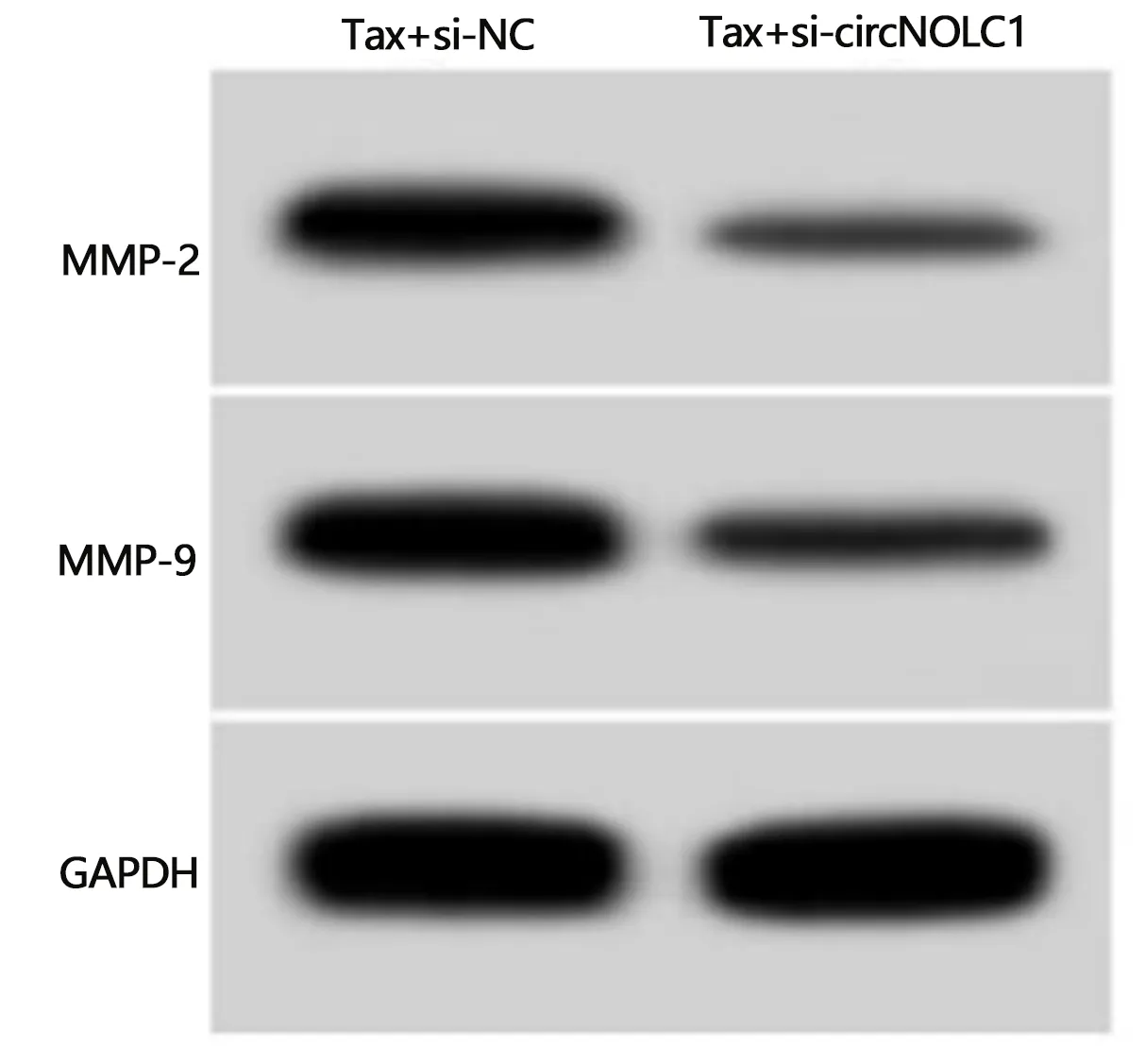
图1 敲减circNOLC1联合紫杉醇对HCCLM3/Tax细胞中MMP-2和MMP-9蛋白表达的影响
2.4 过表达miR-485-5p联合紫杉醇对HCCLM3/Tax细胞增殖、迁移和侵袭的影响 与转染miR-NC的HCCLM3/Tax细胞比较,转染miR-485-5p mimics的HCCLM3/Tax细胞中miR-485-5p的表达量显著升高(2.99±0.23比1.00±0.00,t=25.957,P<0.05)。与Tax+miR-NC组比较,Tax+miR-485-5p组HCCLM3/Tax细胞抑制率升高(P<0.05),克隆形成数、划痕愈合率和侵袭数均降低(P<0.05),迁移和侵袭相关蛋白MMP-2和MMP-9表达降低(P<0.05)。见图2,表4。
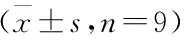
表4 过表达miR-485-5p联合紫杉醇对HCCLM3/Tax细胞增殖、迁移和侵袭的影响
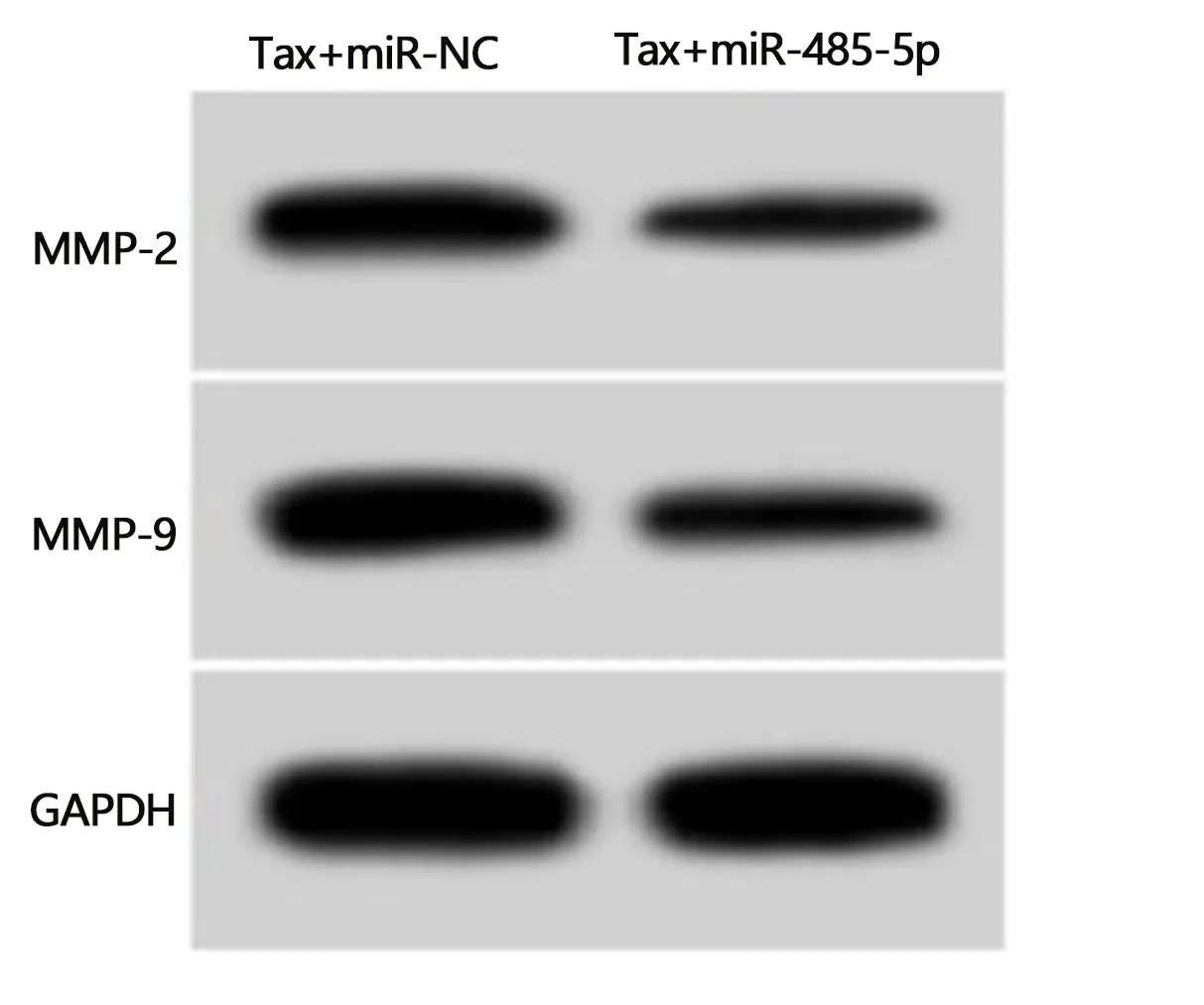
图2 过表达miR-485-5p联合紫杉醇对HCCLM3/Tax细胞中MMP-2和MMP-9蛋白表达的影响
2.5 circNOLC1靶向调控miR-485-5p的表达 StarBase靶基因在线软件预测显示的circNOLC1与miR-485-5p的结合位点见图3。共转染WT-circNOLC1与miR-485-5p mimics的HCCLM3/Tax细胞荧光素酶活性显著低于共转染WT-circNOLC1与miR-NC的细胞(P<0.05),而共转染MUT-circNOLC1与miR-485-5p mimics的HCCLM3/Tax细胞荧光素酶活性与共转染MUT-circNOLC1与miR-NC的细胞比较差异无统计学意义(P>0.05),见表5。与转染si-NC的HCCLM3/Tax细胞比较,转染si-circNOLC1的HCCLM3/Tax细胞中miR-485-5p的表达量显著升高(3.11±0.26比1.00±0.00,t=24.346,P<0.05)。

图3 circNOLC1的序列中含有与miR-485-5p互补的核苷酸序列
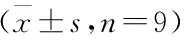
表5 双荧光素酶报告实验
2.6 干扰miR-485-5p逆转敲减circNOLC1联合紫杉醇对HCCLM3/Tax细胞增殖、迁移和侵袭的作用 与共转染si-circNOLC1与anti-miR-NC的HCCLM3/Tax细胞比较,共转染si-circNOLC1与anti-miR-485-5p的HCCLM3/Tax细胞中miR-485-5p的表达量显著降低(0.35±0.04比1.00±0.00,t=48.750,P<0.05)。与Tax+si-circNOLC1+anti-miR-NC组比较,Tax+si-circNOLC1+anti-miR-485-5p组HCCLM3/Tax细胞抑制率降低(P<0.05),克隆形成数、划痕愈合率和侵袭数均升高(P<0.05),MMP-2和MMP-9蛋白表达升高(P<0.05)。见图4,表6。

表6 干扰miR-485-5p逆转敲减circNOLC1联合紫杉醇对HCCLM3/Tax细胞增殖、迁移和侵袭的作用
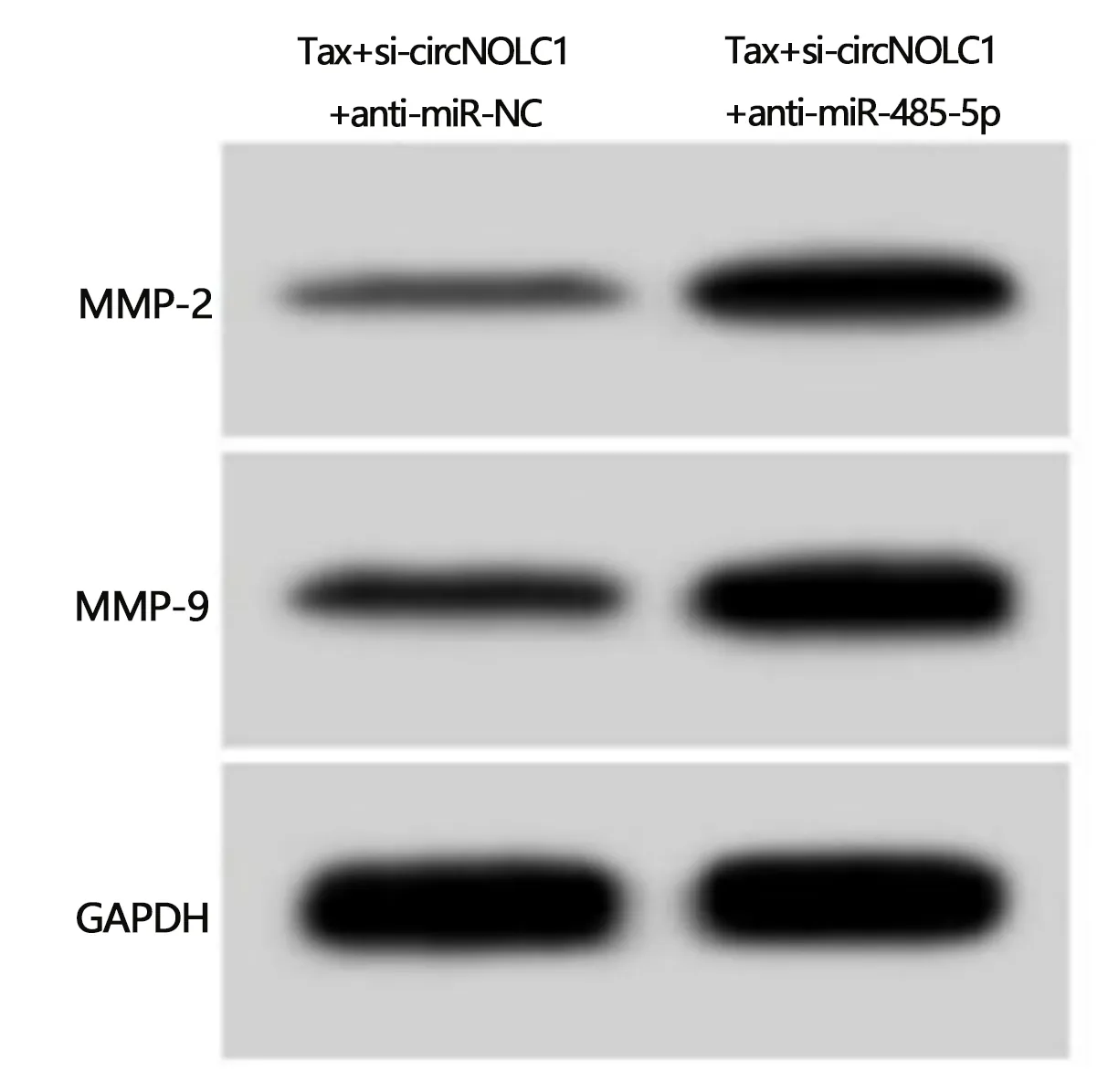
图4 干扰miR-485-5p逆转敲减circNOLC1联合紫杉醇对HCCLM3/Tax细胞中MMP-2和MMP-9蛋白表达的作用
3 讨论
circRNA是一种呈闭合环状的非编码RNA,其可发挥miRNA分子海绵作用影响miRNA靶基因的表达,进而发挥生物学调控作用。近年来研究表明,circRNA参与调控肿瘤细胞对化疗药物紫杉醇的敏感性。circRNF111在紫杉醇抗性的乳腺癌组织和细胞中表达增加,敲低circRNF111可在体外抑制紫杉醇抗性的乳腺癌细胞生长、侵袭和糖酵解,其作用机制与靶向调控miR-140-5p/E2F3轴有关[8];circ_0002874的下调可通过调节miR1273f/MDM2/P53信号通路逆转肺癌细胞对紫杉醇的耐药性[9];circ_CELSR1在紫杉醇耐药的卵巢癌组织和细胞中表达上调,其通过调节miR-149-5p/SIK2轴增强卵巢癌细胞对紫杉醇的耐药性[10];circBIRC6在肝癌组织中表达上调,敲减circBIRC6可通过靶向上调miR-877-5p降低肝癌细胞对紫杉醇抗性轴[11]。这些参与调控肿瘤细胞对紫杉醇耐药性的circRNA为改善肿瘤对紫杉醇的耐药性提供了潜在分子靶点。
作为一种circRNA,目前对circNOLC1影响肿瘤发展的研究还很少见。本研究显示,circNOLC1在紫杉醇耐药肝癌细胞中呈高表达,敲减circNOLC1可阻碍紫杉醇处理的紫杉醇耐药肝癌细胞增殖、迁移和侵袭,提示circNOLC1可作为逆转紫杉醇耐药肝癌细胞对紫杉醇耐药性的分子靶点。细胞迁移和侵袭受多种基因分子和信号通路的调控,其中MMP-2和MMP-9属于基质金属蛋白酶家族成员,表达增加使促进细胞外基质的降解,进而促进细胞迁移和侵袭[12]。本研究显示,敲减circNOLC1可降低紫杉醇处理的紫杉醇耐药肝癌细胞中MMP-2和MMP-9的蛋白表达,提示敲减circNOLC1可能通过调控MMP-2和MMP-9表达来抑制紫杉醇处理的紫杉醇耐药肝癌细胞迁移和侵袭。
为了进一步探究敲减circNOLC1降低紫杉醇耐药肝癌细胞对紫杉醇的耐药性的分子机制,本研究证实了circNOLC1可靶向结合miR-485-5p,且敲减circNOLC1能够促进紫杉醇耐药肝癌细胞中miR-485-5p的表达,说明circNOLC1靶向结合并负调控miR-485-5p。miR-485-5p参与调控多种肿瘤的恶性表型,与肿瘤发展密切相关。研究显示,miR-485-5p在神经胶质瘤、肺腺癌、肾细胞癌、肝癌和乳腺癌等肿瘤中表达降低,上调其表达可抑制肿瘤细胞的恶性行为,进而阻碍肿瘤发展进程[13-17]。此外,miR-485-5p还影响肿瘤的放化疗疗效。研究显示,miR-485-5p在顺铂耐药的皮肤鳞状细胞癌中表达下调,上调其表达可通过靶向抑制REV3L阻碍顺铂耐药的皮肤鳞状细胞癌增殖、迁移和侵袭,并降低细胞对顺铂的耐药性[18];miR-485-5p表达的上调可通过靶向抑制FERMT1增强食管癌细胞的放射敏感性,miR-485-5p可作为改善食管癌放射抵抗的分子靶点[19]。本研究结果显示,miR-485-5p在紫杉醇耐药的肝癌细胞中表达降低,过表达miR-485-5p可降低紫杉醇处理的紫杉醇耐药肝癌细胞的增殖、迁移和侵袭能力,这说明过表达miR-485-5p增强了紫杉醇耐药肝癌细胞对紫杉醇的敏感性,提示miR-485-5p可作为改善肝癌细胞紫杉醇耐药性的分子靶点。同时,本研究还显示,干扰miR-485-5p降低了敲减circNOLC1对紫杉醇处理的紫杉醇耐药肝癌细胞的增殖、迁移和侵袭能力的抑制作用,进一步提示敲减circNOLC1通过靶向上调miR-485-5p来降低紫杉醇耐药肝癌细胞对紫杉醇的耐药性。
综上所述,circNOLC1在紫杉醇耐药肝癌细胞中表达上调,而miR-485-5p表达下调;敲减circNOLC1可削弱紫杉醇处理的紫杉醇耐药肝癌细胞的增殖、迁移和侵袭能力,其作用机制可能与靶向上调细胞中miR-485-5p的表达有关,circNOLC1/miR-485-5p轴可能为改善肝癌紫杉醇耐药性提供了分子靶点,但尚需在体内进行验证。

