醋醅中优良醋酸菌的分离筛选及性能研究
冯荆舒,张荣,高献礼,代春华,何荣海*,马海乐
1(江苏大学 食品与生物工程学院,江苏 镇江,212013)2(江苏大学 食品物理加工研究院,江苏 镇江,212013)
食醋作为我国传统的食品调味品,是由粮食蔬果在多种微生物的作用下,通过淀粉糖化、酒精发酵和醋酸发酵制成[1],其营养价值丰富,含有多酚[2]、黄酮[3]等物质,具有杀菌消炎[4]、降血压、降血脂[5]、预防癌症、心血管疾病[6]等功效。
醋酸菌为革兰氏阴性好氧菌,可将乙醇转化成乙酸[7],产生独特风味,进而影响产品的品质[8]。醋酸菌作为醋酸发酵这一过程的“主力菌”,在食醋的生产发酵过程中不可或缺,其发酵性能很大程度地影响食醋企业的生产发展[9],筛选高产酸且具有良好耐受性的醋酸菌菌株始终是食醋产业的研究方向。杨杰等[10]采用传统分离培养的方法从广西民间酿醋作坊的醋醅中分离1株产酸量高且具有一定耐热和耐乙醇性能的醋酸杆菌。王超敏等[11]从山西老陈醋醋醅中分离筛选出18株巴氏醋杆菌、2株醋化醋杆菌,其中巴氏醋杆菌SAV-CP 1884性能最好。赵馨仪等[12]从山西老陈醋醋醅中筛选出7株产酸菌,其中有3株产酸量高且耐受性良好,分别为巴氏醋杆菌SAV-1、植物乳杆菌SAV-7和SAV-8。
镇江香醋作为我国四大名醋之一,以优质糯米为原材料,采用多菌混合式固态分层发酵的方法,其醋醅中蕴藏着较为丰富的菌种资源。因此,本实验以镇江香醋发酵过程中的醋醅为样品,分离筛选出优良醋酸菌,并进行生理生化及16S rDNA分子生物学鉴定试验,以期筛选出优良菌株,丰富菌种资源,为食醋行业的发展奠定基础。
1 材料与方法
1.1 材料与仪器
醋醅,镇江恒顺香醋有限公司;酵母粉、葡萄糖、琼脂、MgSO4·7H2O、KH2PO4、NaOH、溴甲酚紫,国药集团化学试剂有限公司。
HVE-50灭菌锅,日本Hirayama公司;OptiClean1300垂直流洁净工作台,瑞士Kuhnrikon公司;SPX250B-Z生化培养箱,上海博迅医疗生物仪器公司;HYL-C3组合摇床,太仓强乐实验设备有限公司。
1.2 培养基
分离培养基(g/L):葡萄糖10,酵母膏10,0.04%(体积分数)溴甲酚紫50 mL,琼脂20,121 ℃灭菌20 min,待温度降约70 ℃时加入30 mL无水乙醇。
种子培养基(g/L):葡萄糖10,酵母膏10,pH 5.5,121 ℃灭菌20 min,待温度降约70 ℃时加入30 mL无水乙醇。
发酵培养基(g/L):酵母膏10,葡萄糖10,KH2PO40.1,MgSO4·7H2O 0.1,pH 5.5,121 ℃灭菌20 min,待温度降约70 ℃时加入60 mL无水乙醇。
1.3 分离及鉴定流程
醋醅样品→稀释涂布→分离纯化→革兰氏染色→定性试验→定量试验→培养单菌落→形态观察→生理生化试验→分子生物学鉴定→斜面保藏
1.3.1 分离
称取10 g样品置于含有90 mL无菌生理盐水的三角烧瓶,振荡30 min,梯度稀释后涂平板,置于30 ℃培养箱倒置培养2 d。从中挑选变色圈大而清晰,且长势较好的单菌落进行后续试验。
1.3.2 纯化
将上述单菌落纯化培养3次,确认形态一致后,挑选其中长势较好、变色圈大而清晰的单菌落保藏[13]。
1.3.3 革兰氏染色
对筛选菌株进行革兰氏染色,并借助显微镜观察其细胞形态[14]。
1.3.4 产酸定性试验
取5 mL种子液,离心去除菌体,用0.1 mol/L NaOH溶液调节pH为7.0,加入5~6滴质量分数5% FeCl3溶液,离心取上清液,若水浴加热5 min有红褐色沉淀,则初步认定为产醋酸菌。离心分离沉淀后加入1 mL浓硫酸,沉淀溶解,再加1 mL无水乙醇,若加热沸腾产生乙酸乙酯香味,则为醋酸菌[15]。
1.3.5 初筛
根据革兰氏染色和产酸定性试验初步筛选出醋酸菌。
1.3.6 复筛
将初筛得到的菌株接种至发酵培养基,30 ℃、200 r/min摇床培养6 d,采用酸碱滴定法测定发酵液总酸度[16],并根据结果筛选出产量较高的菌株。酸碱滴定法[17]:将2 mL发酵液加至50 mL蒸馏水中,加入3~5滴0.5%(体积分数)酚酞酒精溶液,用0.1 mol/L NaOH溶液滴定至浅粉色。发酵产酸量的计算如公式(1)所示:
(1)
式中:L,产酸量,g/L;V,发酵液样品消耗NaOH溶液的体积,mL;V0,对照组(空白培养基)消耗NaOH溶液的体积,mL;c,NaOH溶液的浓度,mol/L;60,醋酸的摩尔质量,g/mol;V1,样品的体积,mL。
1.3.7 菌种鉴定
1.3.7.1 生理生化鉴定
根据《伯杰细菌鉴定手册》(第八版)[18]与《常见细菌系统鉴定手册》[19]对菌株进行生理生化鉴定。
1.3.7.2 分子生物学鉴定
由于上述方法不够精准,因此采用分子生物学鉴定方法进一步鉴定菌株[20]。按照DNA提取试剂盒的说明提取DNA。选取通用引物27F和1492R(27F:5′-AGTTTGATCMTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′)对菌株的DNA序列进行PCR扩增[21]。纯化后送至上海生工测序。根据检测结果,在美国国家生物技术信息中心数据库检索同源序列,找到与目标菌株同源性最大的模式菌株,利用MEGA7.0对DNA序列进行多序列比对[22],并采用邻接法构建系统发育树[23],以确定筛选菌株的种属[24]。
1.4 生长发酵性能的测定
1.4.1 生长曲线的测定
菌株活化后接至种子液培养基,置于30 ℃、200 r/min摇床培养,以空白培养基作对照,每2 h测定样品在600 nm处的吸光度值OD600,并绘制生长曲线。
1.4.2 乙醇对菌株生长发酵的影响
将活化的菌株分别接入加有3%、9%、12%、15%(体积分数)无水乙醇的发酵培养基中,在培养0、12、24、36、48、72 h分别取样,测定醋酸菌在600 nm下的吸光度值OD600,并测量培养72 h的产酸量。
1.4.3 乙酸对菌株生长发酵的影响
将活化的菌株分别接入加有1、2、3、4%(体积分数)乙酸的发酵培养基中,在培养0、12、24、36、48、72 h分别取样,测定醋酸菌在600 nm下的吸光度值OD600,并测量培养72 h的产酸量。
1.5 数据处理
所有试验重复3次,试验结果用平均值±标准偏差表示。运用统计分析软件处理数据,显著性水平设定值为0.05,P<0.05表示差异显著。
2 结果与分析
2.1 分离筛选结果
2.1.1 分离纯化
溴甲酚紫在pH为5.2~6.8内,颜色会由黄色变成紫色。1992年BOARD等[25]利用该特性分离产酸菌。由于产酸菌代谢产酸,菌落在紫色的平板上就会呈现出黄色的变色圈,挑取其中长势较好的98个单菌落分离纯化。
2.1.2 初筛
通过革兰氏染色和产酸定性试验,剔除部分革兰氏阳性及不产醋酸的菌株,初步筛选出41株醋酸菌。
2.1.3 复筛
通过产酸定量试验,复筛出其中产酸量较高的5株菌。如图1所示,各菌株的产酸量随时间的增加而不断增高,发酵1~4 d,产酸量均迅速增加,而发酵4~6 d,产酸量缓慢增加并趋于平缓。菌株H3的产酸量始终高于其他菌株,最高为44.16 g/L。
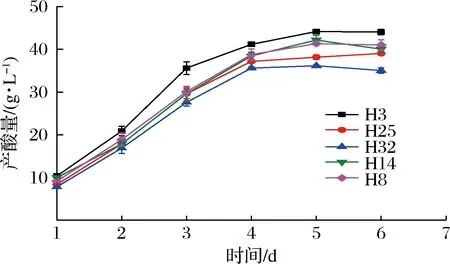
图1 各菌株的产酸曲线Fig.1 Acid production curves of each strain
然后对其遗传稳定性进行研究,如表1所示,各菌株每代的产酸量均发生不同程度的变化。其中菌株H3各代的产酸量之间没有显著性差异,遗传性能稳定。结合图1和表1,选择菌株H3为目的菌株。

表1 各菌株传代培养产酸量的测定 单位:g/LTable 1 Determination of acid production of each strain in subculture
2.2 菌株鉴定结果
2.2.1 形态特征
如图2所示,菌株H3的菌落在溴甲酚紫显色培养基上呈米黄色,不透明,圆形,边缘规整,有凸起,质地稀软,表面光滑;革兰氏染色后呈革兰氏阴性且短杆状,单个或成对、成链排列,无芽孢。

a-菌落形态;b-细胞形态图2 菌株H3的菌落形态和细胞形态图Fig.2 Colony morphology and cell morphology of strain H3
2.2.2 生理生化鉴定
接触酶试验阳性;不产生水溶性棕色色素;不产纤维素;不水解淀粉;生酮试验菌落周围有红色沉淀生成;在乙酸、乳酸氧化试验中菌落周围产生乳白色的晕圈;产葡萄糖酸试验中菌落周围产生透明圈。根据《伯杰细菌鉴定手册》(第八版)和《常见细菌系统鉴定手册》,初步确定菌株H3属于醋杆菌属(Acetobacter)。
2.2.3 分子生物学鉴定
2.2.3.1 基因片段提取和PCR扩增结果
将提取的DNA片段扩增后,利用琼脂糖凝胶电泳检测,条带如图3所示,可以看出菌株H3的16S rDNA序列长度约1 500 bp,与预计的片段大小相符,表明DNA提取扩增成功,可进行后续操作。

图3 菌株H3的琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of strain H3
2.2.3.2 核苷酸序列分析
将菌株H3的16S rDNA序列上传到数据库中比对,结果如表2所示,通过比对发现H3与序列号为KF030784.1的Acetobacterpomorum的同源性最高,相似度达到99.86%。因而可确定筛选菌株属于果实醋杆菌(Acetobacterpomorum)。

表2 菌株H3的序列比对结果Table 2 Sequence alignment results of strain H3
2.2.3.3 系统发育树
通过构建系统发育树分析菌株H3的亲缘关系,结果如图4所示,菌株H3与A.pomorum处于同一分支,表明亲缘关系最近。综合上述分析结果,最终将菌株H3鉴定为果实醋杆菌(A.pomorum)。

图4 菌株H3的系统发育树Fig.4 Phylogenetic tree of strain H3
2.3 生长发酵性能的测定
2.3.1 生长曲线的测定
如图5所示,菌株H3在接种后至10 h生长较为迟缓,处于生长延滞期;在10~20 h生长曲线呈现直线增长的趋势,处于指数生长期;在20~28 h生长状态趋于稳定,处于稳定期;而后呈现出略微下降的趋势,逐步进入衰退期。

图5 菌株H3的生长曲线Fig.5 Growth curve of strain H3
2.3.2 乙醇对菌株生长发酵的影响
不同体积分数的乙醇对菌株的影响如图6所示,在发酵产酸方面,菌株H3的产酸量随乙醇浓度的升高而呈现先升高后下降的趋势,体积分数6%时产酸量最大,为40.5 g/L;在生长量方面,体积分数3%的乙醇能促进醋酸菌的生长;当乙醇体积分数为9%时,生长量略微下降;而体积分数12%~15%的乙醇则会抑制菌株生长。这种现象可能是由于乙醇体积分数较低时可为醋酸菌提供营养,利于其生长代谢,而体积分数过高,则会损伤醋酸菌的细胞膜,不利于细胞生长。综合分析,菌株H3可耐受体积分数9%的乙醇。

a-产酸量;b-生长量图6 不同乙醇含量对菌株产酸量和生物量的影响Fig.6 Effect of different ethanol content on acid production and biomass of strain注:不同小写字母表示各组之间存在显著性差异(P<0.05)(下同)
2.3.3 乙酸对菌株生长发酵的影响
不同体积分数的乙酸对菌株的影响如图7所示。

a-产酸量;b-生长量图7 不同乙酸含量对菌株产酸量和生物量的影响Fig.7 Effect of different acetic acid content on acid production and biomass of strain
在发酵产酸方面,菌株H3的产酸量随着乙酸体积分数的增高而呈现出先升高后下降再升高的变化趋势,体积分数4%时产酸量最大,为70.2 g/L,由于乙酸使发酵液酸度增加,因而测得总酸量包含乙酸的添加量。在生长量方面,随着乙酸含量的增加,醋酸菌的生长受到不同程度的抑制,这种现象可能是由于酸性环境会影响醋酸菌的相关酶活性,从而影响菌株的生长发酵。综合分析,菌株H3可耐受体积分数3%的乙酸。
3 结论
本实验以发酵过程中的醋醅为样品,利用溴甲酚紫显色平板结合初筛复筛试验,筛选出一株产酸量较高、耐受性良好且遗传性稳定的优良醋酸菌,通过形态观察、生理生化以及16S rDNA分子生物学鉴定,最终确定该菌株为果实醋杆菌(Acetobacterpomorum)。该菌株在发酵第5天产酸量最高,为44.16 g/L;能够耐受体积分数9%的乙醇和体积分数3%的乙酸。本实验由于采用的是自然发酵过程中的醋醅,相较于纯种AS1.41和沪酿1.01,筛选菌株的产酸及耐受能力还有待提高,在后续研究中可采用物理或化学诱变的方法进一步选育优良醋酸菌,推动纯种液态发酵的食醋工业化生产的发展。

