患病青白藜可培养内生菌的群落结构及多样性分析
呼 荣,乔佳慧子,郝玉凡,谢天艳,李 玮,沈 硕
(青海大学 青海省农林科学院/青藏高原生物技术教育部重点实验室,青海 西宁 810016)
【研究意义】藜麦(Chenopodium quinoaWilld)又称南美藜、藜米等,1 年生草本植物,种植历史长达7 000 多年,被称为“粮食之母”[1-3]。藜麦是一种高蛋白、低热量、活性物质丰富的全营养食物,具有提升人体新陈代谢、抑制癌细胞生长等方面的功效[4-6]。自2008 年山西省规模化种植藜麦以来,我国藜麦种植区出现各类病害,严重降低藜麦产量。据文献报道[7-9],引起我国藜麦真菌病害的病原菌众多,由Peronospora variabilis引起的藜麦霜霉病导致山西静乐县藜麦种植区发病率达95%,减产约40%;由Cercosporacf.chenopodii引起的藜麦叶斑病导致藜麦减产约25%;茎点霉属(Phomaspp.)真菌引起的黑秆病在藜麦植株抽穗后发病,导致植株枯死。因此,明确藜麦在种植区的病害种类,进一步探索病害的发生发展规律,对有效控制藜麦病害、提高藜麦产量有重要的理论与实际意义。【前人研究进展】2017 年段慧[10]从藜麦病害部位分离获得3 株链格孢属(Alternariasp.)真菌,从藜麦种子分离获得真菌和细菌共15 株,其中枯草芽孢杆菌(Bacillus subtilis)对链格孢属(Alternariasp.)真菌引起的藜麦叶斑病有防治效果。廖映凯[11]从健康藜麦叶片分离出细菌和真菌共3 株,其中1 株内生细菌对造成藜麦叶斑病的病原菌成团泛菌(Pantoea agglomerans)SCCDP-2 和SCCDP-4 有抑制效果。朱雪峰[12]在藜麦种子内分离纯化出61 株细菌和32 株真菌,其中7 株芽孢杆菌和1 株链格孢菌对藜麦菌核病具有生防潜力。何小慧[13]通过高通量测序技术评价了藜麦不同部位、不同时期内生菌群落结构和多样性。赵富清等[14]从青藜2 号中分离出内生细菌34 株,其中3 株内生细菌对链格孢属(Alternariasp.)和刺盘孢属(Colletotrichumsp.)2 种植物病原真菌有较强的拮抗作用。【本研究切入点】此前,有学者通过高通量测序技术揭示了连作藜麦土壤以及健康藜麦不同部位、不同时期内生菌群落结构和多样性[13,15],但尚未见患真菌病害的藜麦的不同部位细菌和真菌群落结构和多样性的相关报道。本研究以藜麦患病茎秆和叶片为材料,采用稀释分离法分离纯化细菌菌株、组织分离法分离纯化真菌菌株,通过形态学观察结合16S rRNA 和ITS基因测序,明确藜麦患病茎秆和叶片中细菌和真菌群落的种类归属,为后期藜麦病害的确定和防治研究提供依据。【拟解决的关键问题】本研究对藜麦不同病害组织的细菌和真菌群落结构、多样性进行分析,初步明确青海省内引起藜麦病害的病原菌及拮抗菌,对藜麦病害的综合防治至关重要。
1 材料与方法
1.1 材料
1.1.1 供试材料 2020年6月,在青海省农林科学院试验地(36°43′N,101°45′E)采集青白藜茎秆和叶片病样。
1.1.2 供试培养基(1)PDA 培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水定容至1 L。(2)NA 培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂20 g,蒸馏水定容至1 L,pH调至7.0~7.2。
1.2 试验方法
1.2.1 样品处理 取采集的藜麦样品,在超净工作台中用无菌水冲洗3次,无菌滤纸吸干水分,用体积分数75%酒精浸泡35 s,无菌水冲洗3次,2% NaClO3溶液浸泡70 s,无菌水冲洗3次后晾干备用。
1.2.2 菌株的分离、纯化和保存 采用常规组织分离法进行真菌菌株的分离[16]。将茎秆切成1 cm 左右的小段,叶片切成1 cm×1 cm 的小块,分别接种到PDA 固体培养基上,恒温静置培养2~5 d。待组织边缘有菌丝出现后,接种针挑取菌丝至PDA 培养基,反复挑取边缘菌丝培养,直至获得纯化菌落,4 ℃冰箱保存。
采用稀释分离法分离细菌菌株[17]。取茎秆和叶片组织各3 块,置于灭菌研钵中,加入无菌水研磨成匀浆后梯度稀释,分别取100 μL 菌悬液于NA 培养基上,均匀涂布,28 ℃静置培养2~4 d。根据菌落形态、颜色等挑取单菌落进行分离纯化,4 ℃冰箱保存。
1.2.3 菌株的鉴定(1)形态学鉴定。将活化后的真菌菌株接种于PDA培养基上,观察其生长的菌落颜色、形状和菌丝、孢子形态,根据《真菌鉴定手册》[18]对菌株进行形态学鉴定。
将活化后的细菌菌株接种至NA 培养基上,观察其菌落的颜色、形状、湿润度和表面形态特征等,根据《常见细菌系统鉴定手册》[19]和《伯杰细菌鉴定手册》[20]对菌落进行形态学鉴定。(2)分子生物学鉴定。真菌菌株用真菌基因组提取试剂盒提取DNA,以通用引物(表1)进行rDNA ITS 序列的PCR 扩增。PCR扩增产物用10 g/L 琼脂糖凝胶电泳进行检测后切胶回收,送至艾优稷生物科技有限公司(西安)有限公司测序。将获得的ITS 序列提交至GenBank 获取登录号,GenBank BLAST 序列在NCBI(http://blast.ncbi.nlm.nih.gov)数据库进行比对,结果利用MAGE7.0软件,采用Neighbor-Joining方法(Bootstrap值为1 000次),构建系统发育树[21]。
采用细菌16S rRNA 通用引物(表1)扩增细菌的16S rRNA基因。PCR扩增产物用1%琼脂糖凝胶电泳进行检测后切胶回收,送至艾优稷生物科技有限公司(西安)有限公司测序。测序结果在EzBioCloud(https://www.ezbiocloud.net/)数据库进行比对,比对结果利用MAGE7.0 软件,采用Neighbor-Joining 方法(Bootstrap 值为1 000 次),构建系统发育树。
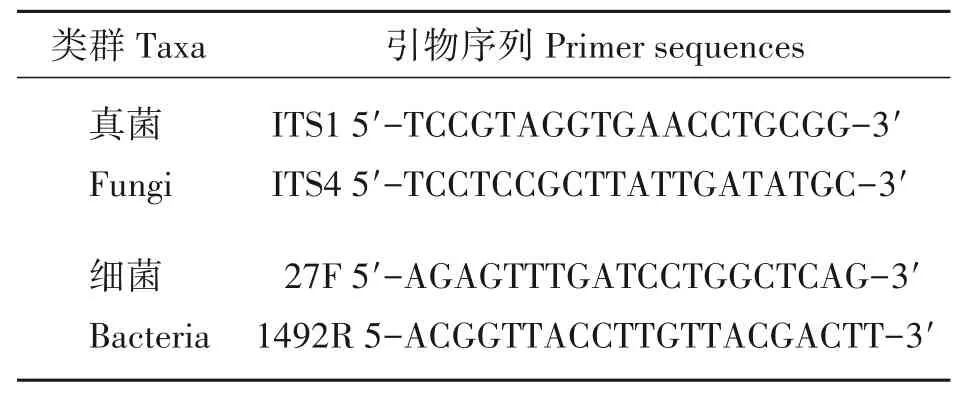
表1 引物序列信息Tab.1 Information of primer sequence
1.3 多样性分析
以97%相似度进行分类,建立操作分类单元(operational taxonomic unit,OTU),在属和种水平上分析真菌和细菌的多样性。Chao1指数评估菌群丰度,Chao1指数越大,OTU数目越多,说明丰富度越高;选用Shannon指数和Simpson指数评估菌群多样性,对群落结构进行多样性分析。
1.4 数据分析
利用Draw Venn Diagram 工具绘制Venn图。利用Muthur软件计算多样性指数。利用Excel软件进行相关数据处理、图形制作。
2 结果与分析
2.1 菌株的鉴定
2.1.1 真菌形态学鉴定 本试验共从藜麦病害组织中分离获得44 株真菌,其中茎秆中共分离到14 株,叶片中分离30株。经肉眼观察菌落表面形态,合并重复菌株后得到9个菌株,光学显微镜观察9个菌株的形态特征(图1)。初步判定分离的真菌属于5 个属:青霉属Penicilliumsp.、链格孢属Alternariasp.、新凸轮孢菌属Neocamarosporiumsp.、毛壳属Chaetomiumsp.和刺盘孢属Colletotrichumsp.。
菌株20CLM F-4-2 和20DLM F-3-1-1 菌落边缘整齐,为同心环形,中间部分呈现墨绿色,边缘颜色为白色,产生很多粉状物(图1-A1,B1);菌株20ALM F-1-3-2-2、20ALM F-1-8 和20CLM F-1-3-2 菌落为同心环形,中间部位呈棕褐色,至边缘部位颜色逐渐淡化为白色,菌落絮状(图1-C1,图1-D1,图1-E1);菌株20ALM F-2-1-1 菌落整体呈现白色,短绒状(图1-F1);菌株20DLM F-9-2-2 和20DLM F-9-6-2 菌落为圆形,整体为白色,有大量毛绒状气生菌丝,扩展速度很快(图1-G1,图1-H1);菌株20DLM F-5-4菌落中央和边缘呈现白色,中间部分为灰褐色(图1-I1)。

图1 真菌的形态特征与培养性状Fig.1 Morphological and cultural characteristics of fungi
2.1.2 真菌分子生物学鉴定 选择31 株具有代表性的真菌菌株进行序列相似对比分析,使用Mega7.0软件,根据Neighbor-Joining 方法构建系统发育树。鉴定结果表明(图2),31 株真菌菌株与其同属内近缘菌间的ITS 序列相似性位于98.59%~100.00%。结合形态特征和ITS 序列分析结果(表2),将菌株20CLM F-4-2 鉴定为P.polonicum,菌株20DLM F-3-1-1 为P.goetzii,菌株20ALM F-1-3-2-2 为A.alternata,菌株20ALM F-1-8 为A.tenuissima,菌株20CLM F-1-3-2 为A.brassicae,菌株20ALM F-2-1-1 为N.calvescens,菌株20DLM F-9-2-2 为C.elatum,菌株20DLM F-9-6-2 为C.globosum,菌株20DLM F-5-4为C.spinaciae。

图2 基于ITS序列构建的真菌菌株系统发育分析Fig.2 Phylogenetic analysis of fungal strains based on ITS sequences

表2 真菌菌株鉴定结果Tab.2 Identification results of fungal strains
2.1.3 细菌形态学鉴定 本试验共从藜麦病害组织中分离获得212株细菌,其中茎秆中共分离到10株,叶片中分离到202 株。经光学显微镜观察单菌落形态,结合观察革兰氏染色结果,合并重复菌株后得到13个菌株,菌株的形态见图3。初步判定分离的细菌归属于沙雷氏属Serratiasp.、芽孢杆菌属Bacillussp.和Heyndrickxiasp.。
菌株20CLM B-8-2 菌落不规则形,乳白色不透明,润湿度高,中间部位有褶皱(图3-A1);菌株20DLM B-2-2菌落为乳白色,边缘褶皱(图3-B1);菌株20CLM B-2-18菌落不规则形,乳白色,表面平整润湿(图3-C1);菌株20CLM B-2-34 菌落为淡黄色不透明,边缘波状略有褶皱(图3-D1);菌株20DLM B-5-13 菌落圆形,中心有凸起,润泽度较高,边缘齐整(图3-E1);菌株20DLM B-2-8 菌落润湿度较差,分泌透明物质,后期边缘有丝状物(图3-F1);菌株20DLM B-10-5 菌落近圆形,略有突起,边缘规整(图3-G1);菌株20DLM B-4-4菌落不规则,润泽度较差,边缘有毛状物(图3-H1);菌株20BLM B-1-14菌落为圆形,白色,边缘平整光滑,中间凸起(图3-I1);菌株20CLM B-5-7-1菌落松散,边缘开裂(图3-J1);菌株20CLM B-3-3 菌落为圆形,浅黄色,表面有褶皱,润泽度较高(图3-K1);菌株20DLM B-9-8 菌落近圆形不透明,表面干燥隆起,后期有黑色素产生(图3-L1);菌株20DLM B-8-6菌落为近圆形,较湿润,分泌透明物质(图3-M1)。菌株20CLM B-8-2为革兰氏阴性菌,其他均为革兰氏阳性菌。

图3 细菌形态学鉴定Fig.3 Bacterial morphological identification
2.1.4 细菌分子生物学鉴定 选择测序得到的36 株具有代表性的细菌菌株进行序列对比分析,使用Mega7.0 软件,根据Neighbor-Joining 方法构建系统发育树(图4,图5,图6)。鉴定结果表明,36 株细菌菌株与其同属内近缘菌间的16S rRNA 序列相似性位于98.82%~100.00%。结合形态特征和16S rRNA 序列分析结果(表3),将菌株20CLM B-8-2 鉴定为S.liquefaciens,菌株20DLM B-2-2 为B.subtilis,菌株20CLM B-2-18为B.cabrialesii,菌株20CLM B-2-34为B.tequilensis,菌株20DLM B-5-13为B.altitudinis,菌 株20DLM B-2-8 为B.zhangzhouensis,菌株20DLM B-10-5 为B.halotolerans,菌株20DLM B-4-4 为B.paralicheniformis,菌株20BLM B-1-14 为B.velezensis,菌株20CLM B-5-7-1 为B.licheniformis,菌株20CLM B-3-3为B.pumilus,菌株20DLM B-9-8为B.atrophaeus,菌株20DLM B-8-6为H.oleronia。
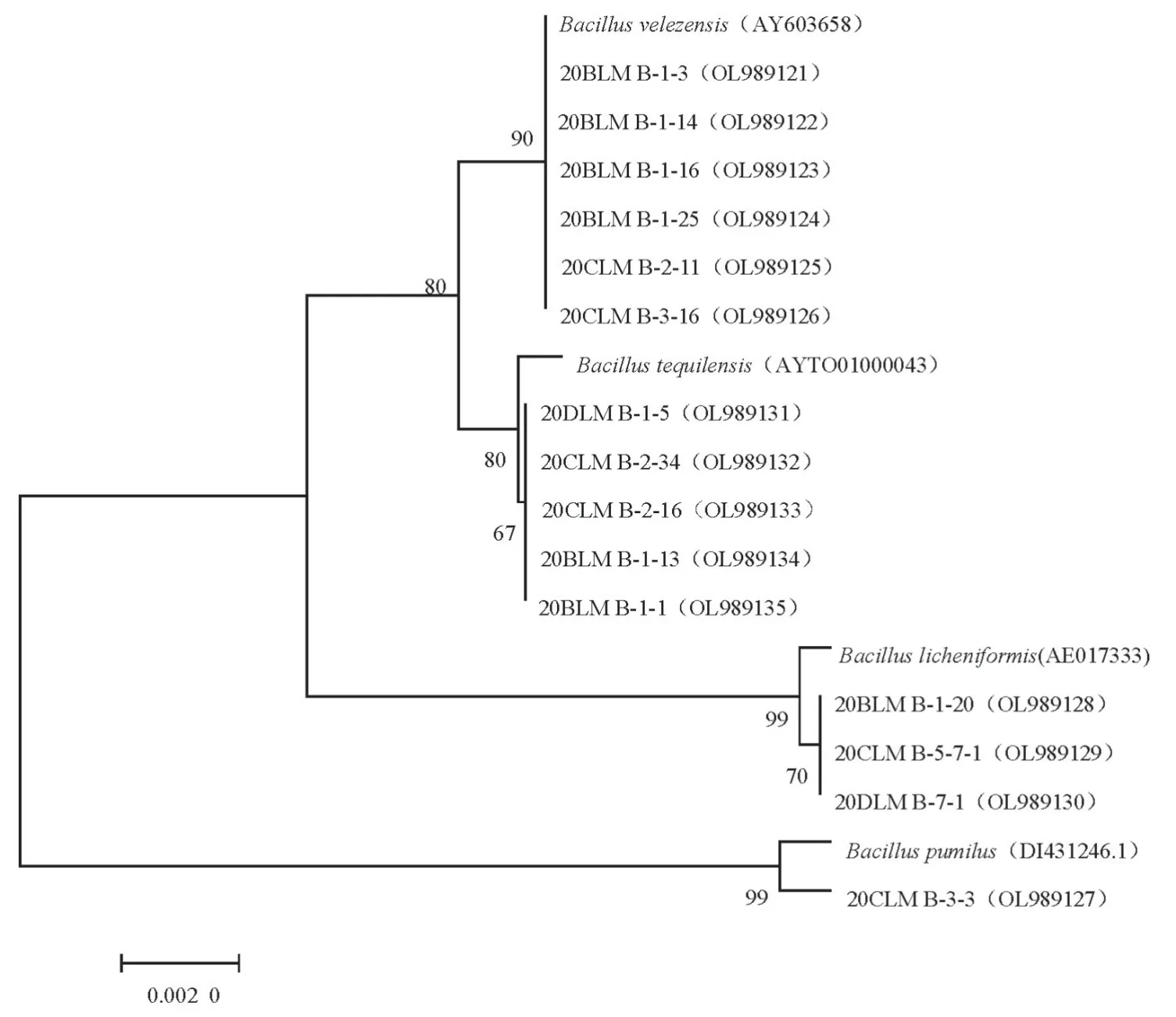
图4 基于16S rRNA基因序列构建的菌株20CLM B-2-34、20BLM B-1-14、20CLM B-5-7-1和20CLM B-3-3系统发育分析Fig.4 Phylogenetic analysis of strains 20CLM B-2-34,20BLM B-1-14,20CLM B-5-7-1 and 20CLM B-3-3 constructed based on 16S rRNA gene sequences
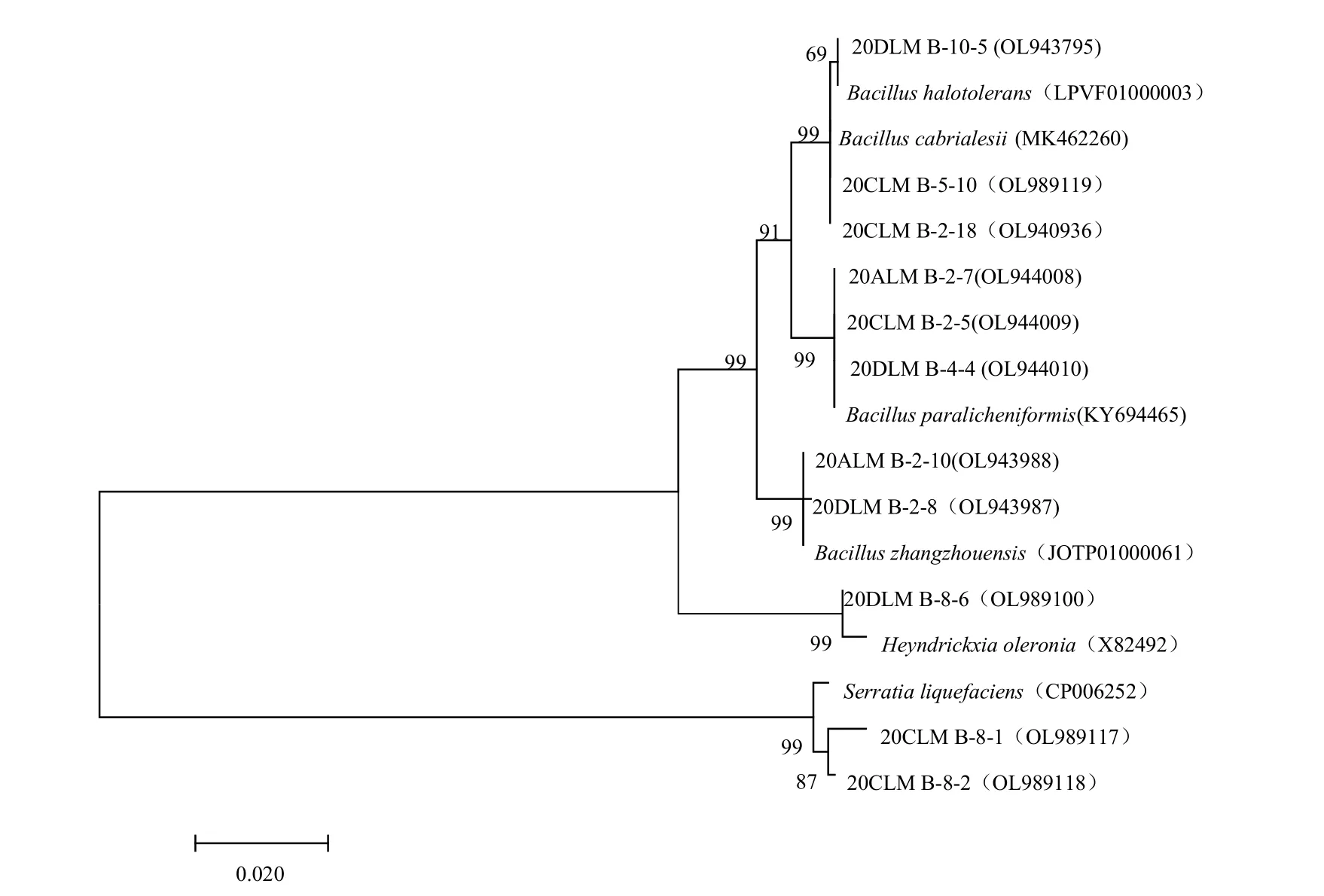
图5 基于16S rRNA基因序列构建的20CLM B-8-2、20CLM B-2-18、20DLM B-2-8、20DLM B-10-5、20DLM B-4-4和20DLM B-8-6系统发育分析Fig.5 Phylogenetic analysis of 20CLM B-8-2,20CLM B-2-18,20DLM B-2-8,20DLM B-10-5,20DLM B-4-4 and 20DLM B-8-6 based on 16S rRNA gene sequences

图6 基于16S rRNA基因序列构建的20DLM B-2-2、20DLM B-5-13和20DLM B-9-8系统发育分析Fig.6 Phylogenetic analysis of 20DLM B-2-2,20DLM B-5-13 and 20DLM B-9-8 based on 16S rRNA gene sequences

表3 细菌菌株鉴定结果Tab.3 Identification results of bacterial strains
2.2 藜麦茎秆和叶片部位细菌和真菌OTU分析
由图7 可见,Venn 图显示了藜麦患病茎秆和叶片部位共有的及各自特有的OTU。患病茎秆部位特有的真菌OTU 为1,患病叶片部位特有的真菌OUT 为6,2 个部位共有真菌OTU 为9,重叠的OTU 为2,占比22.2%,表明患病叶片部位的真菌多样性高于部位。患病茎秆部位无特有的细菌OTU,患病叶片部位特有的细菌OUT为9,2个部位共有细菌OTU为13,重叠的OTU为4,占比30.8%,表明患病叶片部位的细菌多样性高于茎秆部位。综合分析,患病叶片部位的微生物多样性远远高于茎秆。
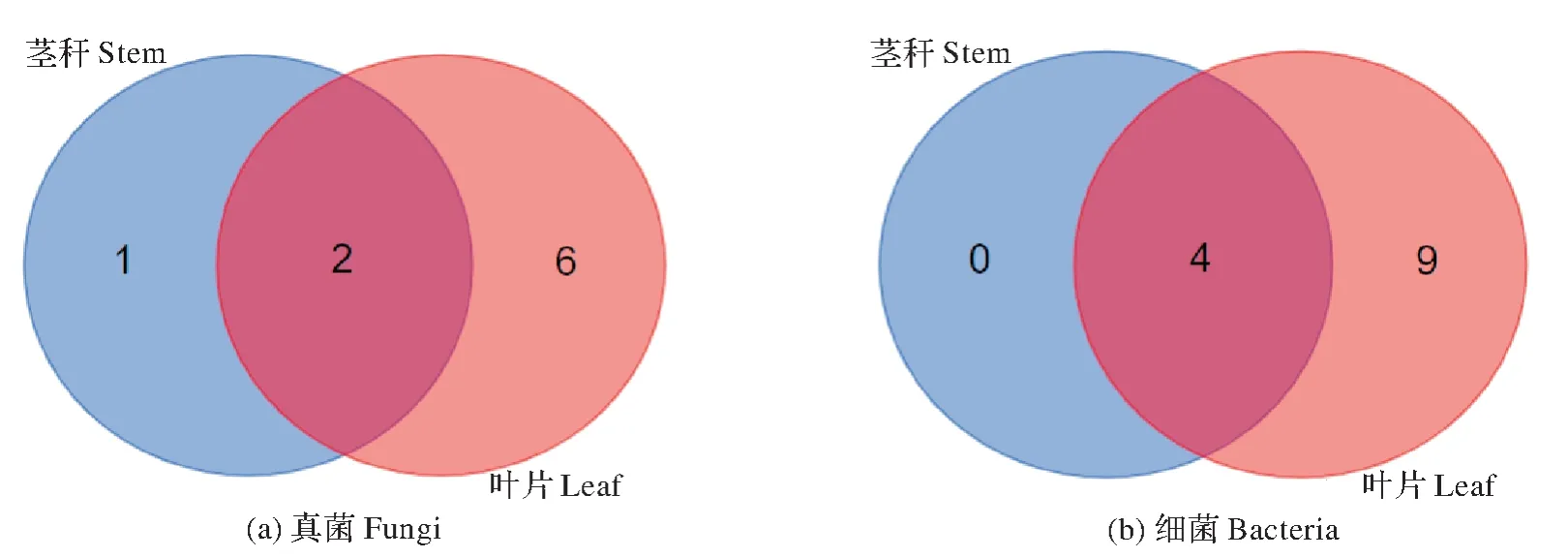
图7 藜麦茎秆和叶片部位真菌和细菌群落OTU韦恩图Fig.7 OTU Venn diagram of fungal and bacterial communities in quinoa stem and leaf parts
2.3 藜麦茎秆和叶片部位细菌和真菌多样性分析
患真菌病害的藜麦的不同部位细菌和真菌多样性统计结果见表4。藜麦患病茎秆部位真菌群落划分为1 个门、1 个纲、1 个目、1 个科、2 个属,细菌群落为1 个门、1 个纲、1 个目、1 个科、1 个属。藜麦患病叶片部位真菌群落为1 个门、3 个纲、4 个目、4 个科、4 个属,细菌群落为2 个门、2 个纲、2 个目、2 个科、3 个属。
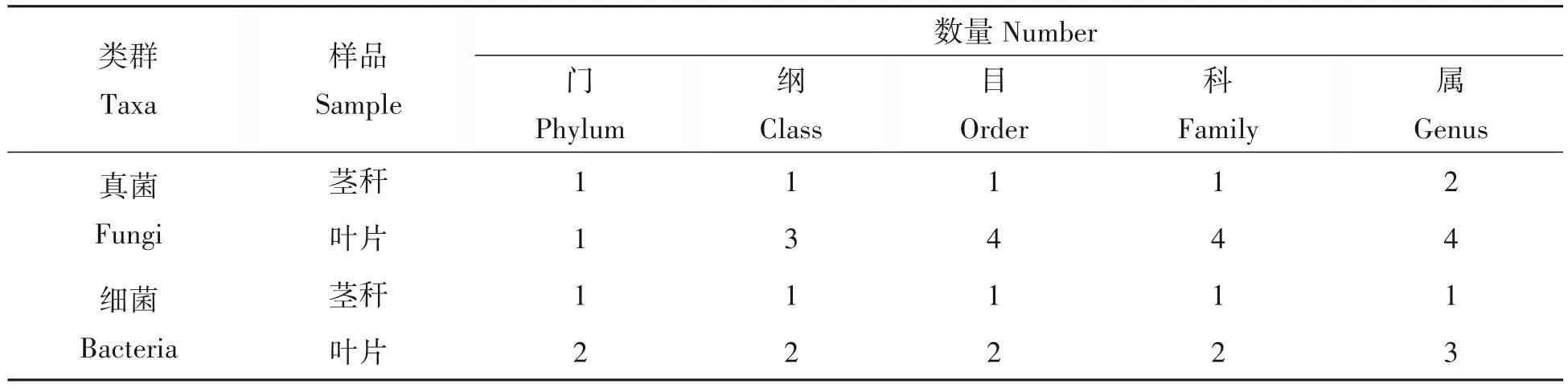
表4 藜麦茎秆和叶片部位细菌和真菌群落各分类地位数量Tab.4 Number of taxonomic positions of bacterial and fungal communities in stems and leaves of quinoa
多样性指数值计算结果见表5,Chao1指数表明患病叶片部位细菌丰富度几乎为茎秆部位的5倍,真菌丰富度几乎为茎秆部位的3 倍,说明叶片中分离到的细菌和真菌丰富度远高于茎秆。Shannon 指数和Simpson指数都说明患病叶片中分离到的真菌和细菌多样性都略高于茎秆部位。
2.4 不同分类水平下真菌和细菌群落结构分析
2.4.1 属分类水平 在属的分类水平下,分析藜麦患病茎秆和叶片部位真菌及细菌群落结构(图8)。结果表明,茎秆和叶片中分离到的主要优势真菌为链格孢属Alternariasp.,占所有真菌总数的33.4%。茎秆中的优势真菌为链格孢属Alternariasp.(71.4%),占其分离真菌总数量的比例明显高于叶片(16.7%);叶片中的优势真菌为毛壳属Chaetomiumsp.和青霉属Penicilliumsp.,相对丰度分别为36.7%、33.3%。茎秆和叶片中主要优势细菌为芽孢杆菌属Bacillussp.,占所有细菌总数的84.6%。茎秆中的细菌全部为芽孢杆菌属Bacillussp.;叶片中包括芽孢杆菌属Bacillussp.、沙雷氏属Serratiasp.和Heyndrickxiasp.,芽孢杆菌属的相对丰度为98.5%,其余属的丰度占比为1.0%~0.5%。
2.4.2 种分类水平 从图9 可以看出,在种的分类水平下,藜麦患病茎秆和叶片部位分离到的主要的优势真菌为A.alternata,占所有真菌总数的27.5%,其次为C.elatum(22.7%)和P.polonicum(20.4%)。藜麦茎秆部位包括3 个种的真菌:A.alternata、A.tenuissima和N.calvescens,茎秆中的优势种A.alternata(64.3%)占其分离真菌总数量的比例明显高于叶片(10.0%);叶片中的优势种为C.elatum(33.3%)和P.polonicum(30.0%),其余各种如C.spinaciae、A.alternata、A.tenuissima、A.brassicae、P.goetzii、C.globosum所占比例差异不明显。藜麦患病茎秆和叶片部位主要的优势细菌种为B.velezensis和B.tequilensis,占所有细菌总数的36.8%和34.0%。茎秆中B.velezensis丰度比例为60.0%,其余各种丰度比例为10.0%~20.0%;叶片中的优势种为B.velezensis(35.6%)和B.tequilensis(35.1%),其余各种的丰度比例为0.5%~11.7%。
3 讨论
藜麦作为一种新型高价值作物,被联合国粮农组织认为是一种单体植物即可满足人体基本营养需求的食物[11]。本研究对藜麦患病茎秆、叶片部位细菌和真菌群落进行多样性分析。结果表明在分离得到的真菌中链格孢属Alternariasp.是优势属,丰度为33.4%。链格孢属真菌作为重要的植物病原菌,引起的严重病害包括黑斑病、叶斑病等[10]。张斌等[22]研究发现由A.alternata和A.gaisen等多种链格孢菌引起的柑橘黑腐病和褐斑病;Yan等[23]在我国江苏省的几个山核桃品种发现由A.tenuissima引起叶黑斑病;Yosra 等[24]调查发现孜然链格孢A.burnsii引起突尼斯地区菜豆叶斑病,在病害易爆发时期,可造成极大损失;Hahn等[25]在巴西尖叶石杉上发现由A.arborescens引起的叶斑病。说明引起藜麦病害的病原菌很有可能为链格孢属Alternariasp.真菌。毛壳属Chaetomiumsp.和青霉属Penicilliumsp.是除链格孢属外分离得到较多的真菌,丰度均为22.2%。在此前的研究中发现,毛壳属真菌可以用来防治棉花黄萎病[26],用于柑橘采后保鲜[27],也造成石榴叶斑病[28]等。青霉属真菌可以抑制青枯菌活性[29],刺盘孢属Colletotrichumsp.真菌可侵染线辣椒、箭筈豌豆等植物,造成产量下降[30-31]。
芽孢杆菌作为一类重要的生防菌资源,能够有效预防植物病害。本研究对藜麦患病茎秆、叶片部位细菌群落进行多样性分析,结果表明分离得到的细菌优势属为芽孢杆菌属,丰度为84.6%,优势种为B.velezensis和B.tequilensis。据有关报道,藜麦种子内生菌枯草芽孢杆菌、沙福芽孢杆菌可以防治藜麦叶斑病和藜麦菌核病[10,12],藜麦叶片内生菌贝莱斯芽孢杆菌可以防治藜麦叶斑病[14],枯草芽孢杆菌可以防治棉花立枯病和黄萎病[32],特基拉芽孢杆菌可以防治稻瘟病等[33],贝莱斯芽孢杆菌可以防治桃树根腐病、水稻纹枯病和花生白绢病等[34-36],萎缩芽孢杆菌可以抑制苹果树腐烂病菌菌丝生长和孢子的萌发、防治樱桃叶斑病[37-38]。
本研究对从藜麦患病茎秆和叶片部位获得的细菌和真菌菌株进行了形态学和分子学方面的初步探索,分析不同患病部位细菌和真菌组成及多样性,初步探讨了患病部位菌株组成差异,为后期研究提供了试验基础及供试菌株,为之后研究菌株的次生物质、诱导植物产生抗性等作用以及菌种资源开发奠定了基础。

