circRNA_0008259通过抑制miR-423-5p调控瘢痕疙瘩成纤维细胞Ⅰ型胶原蛋白的表达
杨馨悦,熊一峰,张淑兰,张志彬,彭亚婷
瘢痕疙瘩是一种皮肤纤维化疾病,表现为成纤维细胞过度增殖以及Ⅰ、Ⅲ型胶原蛋白合成增多[1]。虽然瘢痕疙瘩被归类为良性皮肤疾病,但经常表现出与恶性肿瘤相似的生物学特征,如过度增殖、抗凋亡和侵袭[2]。尽管其治疗方法包括手术加放疗、皮损内药物注射、冷冻等,但这些方法仍具有局限性[3]。目前瘢痕疙瘩特别是大面积瘢痕疙瘩的治疗仍具有挑战性。环状RNA(circRNAs)是一类广泛存在的具有调控作用的内源性RNA,在多种生物过程及人类疾病中发挥着重要作用[4]。笔者前期研究[5]发现过表达环状RNA circRNA_0008259可显著下调瘢痕疙瘩成纤维细胞(keloid fibroblasts, KFs)中Ⅰ型胶原蛋白的表达,但其具体调控机制不明确。为此,本研究将进一步探讨circRNA_0008259调控Ⅰ型胶原蛋白表达发生机制。
1 材料与方法
1.1细胞培养与转染 KFs来自原代培养的人皮肤瘢痕疙瘩组织,具体方法见前期发表的文章[5]。细胞在37 ℃、5%CO2、含10%胎牛血清(Gibco)和100 μg/mL青霉素-链霉素的Dulbecco改良Eagle培养基(Gibco,Gaithersburg,USA)中培养。质粒构建和稳定转染以分离高表达hsa_circ_0008259的稳定KFs,将hsa_circ_0008259 cDNA合成并克隆到CMV载体和慢病毒中(上海吉凯)。根据说明书,人类KFs感染慢病毒的倍数为50。所有细胞在2周后用1 μg/mL嘌呤霉素进行筛选。使用实时定量PCR(qRT-PCR)在转染后48 h确认过表达效率。
1.2总RNA提取与qRT-PCR 使用TRIzol试剂(Invitrogen)从培养细胞中提取总RNA。使用M-MLV逆转录酶(Promega,Madison,USA)和随机引物(Promega)合成用于qPCR分析的cDNA。miRNA检测使用miRNA Universal SYBR qPCR Master Mix试剂盒(南京诺唯赞)。基因表达水平标准化为管家基因GAPDH,miRNA表达水平标准化为U6。每个样品在LightCycler 480实时PCR系统(罗氏)上分析一式三份。本研究中使用的miRNA引物购自通用生物系统(安徽)有限公司,引物序列如下:miR-423-5p上游5′-GTGAGGGGCAGAGAGCGA-3′,下游5′-AGTGCAGGGTCCGAGGTATT-3′;miR-451a上游5′-ACACTCCAGCTGGGAAACCGTTACCATTAC-3′,下游5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCA GTTGAGCTTACAG-3′;miR-889-3p上游5′-GCGCGT TAATATCGGACAAC-3′,下游5′-AGTGCAGGGTCCGAGGTATT-3′;miR-200-5p上游5′-GCGCATCTTACTGGGCAGC-3′,下游5′-AGTGCAGGGTCCGAGGTATT-3′;miR-676-3p上游5′-CGCGCTGTCCTAAGGTTGT-3′,下游5′-AGTGCAGGGTCCGAGGTATT-3′;U6上游5′-CTCGCTTCGGCAGCACA-3′,下游5′-AACGCTTCACGAATTTGCGT-3′。
1.3RNA高通量测序 使用VAHTSTM总RNA序列(H/M/R)构建RNA样本的cDNA文库。在RiboBio Co.Ltd.的IIIumina HiSeqTM2500上对cDNA文库进行配对和测序。分析了样本间的miRNA表达聚类和差异表达。根据差异倍数(| log2(倍数变化)|≥2)和显著性水平(P<0.05)选择样本间差异表达的miRNA。层次聚类分析(| log2(倍数变化)|≥2)分析不同实验参数下差异转录的miRNA的表达。在GO和KEGG数据库上对差异表达的miRNA的亲本基因进行了显著的富集分析。
1.4蛋白质提取和酶解 样品从-80 ℃取出,分别加入4倍体积裂解缓冲液(8 mmol/L尿素,1%蛋白酶抑制剂),超声裂解。4 ℃,12 000 g离心10 min,去除细胞碎片,上清液转移至新的离心管,利用BCA试剂盒(上海碧云天)进行蛋白浓度测定。各样品蛋白取等量进行酶解,加入适量标准蛋白,用裂解液将体积调整至一致。缓慢加入终浓度20% TCA,涡旋混匀,4 ℃ 沉淀2 h。4 500 g,离心5 min,弃上清,用预冷的丙酮洗涤沉淀2~3次。晾干沉淀后加入终浓度200 mmol/L的TEAB,超声打散沉淀,以1∶50的比例(蛋白酶:蛋白,m/m)加入胰蛋白酶,酶解过夜。
1.5TMT/iTRAQ标记 胰蛋白酶消化后,肽通过Stratx C18 SPE柱(Phenomenex)脱盐并真空干燥。肽在0.5 mol/L TEAB中重组,并根据TMT试剂盒/iTRAQ试剂盒说明书进行处理,将一单位TMT/iTRAQ试剂解冻并在乙腈中重新组合。然后,将肽混合物在室温下培养2 h,并通过真空离心汇集、脱盐和干燥。
1.6生物信息学分析
1.6.1GO富集分析 费歇尔精确双端检验方法(Fisher′s exact test)被用于检验差异表达的蛋白/miRNAs,以鉴定到的蛋白//miRNAs为背景,Gene Ontology(GO)富集检验P<0.05差异有统计学意义。
1.6.2通路富集分析 Kyoto Encyclopedia of Genes and Genomes(KEGG)数据库被用于通路的富集分析。费歇尔精确双端检验方法被用于检验差异表达蛋白/miRNAs在以鉴定到的蛋白/miRNAs为背景,通路富集检验P<0.05被认为是显著的。最后根据KEGG网站通路层级分类方法将这些通路进行分类。
1.6.3基于蛋白功能富集的聚类分析 基于不同分组的差异表达蛋白/miRNA功能富集的聚类分析用于研究其在特定功能(GO,KEGG通路)上存在的潜在联系和差异。首先收集所用蛋白/miRNA分组富集到的功能分类信息和对应的富集P值,然后筛选出至少在一个蛋白/miRNA分组中为显著富集(P<0.05)的功能分类。
1.6.4蛋白互作网络分析 将不同比较组中筛选得到的差异表达蛋白数据库编号或蛋白序列,通过与STRING(v.10.5)蛋白网络互作数据库比对后,按照confidence score >0.7 (high confidence)提取得到差异蛋白互作关系。然后通过R package “networkD3”工具对差异蛋白互作网络进行可视化展示。
1.7双荧光素酶报告基因检测 通过PCR分别扩增出可与miR-423-5p结合的circRNA_0008259序列以及包含miR-423-5p靶区的CTSD基因的3′UTR序列,将获得的序列分别插入pmirGLO质粒(日本Promega公司)以获得pmirGLO-circ-WT双荧光素酶载体以及CTSD-3′UTR-WT双荧光素酶报告载体。并分别构建pmirGLO-cir突变型载体(pmirGLO-cir-Mut)和CTSD-3′UTR的突变型载体(CTSD-3′UTR-Mut)。将细胞接种并培养在24孔培养板中,以达到约70%的融合。将miR-423-5p类似物和CTSD-3′UTR-WT(pmirGLO-circ-WT)载体或者CTSD-3′UTR-Mut(pmirGLO-cir-Mut)载体共转染至细胞。转染48 h后,使用双荧光素酶报告基因分析试剂盒(BioVision,Milpitas,CA,USA)在光度计上测定萤火虫和肾素荧光素酶活性。
1.8统计学处理 对于本研究中进行的实验,至少进行了3次独立的实验。通过Student′t检验分析实验组之间的统计学显著性,并确定P<0.05为差异有统计学意义。
2 结果
2.1瘢痕疙瘩成纤维中受circRNA_0008259调控的miRNAs circRNA_0008259过表达组与对照组相比,共有48个差异表达的miRNAs, 其中上调的20个,下调的28个(图1,倍数≥2,P<0.05)。GO聚类分析显示差异表达的miRNA参与多种生物过程,包括胞浆功能、Ⅰ型胶原蛋白等。KEGG通路分析表明,这些差异表达的miRNAs参与一些生物通路,包括代谢通路、癌症相关通路等(图2)。
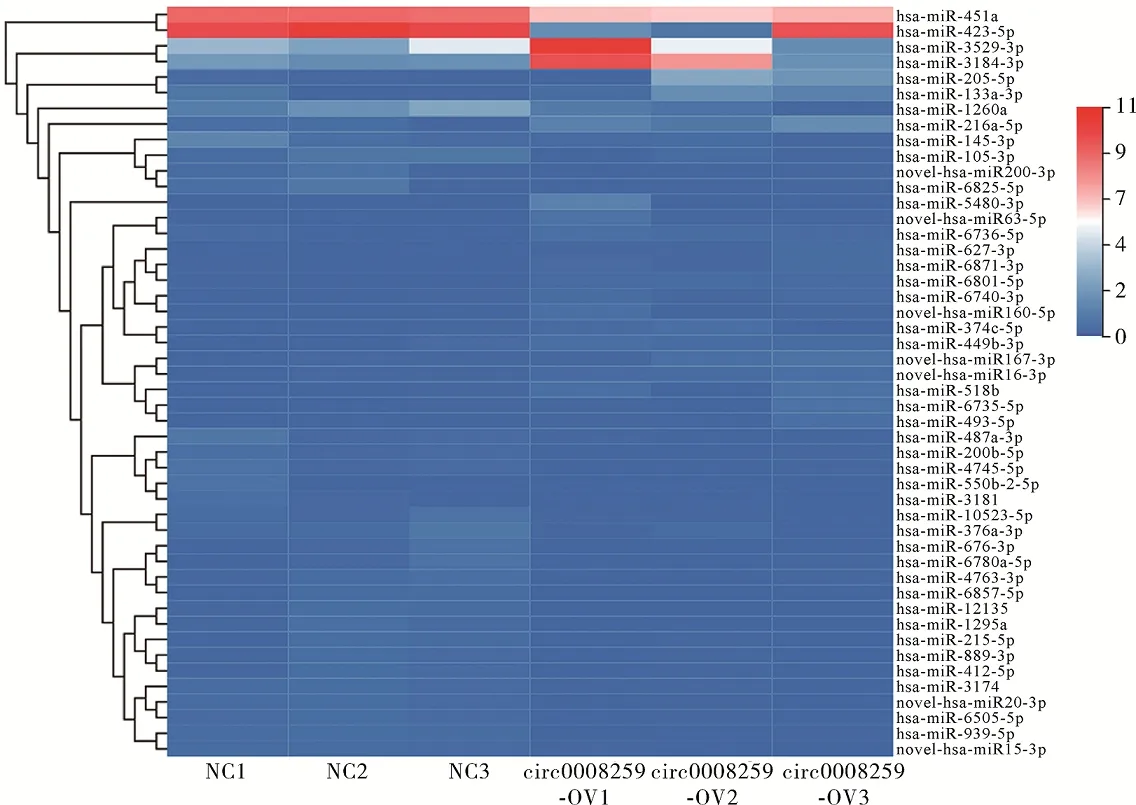
Note:The heatmap of hierarchical grouping shows the miRNA expression profile;the red shows up-regulated miRNAs and the blue shows the down-regulated miRNAs.图1 circRNA_0008259过表达与对照组之间差异表达miRNAs的表达谱Fig.1 circRNA expression profile of differentially expressed miRNAs between circ0008259-overexpression group (circ0008259-OV) and control group (NC)

Note:*P<0.05, **P<0.01. The top 20 GO enrichmentterms,the parental genes of differentially expressed miRNAs were analysed by GO assessment (|Fold Change| ≥ 2, P< 0.05); qRT-PCR was used to detect the expression level of 6 candidates miRNAs; The top 20 KEGG pathways enrichment terms,KEGG pathways assessment was conducted on the parental genes of differentially expressed miRNAs (|Fold Change| ≥ 2, P < 0.05); Double luciferase reporter assays (DLR), miR-423-5p (miR-423-5p mimics), miR control (miR-423-5p control)图2 circRNA_0008259过表达与对照组之间差异表达miRNAs的生物信息学分析及qRT-PCR验证Fig.2 Bioinformatic analyses and qRT-PCR verification of differentially expressed miRNAs between circ0008259-overexpression group (circ0008259-OV) and control group (NC)
2.2对受 circRNA_0008259调控的下游miRNAs 进行验证 5种miRNA的表达水平在circRNA_0008259过表达组中都是下调的,其中miR-423-5p在过表达的circRNA_0008259中下调10.05倍(t=7.70,P<0.01),miR-889-3p下调12.93倍(t=7.93,P<0.01), miR-451a下调1.94倍(t=3.01,P<0.05), miR-200-5p下调1.85倍(t=3.08,P<0.05), miR-676-3p下调2.45倍(t=6.22,P<0.01),见图2b。鉴于miR-423-5p在circRNA_0008259过表达后下调非常显著,且其在KFs中的含量最丰富。与对照组相比,共转染miR-423-5p类似物(mimics)和pmirGLO-circ-WT的细胞的荧光素酶活性显著降低(t=6.07,P<0.01),而共转染miR-423-5p类似物和pmirGLO-circ-Mut的细胞荧光素酶活性差异无统计学意义(t=2.38,P>0.05),见图2d。
2.3KFs中受circRNA_0008259 调控的蛋白 总共鉴定出6 571个蛋白质,在circRNA_0008259过表达后,其中倍数≥1.2倍差异的有103种蛋白,倍数≥1.3倍差异的有40种蛋白(P<0.05)。在这40种差异表达的蛋白中,6种表达下调,其中包括Ⅰ型胶原蛋白(COL1A1),34种表达上调(图3a)。
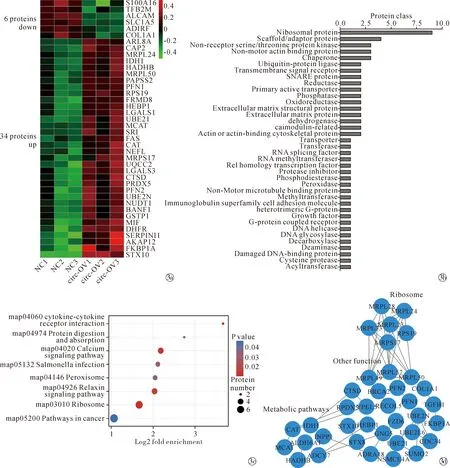
The heatmap shows the protein expression profile of differentially expressed proteins,the red shows up-regulated proteins and the green shows the down-regulated proteins; The differentially expressed proteins were classified into 38 classes by the PANTHER classification system; The KEGG pathways enrichment terms (|Fold Change| ≥ 1.2, P<0.05); The PPI (protein-protein interaction) network图3 circRNA_0008259过表达与对照组之间差异表达蛋白的生物信息学分析Fig.3 Bioinformatic analyses of differentially expressed proteins between circ0008259-overexpression group (circ-OV) and control group (NC)
2.4circRNA_0008259调控蛋白的生物信息学分析与验证 103种差异表达的蛋白质按照PANTHER分类,被分为38种蛋白质类别,其中前5类为核糖体蛋白(9种蛋白质)、支架/接头蛋白(4种蛋白质)、非受体丝氨酸/苏氨酸蛋白激酶(3种蛋白质)、非运动肌动蛋白结合蛋白(3种蛋白质)和伴侣蛋白(3种蛋白质),见图3b。此外,KEGG途径分析显示,这些差异表达的蛋白质参与一些基本的生物途径,包括蛋白的消化和吸收、核糖体以及癌症相关通路等(图3c)。103个差异表达蛋白中有38个参与了STRINTG数据库中的PPI网络,在功能上与代谢通路和核糖体有关(图3d),提示许多受circRNA_0008259调控的蛋白质倾向于相互作用并共同发挥其功能。与对照组相比,在circRNA_0008259过表达组中差异有统计学意义的有6种(CTSD、PFN1、PRDX5、COL1A1、SLC1A5和SRI),见表1。
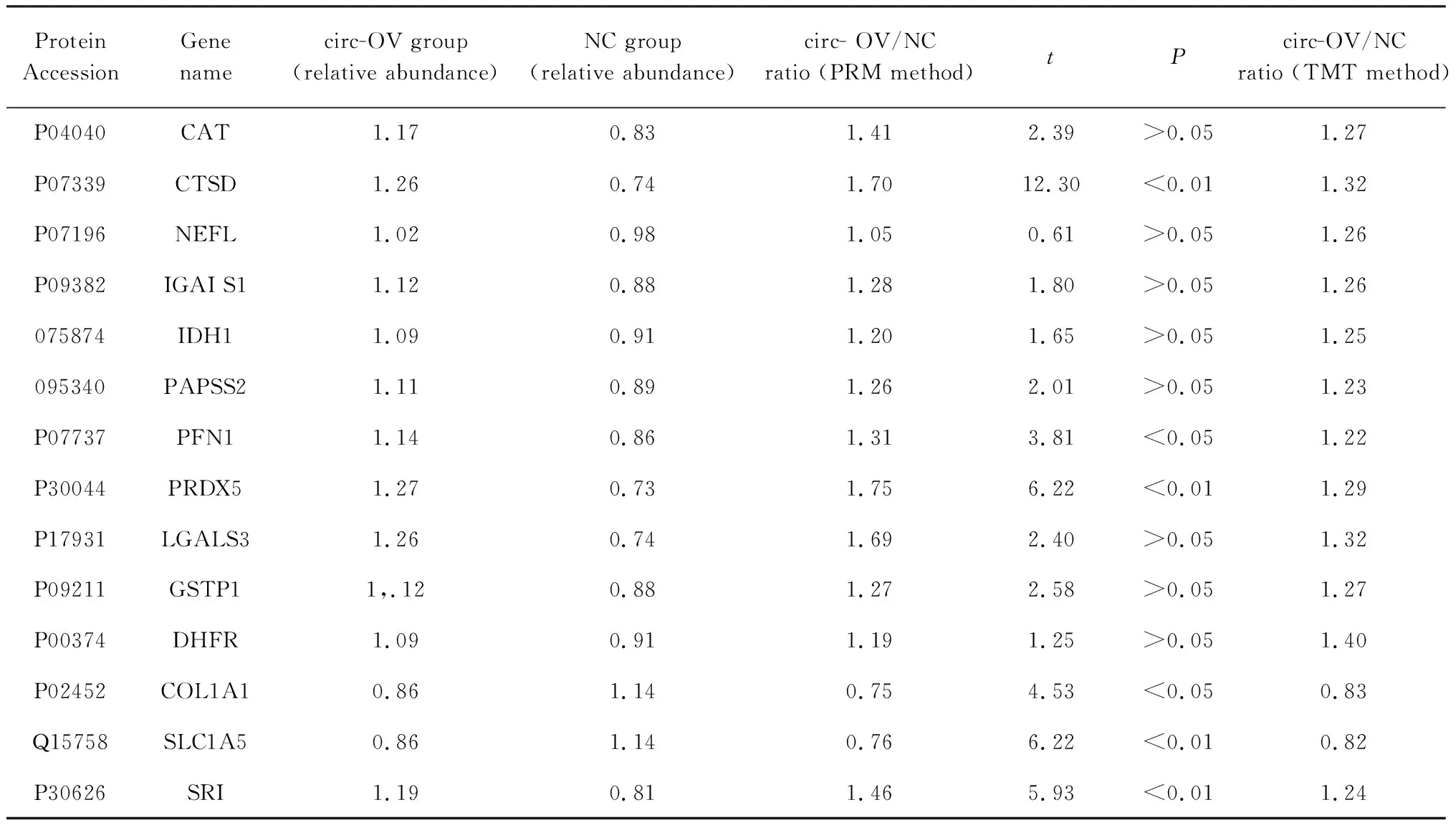
表1 PRM法验证circRNA_0008259过表达组(circ-OV)与对照组(NC)之间的差异表达蛋白Tab.1 Validation of differentially expressed proteins between circ0008259-overexpression group (circ-OV) and control group (NC) using PRM method
2.5预测并验证miR-423-5p的下游靶基因 经iTRAQ和PRM验证的6种蛋白中,CTSD(Cathepsin D,组织蛋白酶D)具有能与miR-423-5p结合的位点(图4a)。与对照组相比,共转染miR-423-5p类似物和CTSD-3′UTR-WT的细胞的荧光素酶活性显著降低(t=3.90,P<0.05),而共转染miR-423-5p和CTSD-3′UTR-Mut的细胞荧光素酶活性差异无统计学意义(t=2.08,P>0.05),见图4b。这些结果表明,miR-423-5p可直接靶向结合CTSD基因的3′UTR端。

Note:*P<0.05. The binding sites of miR-423-5p with its target gene was predicted by targetscan software; Double luciferase reporter assays (DLR),miR-423-5p (miR-423-5p mimics), miR Control (miR-423-5p control图4 miR-423-5p下游耙基因的生物信息学预测及DLR验证Fig.4 The target gene of miR-423-5p was predicted by bioinformatic method and verified by DLR
3 讨论
circRNA被认为可通过“海绵吸附”miRNA,从而抑制miRNA的功能以起到调控细胞生物学功能的作用[6]。本研究首先采用RNA测序的方法筛选出受circRNA_0008259调控的miRNAs,然后通过qRT-PCR验证,证实miR-423-5p在circRNA_0008259过表达后明显下调,且含量丰富,故其最可能受circRNA_0008259调控,并通过DLR证实circRNA_0008259与miR-423-5p的结合。接着,采用基于TMT/iTRAQ的定量蛋白质组学的方法筛选出受hsa_circ_0004872调控的蛋白,并使用PRM法进行验证,验证结果与iTRAQ一致,说明检测结果的可靠性。最后结合蛋白质组学结果及生物信息学软件预测CTSD可能为miR-423-5p的下游靶点,并通过DLR证实。以上研究结果提示过表达hsa_circ_0004872可能通过抑制miR-423-5p,从而上调CTSD,最终下调Ⅰ型胶原蛋白的表达。
有研究报道miR-423-5p在多种肿瘤的发生、发展、转移中起着重要的作用。例如:研究[7]证实miR-423-5p通过抑制ING-4在胶质瘤组织中作为癌基因发挥作用,并提示其对胶质瘤具有治疗潜力。口腔鳞状细胞癌术后唾液样本中观察到miR-423-5p表达显著降低,提示其可能的癌症特异性来源,miR-423-5p特别有希望用于口腔鳞状细胞癌高危人群的筛查/随访,并有助于术前预后评估[8]。还有研究[9]发现,肿瘤相关成纤维细胞分泌的外泌体miR-423-5p通过TGF-β信号通路靶向GREM2,促进前列腺癌的化疗抵抗。笔者前期研究已经证实hsa_circ_0004872可调控KFs细胞Ⅰ型胶原蛋白的表达,且本研究发现miR-423-5p在hsa_circ_0004872过表达后显著下调,故提示其可能对KFs的调控起作用。
瘢痕疙瘩被认为是一种具有肿瘤倾向的疾病[10]。虽然瘢痕疙瘩由于缺乏自发发生和转移而未被常规归类为真正的肿瘤,但经常表现出各种癌症样特征,如不受控制的增殖、浸润周围组织以及缺乏自发消退的能力[11]。这种特征与瘢痕疙瘩中成纤维细胞增生以及产生过多的Ⅰ、Ⅲ型胶原蛋白有关[10]。目前的研究[12-13]已经证实Ⅰ、Ⅲ型胶原蛋白增多是瘢痕疙瘩形成的重要环节,瘢痕疙瘩组织中大量Ⅰ、Ⅲ型胶原蛋白沉积。瘢痕疙瘩切除后立即注射曲安奈德(治疗瘢痕疙瘩的一线药物)可诱导Ⅰ型胶原蛋白基因表达下调。瘢痕疙瘩基质中最初过度产生的Ⅲ型胶原被Ⅰ型胶原取代,导致后期Ⅰ型与Ⅲ型胶原的比例高达17∶1[14]。另外研究[15]还发现,miRNAs等非编码RNA参与了瘢痕疙瘩Ⅰ、Ⅲ型胶原蛋白表达的调控。
本研究发现过表达hsa_circ_0004872后Ⅰ型胶原蛋白表达水平下调(1.21倍),而Ⅲ型胶原蛋白水平轻微下调(<1.2倍,结果未展示)。结合miRNA测序及PCR验证结果,笔者推测在KFs中,过表达circRNA_0008259可能通过海绵吸附作用抑制miR-423-5p,进而上调下游的靶基因,最终调控Ⅰ、Ⅲ型胶原蛋白表达。采用生物信息学预测及结合蛋白质组学方法,推测CTSD是miR-423-5p的下游靶基因,并通过DLR证实了miR-423-5p能与CTSD结合。
CTSD是一种天冬氨酸蛋白酶,存在于典型的酸液泡室(即内体和溶酶体)[16]。CATD通常会导致溶酶体中的蛋白质在酸性pH下降解,并在内质体中形成成熟的活性肽。组织蛋白酶D可以内切割天然牛Ⅰ型胶原的铝链,能溶解完整结缔组织纤维中的胶原蛋白。此外,有研究[16-17]报道CTSD在肿瘤转移、神经退行性疾病等中也有重要作用。有研究发现CTSD与乳腺癌细胞的浸润和转移有关。还有研究[17]观察到反义寡核苷酸和shRNA分别抑制MCF7和MDA-MB-231细胞中的组织蛋白酶D,能减少其通过基质凝胶的侵袭。CTSD在肿瘤中发挥作用的机制,包括降解胶原蛋白等细胞外基质以允许肿瘤细胞的侵袭[18]。
本研究探讨了hsa_circ_0004872影响KFs中Ⅰ型胶原蛋白表达的分子机制。笔者推测过表达hsa_circ_0004872通过与miR-423-5p结合,进而上调CTSD,最终抑制瘢痕疙瘩Ⅰ型胶原蛋白表达,为瘢痕疙瘩的发病机制和治疗提供线索和手段。然而,后续还需进一步采用挽救实验等细胞功能实验、hsa_circ_0004872与miR-423-5p细胞内共定位、动物实验等方法进一步证实hsa_circ_0004872调控瘢痕疙瘩Ⅰ型胶原蛋白表达的机制。

