T-2毒素免疫毒性分子机制的研究进展①
王弘瑞 赵丽娟 房明丽 杨 明 (吉林大学基础医学院分子生物学教研室,长春 130021)
T-2 毒素是由多种镰刀菌产生的单端孢霉烯族类化合物之一,是一种毒性极强的倍半萜烯类真菌毒素。联合国粮农组织(FAQ)和世界卫生组织(WHO)已将T-2毒素确定为能够在自然条件下污染的最危险的污染物之一[1]。T-2 毒素广泛分布于自然界,能够污染食物和饲料,对人、畜危害较大。食入被T-2 毒素污染的食物后会引发呕吐、腹泻、共济失调,严重者引发休克甚至死亡[2]。T-2毒素还具有较强的免疫毒性,长期低量摄入机体可导致血液及淋巴系统受到侵害,造成内分泌紊乱及免疫功能下降等不良反应[3]。近年来,越来越多的研究表明,T-2毒素的免疫毒性与氧化应激、凋亡以及自噬等机制有关[4]。T-2 毒素不仅可以激活多条信号通路来调节免疫反应和凋亡相关分子的表达;还被发现与“免疫逃逸”有一定相关性,可促进病原体逃避宿主的免疫应答。本文对T-2 毒素的免疫毒性机制的研究进展进行归纳总结,旨在为其后续研究提供参考。
1 T-2毒素的基本特征及其免疫毒性
T-2 毒素是分子式为C24H34O9的一种倍半萜类化合物,正常条件下呈白色粉末或针状的结晶状态,性质稳定,在常温条件下能够保存6~7 年。T-2毒素对包括植物、动物和人类在内的几乎所有真核生物都有毒性作用,其结构中的C12和C13环氧环是首要的毒性和活性官能团,当环氧环结构受到破坏时,其毒性作用会被大大降低。此外,T-2 毒素的毒性强度可被某些真菌和酶所改变[5]。目前,检测T-2毒素的主要方法为免疫检测。有研究者采用T-2 毒素单克隆抗体联合化学发光酶联免疫法,不仅灵敏度高且与其他毒素无交叉反应,此外胶体金法也可以用于检测T-2 毒素,仅需4 min 就可以实现食品中T-2毒素的半定量快速检测[6-7]。
T-2 毒素具有多种毒性作用,并以各种方式对动物的组织和器官产生有害作用。免疫毒性是T-2毒素最重要的毒性之一,其不仅能够损害固有免疫反应,还能对获得性免疫反应产生一定影响[8]。T-2毒素的免疫毒性具有时间依赖性和剂量依赖性的特点,根据T-2 毒素对动物的免疫剂量、免疫频率以及免疫时间的不同,其效应可分为免疫刺激和免疫抑制[9]。当T-2 毒素处于低剂量水平时,其可作为一种免疫刺激剂,增加血清中抗体IgA 和IgE 的浓度,诱导炎症细胞因子、TNF-α、IL-1β 和IL-6 的表达[10]。最近的一项研究表明,单剂量的T-2 毒素可以增强小鼠脾脏内的免疫反应,并使小鼠过表达miR-155-5p,从而介导炎症因子的产生[11]。此外,在中华绒螯蟹幼蟹的肝胰腺中,T-2 毒素的感染可以激活细胞内核因子κB(NF-κB)的信号通路[12]。而当T-2 毒素处于高剂量水平时,则可作为一种免疫抑制剂。高剂量的T-2 毒素抑制淋巴细胞增殖、诱导淋巴细胞凋亡及抗原特异性分化,从而损伤淋巴结、胸腺、骨髓等免疫器官和组织,降低了机体的免疫能力。T-2 毒素的免疫抑制作用不仅会使宿主对病原菌的抵抗力降低,还能降低机体通过接种疫苗获得的免疫效果[13]。研究发现如果猪食用T-2 毒素污染的饲料后,其对猪繁殖率与呼吸综合征病毒(PPRRSV)活疫苗的免疫效果及保护率均会受到显著影响[14]。
2 T-2毒素免疫毒性的分子机制
T-2 毒素可介导活性氧(ROS)活化、脂质过氧化、炎症因子表达及表皮细胞凋亡从而导致皮炎的发生[15]。不仅如此,T-2 毒素还可以干扰肠道屏障及血脑屏障功能,影响肠道内的免疫应答和大脑神经递质的水平,从而诱导氧化应激、DNA 损伤及线粒体功能障碍。此外,T-2 毒素还能增强小鼠胚胎的自噬能力,从而损害胚胎的正常发育[16]。T-2 毒素的免疫毒性的分子机制由多种信号通路来介导,从而调节机体免疫反应和细胞凋亡相关信号的表达,这些信号分子决定着细胞的命运。然而,这些信号通路相关分子之间的相互作用特别复杂,因此,本文将从氧化应激、自噬、凋亡以及免疫逃逸几方面对T-2 毒素的免疫毒性的分子机制进行详细阐述,见图1。
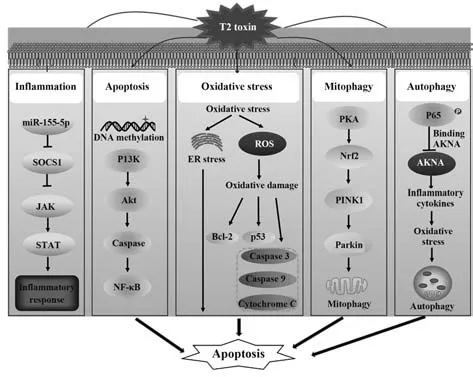
图1 T-2毒素免疫毒性的分子机制图Fig.1 Molecular mechanism of immunotoxicity of T-2 toxin
2.1 氧化应激 T-2 毒素最重要的毒性机制之一是氧化应激。T-2 毒素可通过激活多条信号通路和抑制免疫反应等途径来诱导氧化应激。线粒体是细胞产生活性氧的重要组成部分,T-2 毒素诱导的线粒体功能障碍与氧化应激密切相关。如T-2 毒素增加了活性氧和线粒体细胞色素C 的释放,并激活了半胱氨酸天冬氨酸蛋白酶9(caspase-9)和cas‐pase-3。T-2毒素可与核糖体60S亚基的肽基转移酶活性中心结合,从而诱导RNA 活化的蛋白激酶R(PKR)和造血细胞激酶(HCK)的表达,使核糖体发生核毒性应激反应(RSR),进而激活丝裂原活化蛋白激酶(MAPK),诱导细胞因子基因表达和细胞凋亡,甚至还可导致感染T-2 毒素的动物生长迟缓。T-2 毒素也可直接激活细胞外信号激酶(ERK)、c-jun 氨基末端激酶炎症(JNK)和p38 等MAPKs 家族成员,并在人神经母细胞瘤细胞中促进ERK 信号通路中Grb2、Ras、Raf 及其下游的转录因子c-fos 和c-jun 的表达上调。除此之外,线粒体介导的氧化应激通路、caspase 介导的凋亡通路、JAK/STAT 通路、cAMP 通路及NOD2 通路都被报道与T-2 毒素的免疫抑制功能有关。
T-2 毒素能够激活ROS,增加脂质过氧化和氧化应激,从而导致细胞凋亡[17]。具体地说,ROS 的积累可能导致氧化损伤,导致线粒体功能障碍和DNA 的损伤。同时,活性氧作为细胞信号分子,也可以诱导细胞凋亡和自噬[18]。如T-2 毒素能导致活性氧的积累进而引起肝细胞的氧化损伤,并通过上调线粒体中与细胞免疫、细胞增殖和脂质代谢相关的蛋白质的表达来发挥其毒性作用[19-20]。低浓度的T-2 毒素还可以引起植物体内ROS 的积累,从而改变宿主的免疫力[21]。在另一项研究中,研究者通过斑马鱼模型评估了T-2 毒素的发育毒性和免疫毒性,并进一步证明该毒素发育毒性的重要机制与T-2毒素诱导的氧化应激和细胞凋亡有关[22]。此外,T-2毒素还可以通过氧化应激引起与生殖细胞凋亡相关的生精障碍,从而破坏男性的生殖功能[23]。因此,未来需要进一步明确一些与氧化应激相关的信号通路及上下游分子,以寻找更多的方法来降低T-2毒素的免疫毒性。
2.2 细胞自噬 越来越多的研究报道了自噬在T-2毒素的免疫毒性机制中发挥重要的调节作用。自噬可保护Wistar 大鼠原代培养的心肌细胞免受T-2毒素的细胞毒作用,而硒元素的缺乏可降低自噬的保护性作用,加重T-2 毒素所致的损伤[24]。另一项关于T-2 毒素对线粒体的细胞毒作用的研究表明,通过蛋白激酶A(PKA)/核红系相关因子2(Nrf2)/PINK1/Parkin 通路可以调节T-2 毒素诱导的线粒体自噬,提高细胞质和线粒体的特异抗氧化活性,从而降低该毒素对大鼠垂体瘤细胞(GH3)的氧化应激和毒性,保护GH3 细胞[25]。总的来说,自噬似乎是机体抵御T-2 毒素感染过程中发生的主要事件,对细胞损伤起保护作用。自噬除了在保护细胞方面发挥关键作用外,对细胞死亡也很重要。据报道,在氧化应激条件下,T-2 毒素的细胞毒作用会诱导虾的肝胰腺细胞的自噬和凋亡[26]。因此,自噬不能简单地抑制T-2 毒素诱导的细胞凋亡。人们推测,T-2 毒素促进细胞自噬的发生取决于T-2 毒素的剂量和作用时间,而决定T-2 毒素最终诱导细胞死亡还是存活则是进一步取决于这些过程与其他信号通路之间的相互作用。目前,自噬在免疫毒性中的调节是极其复杂的,关于T-2 毒素调节自噬的机制的研究还不够深入,需要进一步探讨该毒素对自噬和免疫调节的影响。
2.3 细胞凋亡 细胞凋亡与氧化应激及自噬过程都是密不可分的,它们对维持生理稳态平衡和发病机理都至关重要。目前已有多项研究表明T-2 毒素可诱导细胞凋亡的发生。T-2 毒素诱导的氧化应激,积累大量ROS,导致氧化损伤及线粒体功能障碍等,从而介导细胞凋亡的发生。此外,妊娠期大鼠在感染T-2 毒素后会出现胎盘、胚胎干细胞和肝组织中的细胞凋亡,包括肠隐窝上皮细胞、淋巴样细胞、造血组织、睾丸基质细胞和卵巢颗粒细胞的凋亡[27]。在小鼠软骨细胞中,T-2 毒素能够引起软骨细胞内质网和线粒体的损伤,导致Ⅱ型胶原分泌减少,软骨细胞凋亡增加。已证实凋亡抑制蛋白(IAPs)参与了T-2 毒素诱导的Ⅱ型胶原的减少[28]。在小鼠原代骨髓基质细胞中,T-2 毒素能够增强凋亡相关基因caspase-3 的表达,并降低Bcl-2/Bax 比值,诱导细胞凋亡。此外,该毒素还能显著增加细胞炎症因子TNF-α、IL-1β、IL-6 和环氧合酶-2(COX-2)的表达,并激活NF-κB和JNK两条炎症信号通路,影响细胞周期,导致许多高增殖活性的细胞凋亡。这些结果表明T-2 毒素可通过线粒体介导的凋亡途径来诱导细胞凋亡[29]。据报道,T-2 毒素诱导炎症因子表达、组织损伤及凋亡等与DNA 甲基化有关,在T-2毒素感染过程中,DNA甲基化能够沉默Ras相关区域家族蛋白4(RASSF4)的表达,导致苏氨酸蛋白激酶(AKT)/caspase/NF-κB 信号通路及其下游信号通路的激活,引起肝细胞的凋亡[30],从而提示DNA甲基化是T-2 毒素肝毒性的一个潜在机制。综上所述,T-2 毒素可通过抑制蛋白质合成和诱导氧化应激引起的DNA 损伤来刺激caspase 介导的线粒体凋亡途径是诱导细胞凋亡不可或缺的机制。由于自噬和凋亡之间存在着复杂的关系,因此T-2 毒素的毒性机制与自噬和细胞凋亡的关系有待进一步研究。
2.4 免疫逃逸 近年来的研究发现免疫逃逸也与单端孢霉稀族类毒素的免疫毒性机制有关。“免疫逃逸”通常指的是病毒、细菌和癌细胞等通过抗原伪装和调节周围环境来逃避宿主的免疫防御,并伴随着抑制或破坏宿主的免疫反应。在单端孢霉稀族类毒素介导的免疫逃逸过程中,其可改变细胞免疫微环境,降低机体内如IFN-γ、转化生长因子-β(TGF-β)和Toll 样受体(TLRs)等一些重要的免疫反应相关因子的表达水平,从而帮助病原菌和肿瘤细胞来逃避机体的免疫杀伤[31]。如T-2 毒素可抑制呼肠孤病毒感染诱导的IFN-γ 水平,并减少肺泡巨噬细胞的数量,从而降低了宿主对呼肠孤病毒的抵抗力。因此,包括T-2 毒素在内的单端孢霉烯族类毒素可改变宿主免疫系统,使病原体逃避免疫应答,这种作用似乎是通过抑制抗凋亡相关基因(IFNs 和TLRs)的表达实现的,进而促进了氧化应激和细胞凋亡。
3 展望
综上所述,T-2 毒素的理化性质致使其具有易生成、强毒性、难分解等特性,对人和动物机体的损伤作用范围广,能够造成多种毒性作用,其中应重点关注的是对免疫系统的毒性。T-2 毒素的免疫毒性作用是矛盾而复杂的,T-2 毒素能够通过氧化应激、细胞自噬和多种信号通路诱导细胞的凋亡。因此,通过对T-2 毒素的免疫毒性作用及其诱导细胞凋亡机制的阐述,为今后对T-2 毒素毒性作用机制的深入研究、解毒方法、治疗技术与科学检测等提供参考。