细胞焦亡在急性CO中毒迟发性脑病中的作用机制研究①
扶 猛 严 湘 夏 欢 李 霜 李经伦 (西南医科大学附属医院神经内科,泸州 646000)
一氧化碳(CO)是碳化合物不完全燃烧(氧化)的产物,长时间暴露于CO 中会导致持久性神经系统后遗症和延迟性神经系统后遗症,且致死率高。急性CO 中毒后,13%~50%的患者会经历2~60 d 的假愈期,再逐渐发展为以智力受损、行为障碍等为主要表现的脑功能障碍性疾病,被命名为急性一氧化碳中毒迟发性脑病(delayed encephalopathy after acute carbon monoxide poisoning,DEACMP),其发病机制尚在进一步研究中[1]。细胞焦亡是一种由cas‐pase-1介导的新型细胞死亡形式,在微生物、应激和损伤信号的刺激作用下,炎症小体识别上述刺激信号后导致caspase-1 直接激活,诱导促炎细胞因子的分泌和细胞焦亡的发生[2]。研究证明,caspase-1与脑出血、缺血再灌注损伤、败血症脑病等许多中枢神经系统疾病的发生紧密相关[3-5]。但细胞焦亡与DEACMP 是否有关未见报道。因此本研究拟通过分次腹腔注射CO 气体法建立大鼠迟发性脑病模型,通过分析大鼠染毒前后行为学改变及检测焦亡相关因子NLRP3、caspase-1、GSDMD 蛋白及炎症因子IL-1β、IL-18等动态变化探讨细胞焦亡与DEACMP的关系。
1 材料与方法
1.1 材料 120 只雄性SD 大鼠(250~300 g),动物许可证:SCXK(川)2020-030,由成都达硕实验动物有限公司提供。纯度为99.9%的CO 气体由西南化工研究所提供;Morris 水迷宫跟踪分析系统由西南医科大学公共卫生学院提供;caspase-1 特异性抑制剂Ac-YVAD-cmk(货号:GC42721-1)购自广州吉英生物科技有限公司;显微镜购自OLYMPUS;兔源caspase-1 抗体(货号:DF6148)购自Affinity;苏木素染液(货号:AS1055A)购自ASPEN;伊红染液(货号:AS1094)购自ASPEN;抗NLRP3 抗体(货号:ab263899)、抗GSDMD 抗体(货号:ab219800)购自Abcam;抗cleaved-caspase-1 抗体(货号:AF4005)购自affbiotech;DAB显色试剂盒(货号:ZLI-9033)购自北京中杉金桥生物技术有限公司;大鼠IL-18 ELISA试剂盒(货号:ELK2270)、大鼠IL-1β ELISA 试剂盒(货号:ELK1272)购自ELK Biotechnology。
1.2 方法
1.2.1 实验分组 120只雄性SD大鼠,经水迷宫实验筛选无认知功能障碍,随机分为:空气组(K 组)、CO 中毒组(CO 组)、CO+caspase-1 特异性抑制剂Ac-YVAD-cmk组(cmk组),每组40只;各组再按照染毒时间顺序均分为第1、3、7、14、21天5个亚组。
1.2.2 实验建模 DEACMP 模型的建立采用分次腹腔注射CO 气体法[6-7]。大鼠称重后标记组别、序号,CO组及cmk组大鼠经腹腔注射CO气体,首次剂量为100 ml/kg,造模后每隔4 h 追加1 次,追加量按50 ml/kg 计算,共追加3 次,死亡大鼠严格按照上述造模方式补齐。K 组大鼠按上述方法注射相同体积的空气。cmk 组大鼠于制备DEACMP 模型0.5 h 前腹腔注射Ac-YVAD-cmk(1 mg/只),造模后隔天注射1 次,直至造模结束。染毒后16 h 内反复抽取中毒大鼠股动脉血,用血气分析仪测量碳氧血红蛋白(HbCO)浓度。
1.2.3 Morris 水迷宫实验 大鼠饲养于西南医科大学城北动物实验中心,饲养温度20~25 ℃,湿度适宜,光照良好,昼夜节律分明。实验前对大鼠进行水迷宫测试训练,连续5 d,每天训练4 次,筛选出认知功能差的大鼠。染毒后各时间点,分别于4 个象限标记点将大鼠头朝池壁放入,记录大鼠在水迷宫之中找到平台象限的时间,即逃避潜伏期,记录4个象限逃避潜伏期的均值,重复4 次,取4 次测试的均值作为大鼠的最终逃避潜伏期时间。取走平台,测试大鼠在120 s 内分别从4 个象限中放入池壁后穿越平台所在象限的次数,即空间探索能力,以相同的实验方法记录大鼠的穿越平台次数,取均值进行比较。
1.2.4 组织标本取材 各组大鼠在实验完成后按时间点进行取材送检,部分大鼠在有效麻醉后固定于操作台,充分暴露胸腹部,先后以生理盐水及4%多聚甲醛经左心室灌注固定,灌注成功的标志为大鼠四肢、舌头、肝脏变白和身体僵硬,断头取大鼠海马组织置于适量甲醛溶液中,4 ℃冰箱中保存,用于染色;另一部分大鼠直接断头处死,并于冰面上尽快分离得到新鲜海马组织,用于Western blot 及ELISA检测。
1.2.5 HE 染色观察细胞形态 新鲜组织甲醛固定、修整,梯度乙醇脱水,组织浸蜡进行包埋并贴上标签,待蜡凝固后再次进行修整并置于石蜡切片机上切片,乙醇脱蜡至水,苏木素染液染细胞核约5 min,伊红染液染细胞质约3 min,封片观察海马神经元细胞形态。
1.2.6 Western blot检测NLRP3、cleaved-caspase-1、GSDMD 蛋白的表达 取已准备好的海马组织,分离、剪碎,冰浴并彻底匀浆后提取脑组织总蛋白,相关蛋白浓度测定采用BCA 法。蛋白样品经凝胶电泳,转膜、封闭,加入一抗,4 ℃下孵育过夜,TBST 反复漂洗3次,加入二抗,室温孵育。洗涤后进行化学发光检测,目标带的光密度值用AlphaEaseFC 软件处理系统分析。
1.2.7 免疫组织化学染色检测caspase-1 阳性细胞表达 已准备好的海马标本经切片、脱蜡至水,抗原修复处理等,冷却至室温。PBS 洗涤,每次5 min;室温下浸于3%H2O2溶液中;再洗涤。甩干,5%BSA 封闭;4 ℃下滴入一抗过夜;PBS 洗涤,滴入二抗,37 ℃下孵育;再次经PBS 洗涤,显微镜下观察。冲洗、苏木素复染、分化,再次冲洗后乙醇脱水干燥,光学显微镜下观察,找到被染成黄褐色或棕黄色细胞即为阳性细胞。
1.2.8 ELISA 检测IL-1β及IL-8蛋白水平 取大鼠海马组织上清液,按照大鼠IL-1β、IL-18 ELISA 试剂盒说明书步骤测定IL-1β、IL-18 蛋白水平。酶标板孔中加入100µl 已稀释的标准品和待测样本,盖上封板膜,轻轻混匀后37 ℃孵育1 h,甩干孔内液体,每孔加入300µl 洗液,洗涤3 次,拍干水分后每孔加入亲和链霉素-HRP 50 µl,37 ℃孵育30 min,重复上述洗涤步骤3 次,每孔加入显色剂A、B 各50 µl,37 ℃避光孵育30 min,迅速加入50 µl 终止液,酶标仪测定450 nm波长处各孔的OD 值,按标准品所得的标准曲线计算各样本的IL-1β、IL-18浓度。
1.3 统计学处理 计量资料用±s表示,统计数据分析使用SPSS26.0 软件。各组数据均经正态性和方差齐性检验,多组均数间数值比较采用单因素方差分析,组间两两比较采用LSD 法,P<0.05 表示差异有统计学意义。
2 结果
2.1 大鼠中毒后行为变化及股动脉血HbCO 浓度测量 多数大鼠在腹腔注射CO 气体后表现出焦躁不安、活动增加、胡乱冲撞,四肢皮肤及唇部呈现樱桃红色;少数大鼠出现动作减少、萎靡不振、眼神涣散、四肢无力。逐渐补打CO 气体过程中发现大鼠死亡率升高,部分大鼠还出现肢体抽搐、昏迷、大小便失禁、角弓反张状态等,死亡大鼠在相同环境下及时予以造模补充。16 h 内CO 组及cmk 组大鼠股动脉血HbCO浓度均>50%。
2.2 Morrris 水迷宫实验 水迷宫实验数据分析显示,直至染毒第7天,各组大鼠逃避潜伏期及穿越平台次数的差异均无统计学意义(均P>0.05,表1、表2)。但染毒14 d、21 d 后观察大鼠,CO 组及cmk组逃避潜伏期较K组延长(表1),穿越平台次数较K组少(表2),差异均有统计学意义(均P<0.05)。值得注意的是,染毒第14 天及第21 天,cmk 组大鼠逃避潜伏期短于CO 组,且穿越平台次数多于CO 组,差异均有统计学意义(均P<0.05)。
表1 3组大鼠各时间点逃避潜伏期比较(±s,n=3)Tab.1 Comparison of escape latency at each time point between three groups of rats(±s,n=3)
Note:Compared with K group,1)P<0.05;compared with CO group,2)P<0.05;compared with 1 d,3 d,7 d in CO group,3)P<0.05.
21 d 12.52±0.48 26.03±0.731)3)21.52±1.001)2)241.79<0.01 Groups K CO cmk F P 1 d 12.54±0.43 12.48±00.39 12.52±0.49 0.02 0.983 3 d 12.57±0.40 13.20±0.59 13.06±0.0.32 1.61 0.28 7 d 12.70±0.31 13.49±0.90 13.34±0.98 0.84 0.48 14 d 12.51±0.49 25.93±0.531)3)21.16±0.571)2)492.85<0.01
表2 3组大鼠各时间点穿越平台次数比较(±s,n=5)Tab.2 Comparison of number of platform crossing at each time point between three groups of rats(±s,n=5)
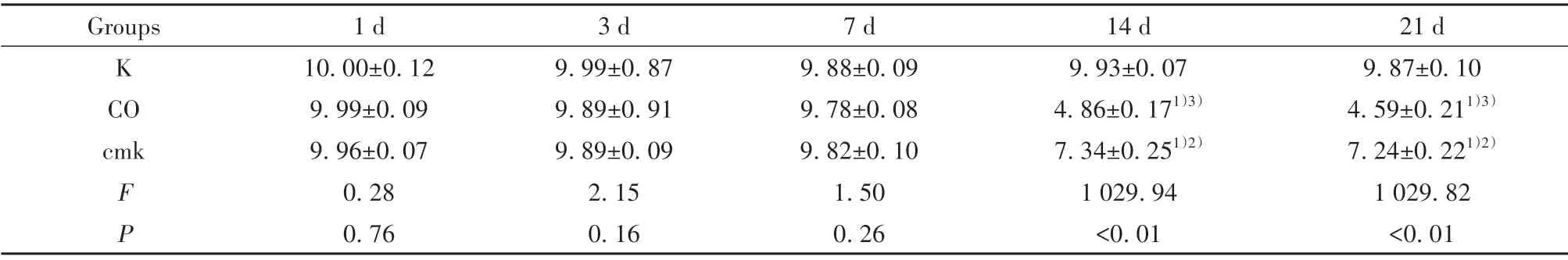
表2 3组大鼠各时间点穿越平台次数比较(±s,n=5)Tab.2 Comparison of number of platform crossing at each time point between three groups of rats(±s,n=5)
Note:Compared with K group,1)P<0.05;compared with CO group,2)P<0.05;compared with 1 d,3 d,7 d in CO group,3)P<0.05.
21 d 9.87±0.10 4.59±0.211)3)7.24±0.221)2)1 029.82<0.01 Groups K CO cmk F P 1 d 10.00±0.12 9.99±0.09 9.96±0.07 0.28 0.76 3 d 9.99±0.87 9.89±0.91 9.89±0.09 2.15 0.16 7 d 9.88±0.09 9.78±0.08 9.82±0.10 1.50 0.26 14 d 9.93±0.07 4.86±0.171)3)7.34±0.251)2)1 029.94<0.01
2.3 HE 染色结果 K 组大鼠海马CA1区神经元细胞形态完好,核膜完整、核仁清晰,细胞着色浅淡,如图1A所示。CO组大鼠海马CA1区神经细胞随着中毒时间延长,细胞核变得固缩、深染,发生变性坏死细胞逐渐增多,如图1B。cmk 组海马CA1 区神经元细胞损伤较CO 组轻,细胞排列较CO 组整齐,细胞之间分界较清晰,如图1C。

图1 14 d时各组海马CA1区HE染色(×400)Fig.1 HE staining of hippocampal CA1 region in each group on 14 d(×400)
2.4 Western blot 检测NLRP3、cleaved-caspase-1、GSDMD 蛋白的表达变化 Western blot 结果显示,K组大鼠中NLRP3、cleaved-caspase-1 及GSDMD 蛋白在各时间点表达差异无统计学意义(均P>0.05,图2)。CO组及cmk组三种蛋白表达变化显著,且具有相似表达趋势,均在染毒后第1 天开始升高,第3 天达到第一次高峰,第7 天有下降,第14 天达到第二次高峰,第21 天表达下降;且染毒第14 天三种蛋白的表达较染毒第3天明显增多,差异有统计学意义(均P<0.05);另外,第14天时CO组及cmk组三种蛋白的表达较K组显著,且CO组三种蛋白的表达较cmk组显著,差异有统计学意义(均P<0.05),见图3。

图2 海马CA1区NLRP3、cleaved-caspase-1、GSDMD 蛋白免疫印迹结果Fig.2 Western blot results of NLRP3,cleaved-caspase-1,GSDMD protein in hippocampal CA1 region

图3 NLRP3/GAPDH、cleaved-caspase-1/GAPDH和GSDMD/GAPDH的灰度比值Fig.3 Gradation ratio between NLRP3/GAPDH,cleavedcaspase-1/GAPDH,GSDMD/GAPDH
2.5 免疫组织化学染色检测海马CA1 区caspase-1表达水平 染毒后14 d 发现,CO 组及cmk 组cas‐pase-1 阳性细胞表达较K 组明显增多(P<0.05),而cmk组阳性细胞表达较CO组减少,差异有统计学意义(P<0.05),见图4、表3。
表3 3组大鼠各时间点caspase-1免疫组化表达数值比较(±s,n=3)Tab.3 Comparison of caspase-1 immunohistochemical expression values at each time point in three groups(±s,n=3)
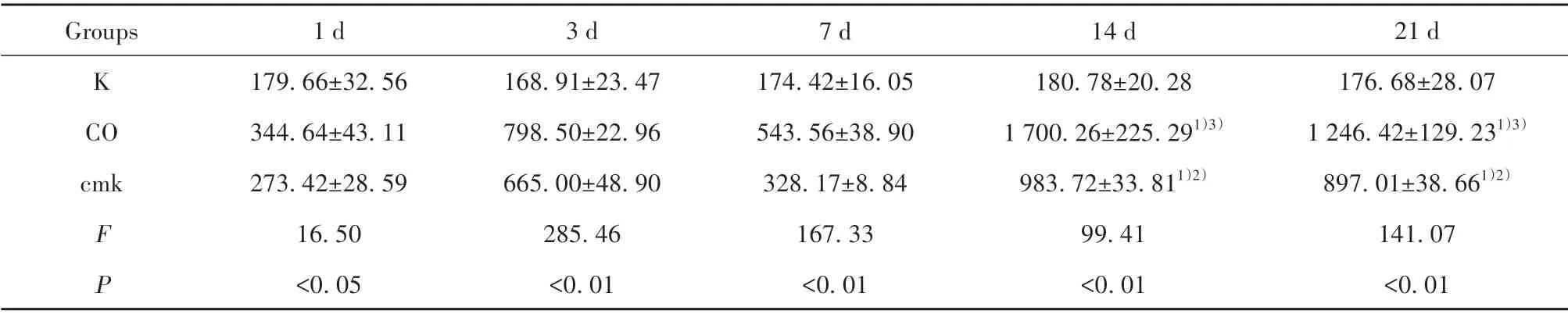
表3 3组大鼠各时间点caspase-1免疫组化表达数值比较(±s,n=3)Tab.3 Comparison of caspase-1 immunohistochemical expression values at each time point in three groups(±s,n=3)
Note:Compared with K group,1)P<0.05;compared with CO group,2)P<0.05;compared with 3 d in CO group,3)P<0.05.
21 d 176.68±28.07 1 246.42±129.231)3)897.01±38.661)2)141.07<0.01 Groups K CO cmk F P 1 d 179.66±32.56 344.64±43.11 273.42±28.59 16.50<0.05 3 d 168.91±23.47 798.50±22.96 665.00±48.90 285.46<0.01 7 d 174.42±16.05 543.56±38.90 328.17±8.84 167.33<0.01 14 d 180.78±20.28 1 700.26±225.291)3)983.72±33.811)2)99.41<0.01

图4 3 组大鼠各时间点海马CA1 区caspase-1 阳性细胞表达Fig.4 Expression of caspase-1 positive cells in hippocam⁃pal CA1 region of rats in three groups at each time point
2.6 IL-1β 及IL-18 含量 CO 组及cmk 组IL-1β 及IL-18 的表达趋势相似,均在第14 天时表达最为显著,如图5。
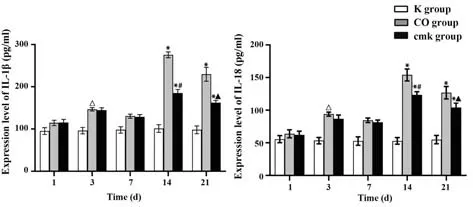
图5 3组大鼠各时间点IL-1β和IL-18表达变化Fig.5 Expression changes of IL-1β and IL-18 at each time point in three groups
3 讨论
COOKSON 等[8]首次提出细胞焦亡的概念,经典焦亡途径依赖于caspase-1 介导。细胞焦亡相关因子在阿尔茨海默病、帕金森病、重度抑郁、多发性硬化等疾病的发病机制中已有一定的研究[9-12]。作为细胞焦亡的效应分子,通常情况下,pro-caspase-1 作为caspase-1 前体存在于细胞中;在各种损伤因素刺激下,pro-caspase-1 在被激活的NLRP3 炎症小体作用下裂解成为caspase-1,活化的caspase-1 随后将GSDMD蛋白裂解为GSDMD-N蛋白,并促进pro-IL-1β及pro-IL-18 成熟与释放,这对机体自我保护作用具有重要意义[13]。被半胱天冬酶切割的底物决定了细胞的死亡性质,而caspase-1 介导的细胞焦亡需要对GSDMD 进行切割,GSDMD 被切割后形成有致焦亡成孔活性的GSDMD-N,GSDMD-N 的成孔机制涉及入膜的剧烈构象变化[14-15]。
人类认知障碍与中枢神经系统炎症反应相关。研究证明,七氟醚引起的术后神经炎症和认知功能障碍可通过ChⅣ干预NLRP3/caspase-1 途径得到改善[16]。佘颜等[17]研究发现,相较于皮质区,细胞焦亡的激活在海马区持续时间更长。因此本文重点从caspase-1 介导的经典焦亡途径出发,分析CO 中毒后各个时间点细胞焦亡在海马的表达情况。
本研究表明焦亡相关蛋白NLRP3、cleaved-cas‐pase-1 和GSDMD 的表达趋势一致,在染毒第1 天开始增加,第3 天达到峰值,第7 天有所下降,染毒第14 天上升到另一峰值,第21 天时再次减少,与ZHANG 等[18]研究相似。发生这种趋势可能的解释是,CO 中毒后急性应激反应致NLRP3、caspase-1、GSDMD 等蛋白在第1~3 天时反应性升高并快速达到高峰,以启动机体固有免疫反应达到保护机体的作用。但染毒后7 d 海马神经细胞焦亡的持续、过度激活的发生,使得焦亡蛋白在染毒第14天又上升到另一峰值并达到最大值,通过时间依赖性诱导后续级联反应导致继发性脑损伤。使用caspase-1 特异性抑制剂Ac-YVAD-cmk 后,cmk 组各时间点焦亡因子表达均低于CO 组,随着细胞焦亡的抑制,也导致IL-1β 和IL-18 的释放减少,减轻了炎症因子所介导的炎症作用,使得cmk组大鼠行为学改变较CO组有所改善。研究表明,海马突触的可塑性可被TNF-α和IL-1β 通过神经元特异性机制直接抑制,而IL-18则通过间接机制导致海马神经元细胞损伤[19]。通过使用IL-1β 功能性抑制剂或IL-1β 受体拮抗剂可减轻大鼠术后学习记忆功能障碍和术后神经炎症[20]。因此,本实验中cmk 组大鼠行为及认知功能改善可能是由于抑制caspase-1 后导致炎症因子释放减少、作用减弱所致。
综上,本实验证明细胞焦亡参与了DEACMP 的发生,中毒早期,焦亡因子反应性升高,快速启动机体固有免疫反应以应对急性损伤。随着时间推移,海马区神经细胞在持续、过度的焦亡激活下发生炎症级联放大反应,导致大鼠行为及认知功能发生改变从而出现迟发性脑病。对细胞焦亡提前进行干预可以在一定程度上改善迟发性脑病大鼠的行为和认知功能,有望在未来成为治疗DEACMP 的新靶点,但其相关机制尚需更深层次的研究探讨。