血清MIP-1α与痛性糖尿病周围神经病变的相关性研究①
马学芹 刘翠明 唐正和 吴融花 董丽华 魏 娟
(山东第一医科大学附属莱钢医院内分泌科,济南 271104)
痛性糖尿病周围神经病变(painful diabetic pe‐ripheral neuropathy,pDPN)又称糖尿病周围神经病理性疼痛,约占糖尿病周围神经病变(diabetic pe‐ripheral neuropathy,DPN)的1/3,以自发性疼痛、痛觉过敏和一定程度感觉缺失为特征,主要临床表现为烧灼样疼痛、针刺痛、电击样疼痛等,夜间疼痛明显,可导致患者睡眠及情感障碍、运动受限等问题,严重影响了患者的日常活动和生活质量[1-3]。目前,引起pDPN 的发病机制主要包括代谢紊乱、自身免疫损伤、氧化应激、炎症反应、血管内皮损伤等,但具体作用机制尚未阐明[4-6]。其中,炎症反应作为免疫功能的一种表现形式,与pDPN 的发生发展密不可分[7-8]。巨噬细胞炎症蛋白-1α(MIP-1α)是一种可将靶细胞吸引到其分泌部位的小分子蛋白质,属于CC 趋化因子家族,能通过与G 蛋白偶联的跨膜受体传导信号,启动细胞内信号转导通路,最终激活炎症细胞,发挥趋化、脱粒、吞噬以及调节炎症因子合成等作用[9]。近期研究表明,在糖尿病神经病变大鼠模型中,小胶质细胞及其分泌的细胞因子,包括趋化因子可能参与了pDPN 的发生[10]。ROJEWSKA等[11]研究显示,在链脲佐菌素诱导的糖尿病神经病变小鼠中MIP-1α蛋白水平明显升高。但目前,对于血清MIP-1α 在pDPN 患者中的水平变化及其意义研究较少。鉴于此,本研究拟通过研究血清MIP-1α与pDPN 的相关性,旨在为pDPN 的临床诊治提供新的参考依据。
1 资料与方法
1.1 资料 选取2019 年1 月至2021 年3 月于山东第一医科大学附属莱钢医院住院符合研究标准的T2DM 患者260 例,根据是否合并DPN 及患者的疼痛评分,分为单纯T2DM 患者69 例、非pDPN 患者96 例和pDPN 患者95 例。选取同期健康体检者62 例。入组标准:T2DM 患者均符合1999 年WHO糖尿病诊断标准;DPN 患者诊断标准参照《中国2型糖尿病指南(2017 年版)》[12]:①确诊2 型糖尿病;②诊断糖尿病时或之后出现神经病变;③临床症状和体征与DPN 的表现相符;④有临床症状(疼痛、麻木、感觉异常等)者,5 项神经检查(踝反射、针刺痛觉、震动觉、压力觉、温度觉)任1 项异常;无临床症状者,5 项检查中任2 项异常,临床诊断为DPN。pDPN 患者诊断标准:符合DPN 诊断且视觉模拟评分量表(VAS 评分)在1~10 分者为pDPN。排除标准:其他病因引起的周围神经病变,如颈腰椎病病变(神经根压迫、颈腰椎管狭窄及退行性变)、脑血管意外后遗症、慢性酒精中毒、甲状腺疾病、严重肝肾功能不全、感染性多发性神经炎、急性炎症性脱髓鞘性多发性神经症等;药物尤其是化疗药物引起的神经毒性作用、双下肢外伤及手术史。本研究经山东第一医科大学附属莱钢医院医学伦理委员会审核批准,研究对象均签署知情同意书。
1.2 方法 所有受检者均记录身高、体重、腰围、臀围,计算BMI、WHR,测量血压。次日空腹状态(禁食至少8 h)下抽取静脉血约12 ml,离心后留取上清,置于−80 ℃冷藏器中保存待测MIP-1α、TNF-α、IL-10,剩余血样用于检测FPG、血脂、HbA1c、空腹胰岛素(fasting insulin,FIns)、hs-CRP。采用ELISA法检测血清MIP-1α、TNF-α、IL-10 水平。自动电化学发光免疫分析仪检测FPG、血脂、FIns、hs-CRP。计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=FPG×FIns/22.5。采用糖化血红蛋白检测仪检测HbA1c。所有操作严格按试剂盒说明进行。同时T2DM、非pDPN、pDPN 3 组患者入院当天佩戴瞬感扫描式葡萄糖监测系统3 d,计算第1 个24 h 内的血糖在目标范围内时间(TIR)(3.9~10.0 mmol/L),通常以百分比(%)表示。疼痛程度采用视觉模拟量表(VAS)进行评价,用0~10分代表不同程度的疼痛,0分为无痛感,1~3 分为轻度疼痛,4~7 分为中度疼痛,8~10 分为重度疼痛。对pDPN组患者根据汉密尔顿抑郁量表(HAMD)24 项版本评分(HAMD-24 评分)进行评定(正常<8 分;轻度抑郁:8~17 分;中度抑郁:18~34 分;重度抑郁:≥35 分)。由同1 名专科医生行肌电诱发仪神经传导速度检查。测量并记录胫神经运动神经传导速度(mNCV)、腓浅神经感觉神经传导速度(sNCV)。
1.3 统计学处理 采用SPSS23.0软件进行统计学分析。正态分布计量资料以±s表示,不符合正态分布资料以中位数表示。两组间比较采用独立样本t检验。组间两两比较采用LSD-t检验,多组间比较采用单因素方差分析。计数资料以例(%)表示,组间比较采用χ2检验。相关分析采用Pearson 相关性分析。采用Logistic 回归分析影响pDPN 的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 各组一般资料及生化指标比较 ①与NC 组相比,T2DM、非pDPN、pDPN 组WHR、FPG、TC、TG、FIns、HOMA-IR、HbA1c、hs-CRP、TNF-α、MIP-1α 水平均升高,IL-10 水平降低,差异有统计学意义(P<0.05);②与T2DM 组相比,非pDPN、pDPN 组糖尿病病程、WHR、FPG、TG、FIns、HOMA-IR、HbA1c、VPT、hs-CRP、TNF-α、MIP-1α 水平均升高,TIR、mNCV、sNCV、IL-10 水平均降低,差异有统计学意义(P<0.05);③与非pDPN 组相比,pDPN 组糖尿病病程、WHR、FPG、TG、FIns、HOMA-IR、HbA1c、hs-CRP、TNF-α、MIP-1α 均升高,TIR、mNCV、sNCV、IL-10 水平均降低,差异有统计学意义(P<0.05);④各组间性别、年龄、BMI、SBP、DBP、LDL-C、HDL-C 相比,差异无统计学意义(P>0.05),见表1。
表1 4组间一般资料比较(±s,[M(QL,QU)]Tab.1 General data in four groups(±s,[M(QL,QU)]

表1 4组间一般资料比较(±s,[M(QL,QU)]Tab.1 General data in four groups(±s,[M(QL,QU)]
Note:1)P<0.05 vs NC group;2)P<0.05 vs T2DM group;3)P<0.05 vs non-pDPN group.
pDPN 95(51/44)53.21±11.14 10.51±7.652)3)23.15±3.02 1.08±0.251)2)3)124.81±13.15 73.17±8.14 12.79±4.161)2)3)4.86±0.931)4.16±1.841)2)3)2.99±1.82 0.82±0.36 220.73±34.141)2)3)5.62±2.141)2)3)44.9(32.19,68.872)3)11.12±1.541)2)3)17.74(16.75,22.18)2)34.79±5.242)3)37.96±4.182)3)6.18±1.941)2)3)8.88±1.031)2)3)5.36±1.771)2)3)75.69±10.321)2)3)Biochemical criterion n(M/F)Age/year Duration of DM/year BMI/(kg·m−2)WHR SBP/mmHg DBP/mmHg FPG/(mmol·L−1)TC/(mmol·L−1)TG/(mmol·L−1)LDL-C/(mmol·L−1)HDL-C/(mmol·L−1)FIns/(pmol·L−1)HOMA-IR TIR(%)HbA1c(%)VPT(Volt)mNCV/(m·s−1)sNCV/(m·s−1)hs-CRP/(mg·L−1)TNF-α/(ng·ml−1)IL-10/(ng·ml−1)MIP-1α/(pmol·L−1)NC 62(33/29)51.61±12.02−22.27±1.98 0.79±0.13 120.31±11.36 70.82±6.47 4.56±0.61 3.46±0.62 1.34±0.25 2.13±0.74 1.21±0.34 49.63±16.37 2.53±0.74−5.03±0.19−−−1.98±0.89 4.33±0.32 18.09±3.51 20.37±3.45 T2DM 69(36/33)52.32±10.97 6.81±4.56 22.78±3.13 0.89±0.171)121.92±12.04 72.19±6.22 9.80±1.951)4.52±0.811)2.29±0.871)3.15±0.73 0.86±0.2 9 84.17±19.521)3.72±1.081)63.72(40.34,81.73)8.34±0.521)5.34(3.72,7.40)47.13±3.16 49.18±2.84 4.17±1.361)5.79±0.501)13.58±2.721)42.56±7.191)non-pDPN 96(50/46)53.45±10.80 8.23±4.202)22.96±2.84 0.97±0.141)2)123.43±13.18 73.24±7.80 11.81±3.671)2)4.87±0.841)3.86±1.241)2)3.04±0.82 0.7 8±0.32 137.45±26.471)2)5.51±1.981)2)50.16(35.68,70.18)2)10.98±1.371)2)16.42(13.97,20.69)2 40.15±4.221)2)42.27±3.952)4.96±1.671)2)6.36±0.781)2)8.02±2.141)2)58.26±9.871)2)
2.2 血清MIP-1α 水平与临床指标相关性分析 Pearson 相关分析显示,血清MIP-1α 水平与糖尿病病程、WHR、FPG、TG、HOMA-IR、HbA1c、hs-CRP、TNF-α 呈正相关,差异有统计学意义(P<0.05);与TIR、IL-10 呈负相关,差异有统计学意义(P<0.05),见表2。
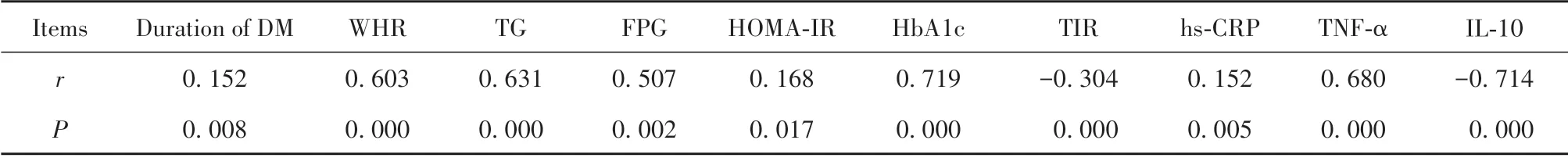
表2 Pearson相关分析MIP-1α与其他指标的相关性Tab.2 Pearson correlation analysis between MIP-1α and other indicators
2.3 血清MIP-1α 水平与pDPN 发生风险的多因素Logistic 回归分析 结果显示,糖尿病病程、HbA1c、TIR、TNF-α、IL-10、MIP-1α均为pDPN 发生的影响因素(P<0.05)。校正糖尿病病程、HbA1c、TIR 因素后,结果显示,MIP-1α、TNF-α 仍为影响pDPN 发生的独立危险因素,见图1。

图1 pDPN影响因素的多因素Logistic回归分析Fig.1 Logistic regression analysis of risk factors for pDPN
2.4 血清MIP-1α 水平在pDPN 患者各亚组之间的比较 根据VAS 疼痛评分将pDPN 进行亚分组后分析,疼痛评分越高,亚组血清MIP-1α、TNF-α、hs-CRP、HAMD-24 评分越高,mNCV、sNCV 越低,差异有统计学意义(P<0.01,表3)。
表3 临床pDPN亚组之间血清MIP-1α、hs-CRP、mNCV、sNCV比较[±s,M(Q1,Q2)]Tab.3 Serum MIP-1α,hs-CRP,mNCV and sNCV were compared between clinical pDPN sub groups[±s,M(Q1,Q2)]

表3 临床pDPN亚组之间血清MIP-1α、hs-CRP、mNCV、sNCV比较[±s,M(Q1,Q2)]Tab.3 Serum MIP-1α,hs-CRP,mNCV and sNCV were compared between clinical pDPN sub groups[±s,M(Q1,Q2)]
Pain degree n HAMD-24 Mild Moderate Severe F/χ2 P 33 32 30−−hs-CRP/(mg·L−1)5.78±1.70 6.39±2.03 7.24±2.16 1.090 0.340 TNF-α/(ng·ml−1)6.75±0.96 8.97±1.02 10.56±1.25 4.125 0.008 IL-10/(ng·ml−1)6.71±1.82 5.56±1.76 4.23±1.57 3.285 0.009 MIP-1α/(pmol·L−1)64.38±7.45 75.70±8.03 86.19±10.87 6.364 0.000 10.23(6.32,15.28)12.19(6.78,19.74)15.36(7.51,30.82)5.423 0.001 mNCV/(m·s−1)38.76±4.93 34.57±4.38 32.69±3.97 4.398 0.007 sNCV/(m·s−1)42.15±4.78 37.24±4.31 35.24±3.92 4.024 0.005
3 讨论
DPN 是导致糖尿病足的高危因素,随着病情进展,部分患者可出现触发痛、自发性疼痛、痛觉过敏等疼痛改变,即pDPN[13]。临床治疗主要围绕控制血糖、血压、血脂,营养神经、抗氧化、改善微循环及镇痛等治疗。但pDPN 神经痛通常是因正常痛觉信号系统受损或功能紊乱引起,疼痛剧烈,对标准化镇痛治疗效果差,让患者备受煎熬,是临床控制疼痛的重要难题,故有效缓解患者神经痛、改善患者生活质量,越来越受到医学界的关注。有研究报道,炎症细胞因子在pDPN 的发生发展中发挥重要作用,其级联反应导致神经缺血、局部神经纤维脱髓鞘,从而引起痛觉及热觉过敏[14]。MIP-1α 是一种对多种炎症细胞具有趋化和激活功能的细胞因子,参与炎症免疫反应,可能与pDPN 有关,但其相关性研究较少,本研究通过探讨血清MIP-1α 与pDPN 的相关性,为pDPN的治疗提供新靶点。
MIP-1α 也称为CCL3,是人MIP-1 家成员,可趋化T淋巴细胞、NK 细胞、单核细胞及未成熟的树突状细胞,使促炎症细胞或炎症细胞进入炎症部位,促进Ca2+及IL-1、TNF-α、组胺等炎症调节因子释放引起炎症反应,还可以通过调节辅助性T 细胞的分化而调节免疫应答,与神经性疼痛的发生密切相关[11,15]。GALLOWAY 等[16]研究发现,在合并pDPN的糖尿病大鼠的背根神经节中MIP-1蛋白水平明显高于未合并pDPN 的糖尿病大鼠。本研究发现,血清MIP-1α 水平在NC、T2DM、非pDPN、pDPN 组中依次升高,且pDPN 升高最显著,与上述研究结论一致,表明MIP-1α 可能参与了pDPN 的发生、发展,对pDPN识别有重要意义。IL-10是机体重要的免疫调节因子,可通过结合自身受体IL‐10R,激活Janus 激酶/信号转导与转录激活子信号通路抑制多种炎症因子的合成,在抑制促炎反应和限制过度免疫反应中发挥重要作用,而促炎因子TNF-α、hs-CRP 水平的过表达是DPN 发病机制之一[17]。本研究Pearson相关性分析发现,血清MIP-1α水平与hs-CRP、TNF-α呈正相关,与IL-10 呈负相关,差异有统计学意义,提示MIP-1α 在炎症反应与抗炎反应两者间动态平衡中至关重要,其一方面可能通过与hs-CRP、TNF-α协同作用促进炎症发生,参与pDPN 的发生发展,另一方面还可能通过抑制抗炎因子IL-10 的表达参与pDPN 的进展[18]。本研究Pearson 相关性分析还发现,血清MIP-1α 水平与糖尿病病程、WHR、FPG、TG、HOMA-IR、HbA1c 呈正相关,差异有统计学意义。提示MIP-1α可通过加重糖脂代谢紊乱,降低胰岛素受体的敏感性,增加胰岛素抵抗,导致病情进一步发展。TIR 是指24 h 内葡萄糖在目标内(通常为3.9~10.0 mmol/L)的时间所占的百分比,是HbA1c 重要补充,两者结合更全面的反映患者的血糖控制水平,已有研究显示,TIR是DPN的保护性因素[19-21]。本研究发现,TIR 水平在pDPN 组低于非pDPN组,且与MIP-1α水平呈负相关,与既往研究一致。本研究多因素Logistic回归分析发现,糖尿病病程、HbA1c、TIR、TNF-α、IL-10、MIP-1α 是pDPN 的影响因素,说明糖尿病病程长,血糖水平控制差、波动大,MIP-1α水平高,均可增加pDPN发生的危险。校正糖尿病病程、HbA1c、TIR 因素后,结果显示MIP-1α、TNF-α 仍为影响pDPN 发生的独立危险因素,提示控制MIP-1α 因素水平对pDPN 的发生有利,以便于指导临床治疗。
目前pDPN 的治疗方法有限,临床上多使用三环类抗抑郁药、抗痉挛药、止痛药等,大部分患者对上述药物的治疗效果反应欠佳。KIGUCHI 等[22]研究显示,坐骨神经受损小鼠的周围神经鞘内注射MIP-1α 可诱发肢体痛觉过敏,而注射MIP-1α 拮抗剂或其受体的拮抗剂可减轻这种痛觉异常。还有研究表明,在STZ 诱导的糖尿病神经病变小鼠的L5、L6 腰椎之间鞘内注射抗MIP-1α 抗体,可以剂量依赖性的提高小鼠痛觉阈值,且可提高吗啡的镇痛效果[11]。本研究根据VAS疼痛评分将pDPN进行亚分组后发现,疼痛评分越高,亚组血清MIP-1α、TNF-α水平及HAMD 抑郁评分越高,mNCV、sNCV 越低,差异有统计学意义,与HERDER 等[23]的研究一致,说明MIP-1α水平越高,神经传导越差、疼痛越重、抑郁状态越明显。分析原因可能为:pDPN 患者体内炎症因子水平升高,激活巨噬细胞,活化T、B 淋巴细胞,促进MIP-1α 表达;另外高表达的MIP-1α 与相应受体结合后又可促使TNF-α 等炎症因子释放,进一步加重炎症反应,导致pDPN 病情的进展[15]。故因此推测,抑制pDPN 患者MIP-1α 的表达,能降低炎症反应程度,减轻患者疼痛,改善神经传导和抑郁状态,MIP-1α可作为治疗pDPN的潜在靶点。
综上所述,MIP-1α 与神经性疼痛的发生发展有密切的关系,是当前研究的热点,其可能通过参与糖脂代谢紊乱、胰岛素抵抗、炎症免疫反应及神经损伤、氧化应激等途径导致pDPN 的发生,可用于评估pDPN 发生发展,为临床治疗提供新思路,有望成为pDPN 治疗的潜在靶点。然而本研究尚存在一定缺陷,样本量较小,且参与pDPN 的影响因素较多,未来将扩大样本量并进一步通过MIP-1α 深层机制及其相关信号通路以阐述其在pDPN 发生、发展中的作用。