新生儿Fc受体免疫学功能及研究进展①
宫照乾 徐雅楠 邓光存 吴晓玲 (宁夏大学生命科学学院,银川 750021)
新生儿Fc 受体(neonatal Fc receptor,FcRn)最初在啮齿动物肠道中被分离,早期发现FcRn的功能是将母体中的抗体传递给新生幼体,在该抗体转运过程中,FcRn仅在酸性条件下结合IgG,结合后介导IgG 跨过胎盘屏障从母体转移至胎儿体内,从而为新生胎儿提供成年个体所具备的体液免疫能力。因此,FcRn在新生哺乳动物被动获得母体免疫中起重要作用[1]。此外,与其他Fcγ 受体家族成员(FcγRs)不同的是,FcRn不仅表达于细胞膜,多种类型细胞内均存在FcRn。因此,FcRn 能在吞噬细胞的酸化内体中结合IgG 及白蛋白,并通过再循环机制将其重新释放至血液,使其免受降解并维持较长的血清半衰期。进一步研究发现,FcRn还参与调节先天免疫应答,并在抗原加工呈递过程中发挥重要作用[2]。FcRn 的免疫调节功能不仅局限于新生儿,在整个生命过程中始终发挥不可或缺的作用。目前FcRn 能够靶向IgG 这一特性已被广泛用于免疫缺陷病及癌症等多种疾病治疗。此外,对FcRn的深入研究不仅能够有效促进IgG 及白蛋白类治疗药物发展,还使一些药物跨过黏膜屏障进行转运,使药物治疗效果最大化[3]。
1 新生儿Fc受体概述
1.1 FcRn 简介 FcRn 又称Brambell 受体,是一种由Fcgrt 基因编码的非典型Fcγ 受体(FcγRs),其历史可追溯至1958 年,ROGERS BRAMBELL 首次提出了细胞受体假说,认为该受体负责将母体IgG 通过卵黄囊和新生儿肠道转运至胎儿体内,卵黄细胞检测发现,这种转运对IgG 亚型具有高度选择性,且仅依赖于IgG 分子上恒定的Fc 部分[4]。基于以上结果,BRAMBELL 首次提出单个细胞受体是介导这些细胞屏障上IgG胞吞的关键因素。
20 世纪70 年代,有研究表明IgG 在新生大鼠肠上皮转运过程严格依赖于pH 值,即新生儿从母体摄取IgG 过程仅在酸性pH 值,而不会在生理pH 值下发生。进一步研究发现,该受体被鉴定为来自于新生鼠肠道,其三维结构由异二聚体蛋白F40-46 和1 个12 kD 的亚基构成[5]。随后研究者克隆了相应基因发现,12 kD 亚基为β2-微球蛋白(β2m),而F40-46 为与Ⅰ类主要组织相容性复合物(classⅠmajor histocompatibility complex,MHC Ⅰ)相关的重链(α链)。由于这一发现,该受体被命名为FcRn[6]。后续研究表明,FcRn 广泛表达于各组织细胞中,包括与血管壁对齐的内皮细胞、肠上皮细胞、气道上皮细胞、胎盘合胞体滋养细胞、肝细胞、内皮细胞、髓样细胞及支气管导管细胞等[5]。在造血细胞,如B 细胞、巨噬细胞及树突状细胞中也发现了高表达的FcRn,该发现能够增加FcRn直接参与IgG复合抗原向T细胞表达的可能性[5]。
1.2 FcRn 结构特点 FcRn 是一种Ⅰ型膜糖蛋白,其结构与MHC Ⅰ相似,是由1 个40 kD 的大亚基和1 个12 kD 的小亚基以非共价键结合形成的异源二聚体。其中大亚基又称α 链,包括3 个胞外结构域(αl、α2 和α3)、1 个跨膜区和1 个含44 个氨基酸的细胞质尾部。小亚基又称β 链,即β2-微球蛋白(β2m)[7]。PAM BJORKMAN 团队解析MHCⅠ晶体结构表明,α1 和α2 结构域位于α3 结构域和β2m 顶部,不同的是相比于MHCⅠ在FcRn 中肽末端锚定的2 个位点被精氨酸侧链和α2 螺旋区的脯氨酸残基阻断[8]。
抗体的Fc结构域是多种蛋白类分子的靶标,因此可充当效应分子配体。抗体的多种生物学活性也取决于与这些效应分子的相互作用,包括FcγRs、补体成分C1q 及FcRn[9]。可溶性FcRn 晶体结构分析表明,FcRn 以2∶1 比例与IgG 的Fc 部分结合,以1∶1比例结合白蛋白[10]。FcRn与配体的结合仅在体内pH<6.5 时发生,结合后FcRn 将配体转运回细胞膜,在细胞外液pH=7.4 时将其重新释放[11]。以IgG为例,这种pH依赖的相互作用是由于FcRn在CH2∶CH3 界面(H310 和H435)与2 个组氨酸结合而产生的,即在低pH 时能够发生质子化反应[5]。FcRn-IgG这一特性对于FcRn 介导IgG 穿梭作用至关重要。大鼠FcRn 和IgG 结合的研究表明,IgG 的FcRn 接触位点包括天冬氨酸137、α2 结构域内的N-聚糖和β2m的N末端,且IgG-Fc结构域在酸性pH下的临界结合位点位于α3 结构域中的1 对组氨酸中。葡萄球菌蛋白A 阻断FcRn 与IgG 结合的实验再次确定CH2-CH3结构域界面是FcRn-IgG 相互作用的关键位点(图1)[12]。
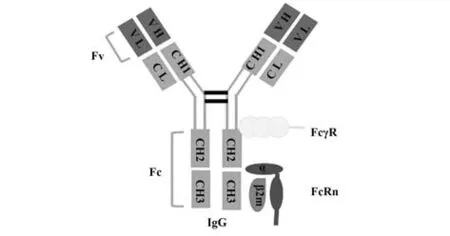
图1 IgG与Fc效应分子相互作用示意图[5,11]Fig.1 Interaction of IgG with Fc effector molecules[5,11]
2 FcRn的生物学功能
2.1 FcRn介导抗原呈递 免疫应答过程是否协调对多细胞生物维持体内稳态至关重要,此过程的基础为抗原识别、加工及呈递。免疫球蛋白是一种独特的分子,能够同时识别多种抗原并被多种受体识别,其中IgG 亚类的丰富性及其结合信号受体的多样性使其成为一种重要的免疫调节分子[13]。而FcγRs 对IgG 的识别代表了一种重要的免疫调节方式,即能够与IgG 上保守的Fc 结构域结合,再以IgG免疫复合物(IgG IC)形式递送独特的抗原决定簇[14]。抗原呈递细胞中,此过程是通过细胞膜表面的FcγRs 启动的,而后使IgG 发生内在化并向内吞小泡递送[2]。虽然单体IgG 能够有效地再循环到细胞表面,但含抗原的IgG IC仅能被转运到囊泡,并在复合抗原的加工过程释放抗原决定簇。这些抗原决定簇被装载到Ⅰ类和Ⅱ类MHC分子上,随后激活相关CD8+和CD4+T细胞[15]。
进入细胞后,IgG 或IgG IC 所通过的酸性运输途径既不由经典FcγRs介导也不由非特异性分布机制介导,而是由FcRn 介导[13]。因此,除在细胞表面能够与IgG 结合的经典FcγRs 外,细胞内终身存在的FcRn 在一定程度上也决定了IgG 和IgG IC 在细胞中的命运[16]。
由FcRn介导的抗原呈递过程大致为:来源于微生物或肿瘤的抗原在进行IgG 处理后形成IgG IC,IgG IC 能够与树突状细胞(dendritic cell,DC)表面的FcγRs结合并启动受体介导的内吞作用,从而将IgG输送至细胞内溶酶体系统。V-ATPase 使囊泡中的环境pH值更低,为IgG从FcγRs上脱离并与FcRn结合提供了合适条件。随后IgG IC 进入抗原加工阶段,从而促进能够装载到Ⅰ类和Ⅱ类MHC分子上的相容表位产生[17]。这些载有肽的MHC 分子可激活CD8+T 和CD4+T 细胞,并通过FcRn-IgG IC 诱导DC产生IL-12。分泌型的IL-12 可作用于激活的CD4+T细胞诱导Th1 极化,此外还可作用于CD8+T 细胞促进细胞活化及细胞毒性。因此,DC 中的FcRn 有助于激活细胞介导的适应性免疫应答,从而有利于机体消除病原体及肿瘤(图2)[13]。

图2 FcRn 将IgG 复合抗原呈递给CD4+T 和CD8+T 细胞的过程[4]Fig.2 FcRn enables presentation of IgG-complexed anti⁃gens to CD4+T and CD8+T cells[4]
DC 中,由FcRn 与MHC Ⅱ类分子介导的向CD4+T 淋巴细胞及CD8+T 淋巴细胞呈递抗原的过程称为交叉递呈,由于该过程涉及细胞外抗原交叉又称为MHC Ⅰ依赖性途径[9]。目前由FcRn 介导的抗原递呈过程无法影响各部位稳态免疫激活,且是内源抗肿瘤活性及肿瘤免疫监视系统的重要组成,该过程与已被广泛认可的CD8+T细胞在抗肿瘤方面的重要性一致,因此FcRn介导的交叉递呈也能够启动肿瘤保护机制[18-19]。
2.2 FcRn 对IgG 及白蛋白的保护作用 IgG 主要由脾脏及淋巴结中的浆细胞合成并分泌,常以单体形式存在,是血清中最主要的抗体。IgG 能够通过胎盘屏障,因此在新生儿从母体中获取抗体以具备抵抗感染的能力方面起重要作用[2]。多数体液免疫过程中,无论是针对病毒还是细胞病原体的保护作用均涉及IgG介导的效应子功能[20]。除IgG外,白蛋白也是最丰富的血浆蛋白之一,可通过与多种配体结合及延长循环半衰期促进脂肪酸、胆红素和血红素等化合物运输。已有研究报道,FcRn能与这两种蛋白结合,并能够保护这两种蛋白免于分解代谢,促进其循环利用[14]。2003 年,克拉克安徒生团队证实了FcRn 和白蛋白的结合位点并证明与FcRn-IgG相互作用的pH 依赖性相似,FcRn 和白蛋白通常也在酸性pH 下结合,在中性或碱性下不结合[21]。肝脏是维持白蛋白稳态的重要器官,研究表明,肝脏也是FcRn结合白蛋白的关键部位,其结合量与全身降解量基本相同,提示FcRn在维持体内白蛋白稳态中具有关键作用[22]。
比白蛋白更值得关注是IgG 稳态维持也代表了体液免疫的一个基本方面,泛素化表达的FcRn可通过胞嘧啶摄取方式进入细胞拯救出即将被降解的IgG 及白蛋白,从而维持体内免疫球蛋白稳定[23]。以IgG 为例,该回收利用的过程是表达FcRn 的细胞通过形成内吞小泡摄取IgG 后形成酸化内体,酸化内体中的pH 降低至6.0 后,FcRn 与IgG 结合形成复合物。该复合物通过再循环回到细胞膜表面,由于血液pH=7.4 时对FcRn 亲和力较弱,因此复合物发生解离,IgG则被再次释放到血液完成1次循环再利用。而在酸化内体中未能与FcRn 结合的IgG 则被运送到溶酶体内被降解(图3)[24]。FcRn缺陷型小鼠动力学研究证明,稳态下FcRn从降解途径中拯救出的IgG 产量几乎是自身产生的4倍。由此推断FcRn在整个生命过程中对IgG 的体内稳态调节起广泛作用。

图3 FcRn介导IgG和白蛋白循环的胞吞作用[26]Fig.3 FcRn mediates endocytosis of IgG and albumin cycling[26]
3 基于FcRn的免疫治疗应用研究进展
3.1 工程化的Fc融合蛋白可延长治疗性抗体半衰期 Fc 融合蛋白是由IgG 的Fc 结构域与所需目标蛋白相互作用组成的。过去十多年中,采用Fc工程技术生成具有提高体内半衰期和跨细胞屏障运输功能的抗体已成为产生“第二代”治疗性抗体的主要领域。Fc 融合蛋白表现出的几个优势中,最引人注目的是与FcRn 相互作用的能力。常见的Fc 融合蛋白即为FcRn-IgG,能够使IgG 在体内重新循环以延长其血浆半衰期。利用该特性可显著改善治疗性抗体半衰期,减少胃肠外给药频率[25]。WARD等[26]在一项关于小鼠Fc 突变体的研究中发现,pH=6.0条件下增加FcRn-IgG 亲和力能够导致经工程改造的IgG 具有更高的血清持久性。此类研究在小鼠体内也证明了FcRn 介导的半衰期延长可提高机体抗肿瘤能力。表明至少在特定小鼠癌症模型中,通过延长半衰期增加药物暴露可保持药物功效并减少给药频率。总之,FcRn有助于组织特异性药物积累,并可能成为用于改善药物在肿瘤和周围器官内累积的靶标[27]。
3.2 FcRn 通过转胞吞作用实现药物传递 FcRn除回收抗体外,还可透过细胞膜进行免疫球蛋白双向转运,从而为蛋白类药物穿过肠屏障进入血液提供了可行途径。但由于胃肠道严格的蛋白水解环境和肠上皮低蛋白渗透性,口服蛋白治疗剂仍是蛋白药物递送的最大难题[28]。除口服外,从肺吸入是以非侵入方式输送蛋白的另一途径。与肠相比,肺pH 较为中性,蛋白水解酶活性也相对较低,且上皮可渗透小肽和蛋白分子。因此关于FcRn 在小鼠肺支气管上皮细胞中的生物表达研究及Fc 融合蛋白实验证实FcR有望成为跨肺输送蛋白药物的可行目标[29]。如促红细胞生成素Fc 融合蛋白(EPO-Fc)的肺部递送能够使FcRn 特异性从肺腔转运进入体循环,并同时具有类似于皮下给药的生物利用度[30]。Fc融合蛋白或Fc功能化的纳米颗粒(Fc-NP)传递到肺空域或肠道管腔的转胞作用中,Fc-融合蛋白或Fc-NP一旦输送到组织间隙就可通过穿透毛细血管内皮屏障直接进入体循环,或在进入血液前先进入淋巴系统再间接进入体循环(图4A、D)[31]。Fc 融合蛋白或Fc-NP 可被表达FcγRs 的驻留DC 或巨噬细胞吞噬(图4B、C)。因此,Fc融合蛋白或Fc-NP便可通过表达FcRn 的APC 进行再循环,或转移至溶酶体,此过程中蛋白水解肽可加载到MHC 分子上。APC 迁移至淋巴结并刺激T 细胞反应,从而诱发免疫应答(图4E)[32]。这一给药方式比口服更具有实现非侵入性蛋白递送的可能,不仅能够以无创方式递送载有蛋白的纳米颗粒,且治疗效果理想。此外,靶向FcRn的纳米颗粒还可用于开发鼻内疫苗或提高部分肠道或肺部疾病治疗药物功效[33]。

图4 Fc融合蛋白或Fc-NP传递到肺空域的转胞作用[29]Fig.4 Transcytosis of Fc-fusion proteins or Fc-NP delivered to lung airspace[28]
4 FcRn的研究前景与展望
随着对FcRn生物学功能研究的不断深入,发现FcRn 可作为一类潜在分子靶标用于改善蛋白和大分子载体类药物特性。此外,FcRn在黏膜表面和胎盘中的转胞吞功能可能成为实现药物传递的新方式。而优化IgG 和FcRn 的相互作用对实现疗效最大化及避免潜在毒性作用也至关重要[34]。因此,近年随着基因工程和DNA技术发展,基于FcRn-IgG的治疗药物开发也引起广泛关注。通过延长或减短工程化IgG 和白蛋白结合物半衰期已成为多种新型治疗药物的设计基石。如从单克隆抗体到Fc 融合蛋白,多种治疗性抗体已被批准用于癌症、自身免疫性疾病及炎症等重大疾病治疗。目前FcRn 还被提议作为治疗自身免疫性疾病的药物靶标,FcRn研究极具前景。因此,深入探讨FcRn的免疫调节功能将为疫苗研发、新药靶标筛选等提供新的思路。