SNHG3调控miR-186对过氧化氢处理的血管内皮细胞损伤的影响
郑 婉 林 云 左 琦 林燕仔 颜亚妮 符碧薇
(海南医学院第一附属医院心血管内科,海口 570102)
血管内皮细胞是组织和血液的直接屏障,血管内皮细胞损伤是动脉粥样硬化等心脑血管疾病发生的重要原因,因此,保护血管内皮细胞免受损伤对防治动脉粥样硬化起重要作用[1]。研究发现,lnc-RNA 异常表达参与调控动脉粥样硬化进展,有望成为心血管疾病的新型诊断标志物或药物治疗靶点[2]。研究报道,小核仁RNA 宿主基因3(small nu‐cleolar RNA host gene 3,SNHG3)参与多种恶性肿瘤发生发展,如SNHG3 高表达与卵巢癌不良预后相关,且促进卵巢癌细胞增殖、侵袭及恶性进展[3]。SNHG3 过表达与患者总体生存和无转移生存的不良预后相关,促进胃癌细胞迁移、侵袭及肺转移[4]。研究表明,miRNA 参与调节细胞增殖、分化、凋亡等功能,通过调控血管内皮细胞、血管平滑肌细胞参与动脉粥样硬化等心血管疾病过程[5-6]。miR-186在高危患者血清中高表达,可反映动脉粥样硬化性心血管疾病严重程度[7]。miR-186 通过抑制胱硫醚-γ-裂解酶表达降低内源性H2S 含量,促进巨噬细胞脂质蓄积和促炎因子分泌,可能与动脉粥样硬化有关[8]。抑制miR-186表达通过上调缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-α)减轻缺氧状态下血管内皮细胞线粒体损伤[9]。但SNHG3 对血管内皮细胞损伤的影响及机制尚不清楚,本研究采用过氧化氢处理人脐静脉内皮细胞Eahy926建立血管内皮细胞损伤模型,探究SNHG3对血管内皮细胞损伤的影响及其机制是否与miR-186有关。
1 材料与方法
1.1 材料 人脐静脉内皮细胞株Eahy926(上海信裕生物科技有限公司);DMEM 培养基(美国Sigma公司);荧光定量试剂盒(美国Progema 公司);RIPA蛋白裂解液(上海碧云天生物技术有限公司);四甲基偶氮唑盐比色法(methyl thiazolyl tetrazolium assay,MTT)试剂盒、凋亡试剂盒、双荧光素酶报告基因检测试剂盒(北京索莱宝科技有限公司);超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒(南京建成生物工程研究所);重组Anti-CyclinD1 抗体(ab134175)、重组Anti-P21 抗体(ab109520)、重组Anti-Bax 抗体(ab32503)、重组Anti-Bcl-2 抗体(ab182858)、山羊抗兔IgG H&L(HRP,ab6721,美国Abcam 公司);PowerPac 蛋白电泳仪、Gel Doc XR+凝胶显示系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 细胞培养与分组 Eahy926 细胞采用含10%胎牛血清的DMEM 完全培养液于37 ℃培养,80% 融和时采用无血清培养基饥饿培养12 h,500 mmol/L过氧化氢培养细胞24 h作为过氧化氢组(H2O2),正常培养的细胞作为对照组。将pcDNA-3.1、pcDNA3.1-SNHG3 转染至Eahy926 细胞,再采用500 mmol/L过氧化氢处理,记为H2O2+pcDNA3.1组、H2O2+pcDNA3.1-SNHG3 组。将pcDNA3.1-SNHG3与miR-NC、miR-186 分别共转染至Eahy926 细胞,再采用500 mmol/L H2O2处理,记为H2O2+pc-DNA3.1-SNHG3+miR-NC 组、H2O2+pcDNA3.1-SNHG3+miR-186组。
1.2.2 RT-qPCR 检测SNHG3 和miR-186 表达 提取细胞总RNA,反转录为cDNA,按荧光定量PCR 试剂盒说明操作,循环条件为95 ℃预变性5 min,95 ℃变性20 s,60 ℃退火30 s,72 ℃延伸30 s,共40 个循环,2−ΔΔCt法计算相对表达。SNHG3 和miR-186 分别以GAPDH 和U6 为内参,SNGH3 正向引物:5'-GACTTCCGGGCACTTCGTAA-3',反向引物:5'-TCCTTAACAAATCCAAGGAGAAGAA-3';miR-186 正向引物:5'-GCCGAGCAAAGAATTCTCCTTT-3',反向引物:5'-CTCAACTGGTGTCGTGGA-3';GAPDH 正向引物:5'-TCCCATCACCATCTTCCAGG-3',反向引物:5'-GATGACCCTTTTGGCTCCC-3';U6 正向引物:5'-CTCGCTTCGGCAGCACATATACT-3',反向引物:5'-ACGCTTCACGAATTTGCGTGTC-3'。
1.2.3 Western blot 检测细胞CyclinD1、P21、Bax、Bcl-2蛋白表达 提取细胞总蛋白,定量,电泳,转至PVDF 膜,封闭,加入一抗孵育过夜,加入二抗孵育2 h,曝光显影、定影,测定蛋白条带灰度值,以目的条带和GAPDH条带比值作为蛋白表达。
1.2.4 MTT 检测细胞存活率 收集各组对数生长期细胞于96 孔板培养48 h,去上清,加入新鲜培养液及10 µl MTT 培养液继续培养4 h,酶标仪检测490 nm 处吸光度(OD)值,细胞存活率(%)=OD实验组/OD空白对照组×100%。
1.2.5 SOD 和LDH 试剂盒分别检测细胞SOD 活性和培养液LDH 含量 细胞培养48 h 后收集各组细胞及培养上清,在细胞沉淀中加入PBS缓冲液,进行冰水浴(300 W,超声3~5 s/次,间隔4 次,每次间隔30 s)。采用考马斯亮蓝试剂盒测定蛋白浓度,按试剂盒说明书加入相应试剂,混匀,37 ℃孵育20 min,酶标仪测定450 nm处吸光度,计算SOD活力或LDH含量。
1.2.6 流式细胞术检测细胞凋亡 收集细胞,1×结合缓冲液悬浮细胞,调节细胞浓度为1×106~5×106个/ml,取100 µl 细胞悬浮液于流式管,加入5 µl Annexin Ⅴ/FITC 混匀,室温避光孵育5 min,加入5 µl PI,并加入400 µl PBS,流式细胞仪检测,细胞凋亡率(%)=早期和晚期凋亡细胞数/总细胞数×100%。
1.2.7 荧光素酶报告实验检测SNHG3 对miR-186的靶向调控 构建野生型和突变型SNHG3 的荧光素酶表达载体WT-SNHG3 和MUT-SNHG3,分别与miR-NC 和miR-186 共转染至Eahy926 细胞,充分裂解细胞后加至培养板,配制萤火虫荧光素酶反应工作液和海肾荧光素酶反应液,并孵育至室温,加入100µl 萤火虫荧光素酶反应液振荡混匀,检测萤火虫荧光素酶活力,加入100µl 海肾荧光素酶反应液振荡混匀,检测海肾荧光素酶活力。将pcDNA3.1、pcDNA3.1-SNHG3、si-NC、si-SNHG3 分别转染至正常Eahy926细胞,按1.2.2检测miR-186表达。
1.3 统计学分析 采用SPSS20.0软件进行统计学分析。计量资料以±s表示,两组间比较行t检验,多组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 H2O2处理的Eahy926 细胞SNHG3 表达 与对照组相比,H2O2处理的Eahy926 细胞SNHG3 表达比未采用处理H2O2处理的Eahy926 细胞显著降低(0.23±0.02vs1.01±0.10,t=22.946,P<0.001)。
2.2 过表达SNHG3 对H2O2处理的Eahy926 细胞活性及SOD、LDH 的影响 与对照组相比,H2O2处理的Eahy926 细胞SNHG3、CyclinD1 表达显著降低,P21 表达显著升高,存活率显著降低,SOD 活性显著降低,LDH 水平显著升高(P<0.05);与H2O2+pcDNA 3.1 组相比,H2O2+pcDNA3.1-SNHG3 组Eahy926 细胞SNHG3、CyclinD1 表达显著升高,P21 表达显著降低,存活率显著升高,SOD 活性显著升高,LDH 水平显著降低(P<0.05,表1、图1)。
表1 过表达SNHG3对H2O2处理的Eahy926细胞活性及SOD、LDH的影响(±s,n=9)Tab.1 Effect of overexpression of SNHG3 on cell viability and SOD and LDH of Eahy926 cells treated with H2O2(±s,n=9)
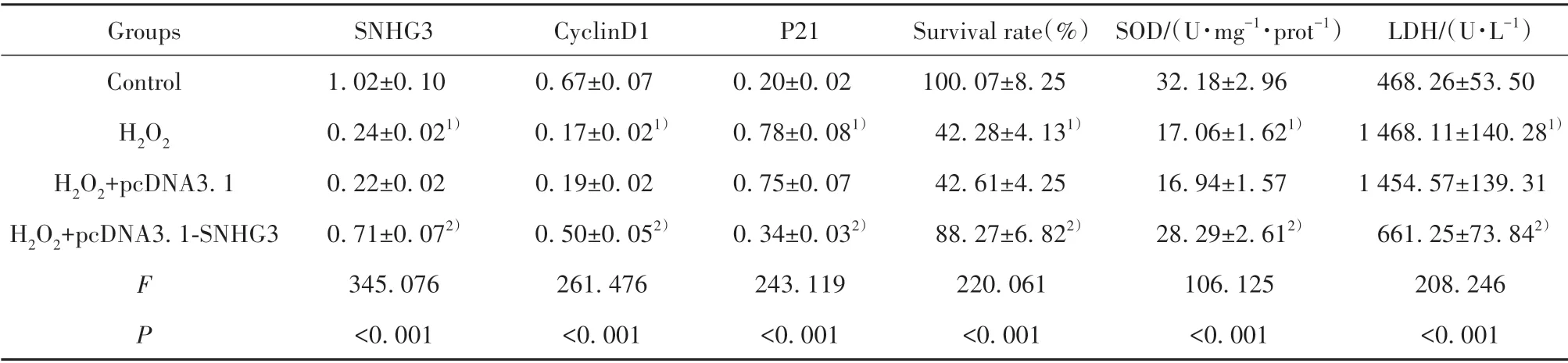
表1 过表达SNHG3对H2O2处理的Eahy926细胞活性及SOD、LDH的影响(±s,n=9)Tab.1 Effect of overexpression of SNHG3 on cell viability and SOD and LDH of Eahy926 cells treated with H2O2(±s,n=9)
Note:Compared with control group,1)P<0.05;compared with H2O2+pcDNA3.1 group,2)P<0.05.
LDH/(U·L−1)468.26±53.50 1 468.11±140.281)1 454.57±139.31 661.25±73.842)208.246<0.001 Groups Control H2O2 H2O2+pcDNA3.1 H2O2+pcDNA3.1-SNHG3 F P SNHG3 1.02±0.10 0.24±0.021)0.22±0.02 0.71±0.072)345.076<0.001 CyclinD1 0.67±0.07 0.17±0.021)0.19±0.02 0.50±0.052)261.476<0.001 P21 0.20±0.02 0.78±0.081)0.75±0.07 0.34±0.032)243.119<0.001 Survival rate(%)100.07±8.25 42.28±4.131)42.61±4.25 88.27±6.822)220.061<0.001 SOD/(U·mg−1·prot−1)32.18±2.96 17.06±1.621)16.94±1.57 28.29±2.612)106.125<0.001

图1 过表达SNHG3对H2O2处理的Eahy926细胞增殖相关蛋白表达的影响Fig.1 Effect of overexpression of SNHG3 on proliferation related proteins expressions in H2O2-treated Eahy-926 cells
2.3 过表达SNHG3 对H2O2处理的Eahy926 细胞凋亡的影响 与对照组相比,H2O2处理的Eahy926 细胞Bax 表达显著升高,Bcl-2 表达显著降低,细胞凋亡率显著升高(P<0.05);与H2O2+pcDNA3.1 组相比,H2O2+pcDNA3.1-SNHG3 组Eahy926 细胞Bax 表达显著降低,Bcl-2 表达显著升高,细胞凋亡率显著降低(P<0.05,图2、表2)。
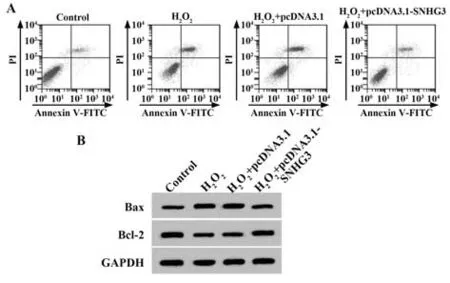
图2 过表达SNHG3 对H2O2 处理的Eahy926 细胞凋亡的影响Fig.2 Effect of overexpression of SNHG3 on apoptosis of Eahy926 cells treated with H2O2
表2 过表达SNHG3 对H2O2 处理的细胞Eahy926 凋亡的影响(±s,n=9)Tab.2 Effect of overexpression of SNHG3 on apoptosis of Eahy926 cells treated with H2O2(±s,n=9)
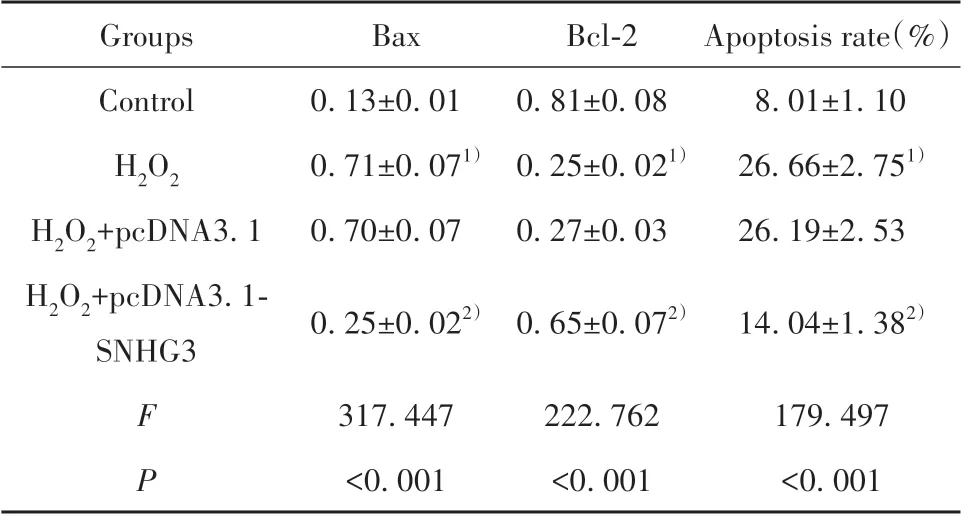
表2 过表达SNHG3 对H2O2 处理的细胞Eahy926 凋亡的影响(±s,n=9)Tab.2 Effect of overexpression of SNHG3 on apoptosis of Eahy926 cells treated with H2O2(±s,n=9)
Note:Compared with control group,1)P<0.05;compared with H2O2+pcDNA3.1 group,2)P<0.05.
Groups Control H2O2 H2O2+pcDNA3.1 H2O2+pcDNA3.1-SNHG3 Bax 0.13±0.01 0.71±0.071)0.70±0.07 0.25±0.022)Bcl-2 0.81±0.08 0.25±0.021)0.27±0.03 0.65±0.072)Apoptosis rate(%)8.01±1.10 26.66±2.751)26.19±2.53 14.04±1.382)179.497<0.001 F P 317.447<0.001 222.762<0.001
2.4 SNHG3 靶向调控miR-186 表达 starbase 预测显示,SNHG3 与miR-186 存在结合位点(图3)。miR-186 与WT-SNHG3 共转染的Eahy926 细胞荧光素酶活性显著降低(P<0.05),而与MUT-SNHG3 共转染的Eahy926细胞荧光素酶活性差异无统计学意义(P>0.05,表3)。相较于pcDNA3.1 组,pcDNA 3.1-SNHG3 组miR-186 表达显著降低,相较于si-NC组,si-SNHG3 组miR-186 表达显著升高(P<0.05,表4)。提示SNHG3可靶向调控miR-186表达。
表3 双荧光素酶实验(±s,n=9)Tab.3 Dual luciferase experiment(±s,n=9)
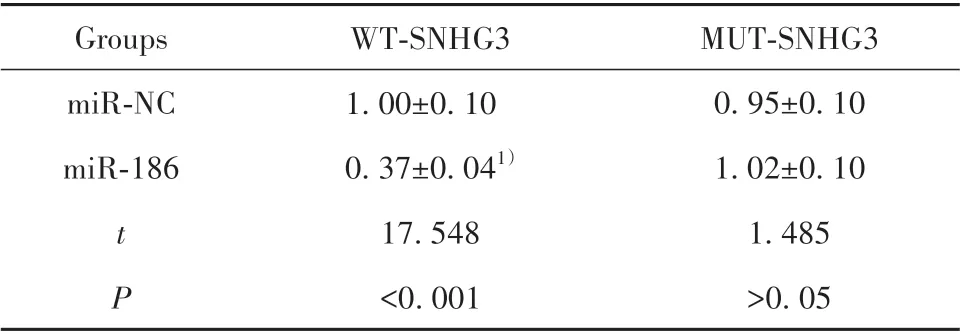
表3 双荧光素酶实验(±s,n=9)Tab.3 Dual luciferase experiment(±s,n=9)
Note:Compared with miR-NC group,1)P<0.05.
MUT-SNHG3 0.95±0.10 1.02±0.10 1.485>0.05 Groups miR-NC miR-186 t P WT-SNHG3 1.00±0.10 0.37±0.041)17.548<0.001
表4 SNHG3调控miR-186表达(±s,n=9)Tab.4 SNHG3 regulates expression of miR-186(±s,n=9)
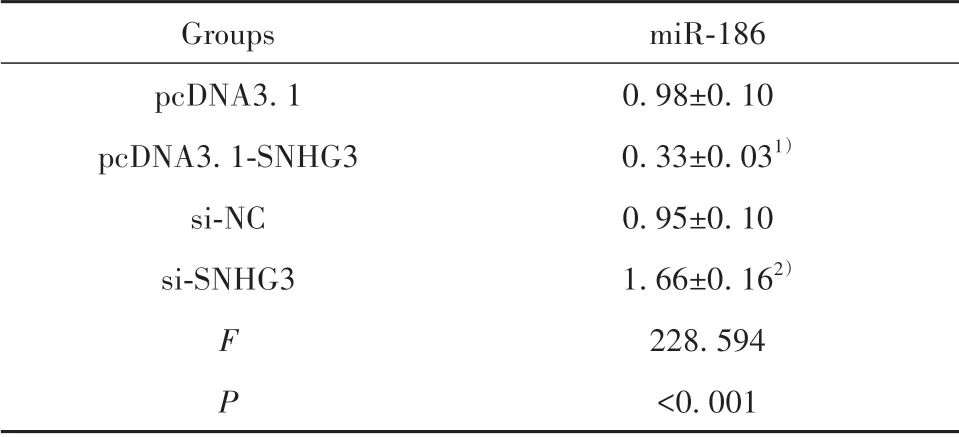
表4 SNHG3调控miR-186表达(±s,n=9)Tab.4 SNHG3 regulates expression of miR-186(±s,n=9)
Note:Compared with pcDNA3.1 group,1)P<0.05;compared with si-NC group,2)P<0.05.
miR-186 0.98±0.10 0.33±0.031)0.95±0.10 1.66±0.162)228.594<0.001 Groups pcDNA3.1 pcDNA3.1-SNHG3 si-NC si-SNHG3 F P
2.5 过表达miR-186 可逆转SNHG3 对H2O2处理的Eahy926 细胞活性及SOD、LDH 的影响 与H2O2+pcDNA3.1-SNHG3+miR-NC 组相比,H2O2+pcDNA-3.1-SNHG3+miR-186 组Eahy926 细胞miR-186、CyclinD1 表达显著降低,P21 表达显著升高,细胞存活率显著降低,SOD 活性显著降低,LDH 水平显著升高(P<0.05,图4、表5)。

图4 过表达miR-186 逆转SNHG3 对H2O2处理的Eahy926细胞增殖相关蛋白表达的影响Fig.4 Overexpression of miR-186 reverses effect of SNHG3 on expressions of proliferation related proteins in H2O2 treated Eahy926 cells
表5 过表达miR-186可逆转SNHG3对H2O2处理的Eahy926细胞活性及SOD、LDH的影响(±s,n=9)Tab.5 Overexpression of miR-186 can reverse effect of SNHG3 on viability and SOD and LDH of H2O2 treated Eahy926 cells(±s,n=9)

表5 过表达miR-186可逆转SNHG3对H2O2处理的Eahy926细胞活性及SOD、LDH的影响(±s,n=9)Tab.5 Overexpression of miR-186 can reverse effect of SNHG3 on viability and SOD and LDH of H2O2 treated Eahy926 cells(±s,n=9)
Note:Compared with H2O2+pcDNA3.1-SNHG3+miR-NC group,1)P<0.05.
LDH/(U·L−1)681.70±71.55 1 317.26±124.291)13.295<0.001 Groups H2O2+pcDNA3.1-SNHG3+miR-NC H2O2+pcDNA3.1-SNHG3+miR-186 t P miR-186 0.97±0.10 0.37±0.041)16.713<0.001 CyclinD1 0.48±0.05 0.22±0.021)14.484<0.001 P21 0.31±0.03 0.64±0.061)14.758<0.001 Survival rate(%)87.95±7.12 44.67±4.391)15.523<0.001 SOD/(U·mg−1·prot−1)27.96±2.73 17.18±1.691)10.072<0.001
2.6 过表达miR-186 可逆转SNHG3 对H2O2处理的Eahy926 细胞凋亡的影响 与H2O2+pcDNA3.1-SN‐HG3+miR-NC 组相比,H2O2+pcDNA3.1-SNHG3+miR-186组Eahy926细胞Bax表达显著升高,Bcl-2表达显著降低,细胞凋亡率显著升高(P<0.05,图5、表6)。
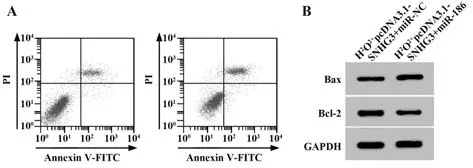
图5 过表达miR-186 可逆转SNHG3 对H2O2处理的Eahy-926细胞凋亡的影响Fig.5 Overexpression of miR-186 can reverse effect of SNHG3 on apoptosis of Eahy926 cells treated with H2O2
表6 过表达miR-186 能逆转SNHG3 对H2O2 处理的细胞Eahy926凋亡的影响(±s,n=9)Tab.6 Overexpression of miR-186 can reverse effect of SNHG3 on apoptosis of Eahy926 cells treated with H2O2(±s,n=9)

表6 过表达miR-186 能逆转SNHG3 对H2O2 处理的细胞Eahy926凋亡的影响(±s,n=9)Tab.6 Overexpression of miR-186 can reverse effect of SNHG3 on apoptosis of Eahy926 cells treated with H2O2(±s,n=9)
Note:Compared with H2O2+pcDNA3.1-SNHG3+miR-NC group,1)P<0.05.
Groups H2O2+pcDNA3.1-SNHG3+miR-NC H2O2+pcDNA3.1-SNHG3+miR-186 Bax 0.23±0.02 Bcl-2 0.66±0.07 Apoptosis rate(%)13.89±1.35 0.59±0.061)0.31±0.031)24.14±2.231)11.796<0.001 t P 17.076<0.001 13.787<0.001
3 讨论
血管内皮细胞损伤是引起一系列心血管疾病的重要原因,对人类身体健康危害极大[10]。细胞凋亡是导致血管内皮细胞损伤的主要原因,氧化应激也与血管内皮细胞损伤有关[11]。SOD 是清除自由基的抗氧化酶,其活性高低反映机体抗氧化能力大小;LDH 是一种糖酵解酶,其漏出量反映细胞膜受损程度[12]。本研究采用H2O2处理Eahy926 细胞,结果显示,细胞存活率显著降低,细胞凋亡率显著升高,SOD 活性显著降低,LDH 水平显著升高,说明血管内皮细胞损伤模型建立成功。
研究报道,SNHG3 上调通过沉默Kruppel 样转录因子2(kruppel-like factor 2,KLF2)和P21 促进胶质瘤细胞增殖,并抑制细胞凋亡,促进神经胶质瘤恶性进展[13]。SNHG3 通过miR-182-5p 促进结直肠癌恶性发展[14]。SNHG3 过表达可防止体内缺氧/缺血性脑损伤和体外海马细胞损伤[15]。lncRNA SNHG3通过充当miR-485 的ceRNA 上调ATG7 表达,从而促进自噬诱导的神经元细胞凋亡[16]。提示SNHG3不仅参与调控重力进展,还影响细胞缺氧损伤。本研究显示,过氧化氢处理的Eahy926 细胞SNHG3 表达显著降低,过表达SNHG3 后,细胞存活率显著升高,凋亡率显著降低,SOD 活性显著升高,LDH 水平显著降低,CyclinD1、Bax 表达降低,P21、Bcl-2 表达升高,表明过表达SNHG3 可促进Eahy926 细胞存活,抑制过氧化氢处理的Eahy926细胞凋亡,抑制氧化应激。提示过表达SNHG3 可保护过氧化氢诱导的血管内皮细胞损伤。
研究发现,缺氧状态下血管内皮细胞miR-186表达明显升高,干扰其表达可对细胞损伤起一定保护作用[9]。miR-186-5p 通过靶向Toll 样受体3(Tolllike receptor 3,TLR3)调节高糖诱导的心肌细胞凋亡[17]。hsa_circ_0010729 通过靶向miR-186/HIF-1α调节血管内皮细胞增殖和凋亡[18]。lncRNA SNHG16通过调节miR-186 表达促进肝癌增殖、迁移和侵袭[19]。表明miR-186参与调控血管内皮细胞凋亡及损伤等过程,且miR-186 可受lncRNA 和circRNA 调控。为研究lncRNA SNHG3 是否与miR-186 具有调控关系,本研究通过在线软件预测显示,lncRNA SNHG3 与miR-186 存在结合位点,且通过双荧光素酶报告实验证实SNHG3 靶向调控miR-186 表达,同时过表达miR-186和lncRNA SNHG3,H2O2处理的细胞存活率显著降低,细胞凋亡率升高,SOD 活性显著降低,LDH 水平显著升高,表明过表达miR-186逆转了SNHG3 对H2O2处理的Eahy926 细胞活性、凋亡及SOD、LDH 的影响。提示SNHG3 可能通过调控miR-186保护过氧化氢诱导的Eahy926细胞损伤。
综上,过表达SNHG3 可能通过下调miR-186 表达保护过氧化氢诱导的Eahy926细胞损伤。