建立ELISA法检测胸膜液GSDMD及其对胸腔积液鉴别诊断的价值①
史 静 袁 源 陈 红 周丽菁 甘德露 陈维贤 李 朴
(重庆医科大学附属第一医院检验科,重庆 400042)
胸腔积液(pleural effusion,PE)是以胸膜腔内病理性液体积聚为特征的一种常见临床症候,当患者全身状况、肺部疾病、器官功能障碍等病理过程导致胸膜液形成和吸收不平衡时通常会产生PE。结核性肺炎、肺部感染和恶性肺部疾病是PE最常见的原因[1]。临床检验工作中常采用病原菌检测、生化和免疫分析PE 以区分其病因。对于结核性PE,结核分枝杆菌(Mycobacterium tuberculosis,Mtb)涂片染色法是目前确诊Mtb的金标准,但敏感度有限,培养Mtb 需数周时间,且需要较高的实验室条件。乳酸脱氢酶(lactate dehydrogenase,LDH)与类肺炎性PE、结核性胸膜炎或恶性PE 有关,故LDH 在鉴别PE 病因方面缺乏特异性和敏感度[2]。一份针对63 项研究的Meta 分析结果显示,腺苷脱氨酶(adenosine eaminase,ADA)诊断结核性胸膜炎平均敏感度和特异性分别为0.92 和0.90[3]。但最近一项研究发现,ADA 水平虽然在胸膜结核诊断中效率较高,但在结核组和恶性组鉴别诊断中可能无明显作用[4]。且ADA在低患病率环境下的诊断效果不理想[5]。故探索更经济、高效和检测方法可行的生物标志物尤其重要。
焦亡(pyroptosis)是一种由caspase-1 或caspase-11/4/5 激活的炎症性程序性细胞死亡途径[5]。Gasdermin——焦孔素(包括6 个同源基因GSDMA、GSDMB、GSDMC、GSDMD、GSDME、PJVK)是一个具有成孔效应的蛋白家族,可影响膜通透性和细胞焦亡。目前研究表明,GSDMD 是细胞焦亡的执行者。GSDMD 被激活的caspase 切割,产生1 个GSDMD-N端片段和1 个GSDMD-C 端调控域。GSDMD-N 在焦亡过程中寡聚并插入细胞膜,形成气孔,最终导致焦亡[6-7]。此外,还存在一种钙依赖的膜修复反应,由转运必需内体分选复合物(endosomal sorting com‐plexes required for transport Ⅲ,ESCRTⅢ)介导,通过去除GSDMD 膜孔维持细胞膜完整性,从而抑制细胞渗透性裂解[8]。如果这一机制是抑制GSDMD 膜孔介导的细胞死亡的一种常见反应,那么无细胞的上清中可能含有GSDMD,为GSDMD 作为一种新的胞外炎症性体液生物标志物提供了理论基础[9]。
目前PE 中GSDMD 的定量检测尚未见报道,GSDMD 水平与PE 相关疾病的关系仍不清楚。因此,本研究旨在通过建立临床常用的ELISA检测法,探讨胸膜液中GSDMD 用于鉴别胸膜液病因的临床价值。
1 资料与方法
1.1 资料
1.1.1 研究对象 选取重庆医科大学附属第二医院2018 年10 月至2019 年11 月于呼吸内科就诊的患者161 例,包括漏出性PE 30 例(对照组)、结核性PE 40 例(结核组)、恶性PE 48 例(恶性组)、感染性PE 43 例(感染组)。结核性胸膜炎中的结核病诊断和治疗根据《全球结核病报告》指南诊断。恶性组取自非小细胞肺癌(non-small cell lung cancer,NSCLC)患者,遵循国家综合癌症网络发布的诊疗指南诊断和治疗。本研究不包括合并肺癌和结核性肺炎患者。感染组患者标准:①渗出物与细菌性肺炎、肺脓肿或支气管扩张有关;②以炎症性胸膜炎、慢性脓胸或胸膜纤维化、斑块为表现,胸膜液未见Mtb者。不属于上述任何一种类型的渗出性PE归入“漏出性”组。本研究按照《赫尔辛基宣言》原则进行,经重庆医科大学第二附属医院医学伦理委员会批准。按照标准操作规程采集PE,并立即转入临床试验室。取胸膜液室温15 000 r/min 离心10 min,收集上清,−80 ℃保存待检。本研究受试者临床特征见表1。
表1 PE患者生化和细胞学特征(±s)Tab.1 Biochemical and cytological characteristics in PE patients(±s)
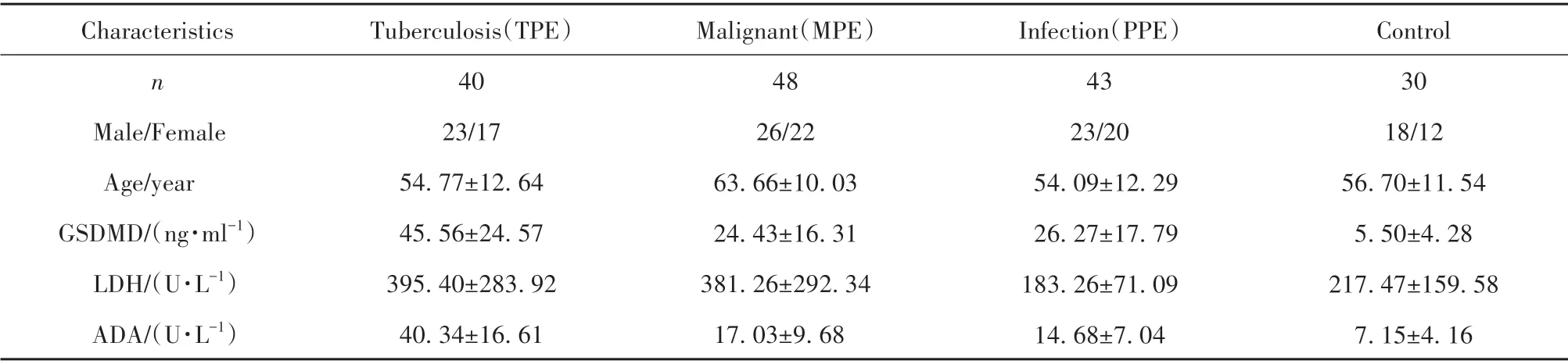
表1 PE患者生化和细胞学特征(±s)Tab.1 Biochemical and cytological characteristics in PE patients(±s)
Characteristics n Male/Female Age/year GSDMD/(ng·ml−1)LDH/(U·L−1)ADA/(U·L−1)Tuberculosis(TPE)40 23/17 54.77±12.64 45.56±24.57 395.40±283.92 40.34±16.61 Malignant(MPE)48 26/22 63.66±10.03 24.43±16.31 381.26±292.34 17.03±9.68 Infection(PPE)43 23/20 54.09±12.29 26.27±17.79 183.26±71.09 14.68±7.04 Control 30 18/12 56.70±11.54 5.50±4.28 217.47±159.58 7.15±4.16
1.1.2 试剂与仪器 GSDMD 单克隆抗体、HRP 酶标抗体(兔抗人免疫球蛋白IgG 抗体,美国Abcam);Corning 96孔酶标板(美国Thermo Fisher Scientific);ELISA 试剂盒(北京万泰);ADA 和LDH 检测试剂盒(四川Maccura);MultiskanTMFC 微平板阅读器(美国Thermo Scientific);7600 自动生化分析仪(日本日立);IMMULITE®1000 化学发光免疫分析仪(德国西门子)。
1.2 方法
1.2.1 GSDMD ELISA 检测法建立 采用单项滴定法确定酶标板上包被抗体浓度,将抗GSDMD 单克隆抗体梯度稀释,以阳性参考品和阴性参考品代替样本,测定OD 值。阳性参考品OD 值>1.0,阴性参考品OD<0.2 为包被最适浓度。100µl 最适浓度的抗GSDMD 单克隆抗体4 ℃包被过夜,次日甩干洗涤后加入5%脱脂牛奶250 µl 封闭,将待测样本加至孔中37 ℃孵育2 h,甩干,含0.1%Tween20的磷酸盐缓冲液洗涤5 次,加入抗GSDMD 多克隆抗体37 ℃孵育1 h,甩干,PBST洗涤3次,每次浸泡2 min,再加入HRP酶标抗体(兔抗人免疫球蛋白IgG)37 ℃孵育30 min,拍干洗板,加入底物TMB 100 µl 37 ℃孵育15 min,加入50 µl 终止液(1 mol/L H2SO4),5 min 内采用MultiskanTMFC 微平板阅读器测量450 nm 处OD值。
1.2.2 标准曲线绘制 将商品化GSDMD 抗原标准品(2 000 pg/ml)倍数稀释,得到浓度为2 000~15.6 pg/ml 的一系列标准品。各浓度标准品重复检测2 次,以超纯水为空白孔样本,OD 差值=实验孔OD 值−空白对照孔OD 值,绘制系列标准品GSDMD浓度和OD差值的标准曲线。
1.2.3 方法学评价 重复性试验:取浓度分别为500、250、125、62.5、31.2 pg/ml 的5 个标准品,批内变异系数采用同批酶标板测定5 次;批间变异系数采用3 批不同时间包被的酶标板测量5 次。干扰试验:随机选择5 份阳性无溶血和黄疸GSDMD 样本,加入一定量(1.2、2.4 和4.8 g/L)血红蛋白和(70、140 和280 µmol/L)胆红素,再次检测GSDMD浓度,进行配对检验,Graphpad Prism 5.0 软件绘制柱状图。
1.2.4 胸膜液指标检测 采用ELISA 试剂盒按照制造商说明检测IFN-γ水平。7600自动生化分析仪检测ADA 和LDH 活性,IMMULITE®1000 化学发光免疫分析仪检测IL-1β水平。
1.3 统计学方法 ELISA 方法学评价包括线性范围、检测限确定、批内和批间变异系数及干扰试验。采用SPSS20.0 软件分析数据。连续变量以±s表示,比较采用t检验,两组间比较采用单因素方差分析。本研究所有检验均为双尾,P<0.05为差异有统计学意义。GSDMD、LDH、ADA 及3 种生物标志物联合诊断的准确性采用受试者操作特征(receiver operating characteristic,ROC)曲线评价,计算特异性、敏感度和曲线下面积(area under the curve,AUC),浓度临界值(cut-off)以最大约登指数计算[10]。
2 结果
2.1 ELISA 法检测GSDMD 方法学建立和评价 当包被抗体浓度为1µg/ml时为最适包被浓度(此时阳性参考品OD>1.0,阴性参考品OD<0.2)。以标准品浓度(15.6、31.2、62.5、125、250、500、1 000、1 500 和2 000 pg/ml)的自然对数为横坐标,OD 差值为纵坐标,绘制浓度与OD 差值曲线(图1A)。当GSDMD 浓度为31.2~250 pg/ml 或250~2 000 pg/ml时,OD 差值接近线性,分别对以上GSDMD 标准浓度的自然对数和OD差值制作标准曲线(图1B)。标准曲线回归方程:①y=0.036 8x+0.041 9(31.2~250 pg/ml,R²=0.954 1),x=ln(X);②y=0.292 8x−1.388 6(250~2 000 pg/ml,R²=0.996 6),x=ln(X)。其检测限为31.2 pg/ml,批内和批间变异系数分别为5.65%和8.63%(表2)。抗干扰能力评价:浓度胆红素(280 µmol/L)和血红蛋白(4.8 g/L)干扰下,GSDMD浓度差异无统计学意义(P>0.05,图2)。

表2 批内和批间重复性实验Tab.2 Intra-batch and inter-batch repeatability

图1 GSDMD 标准品浓度的自然对数与OD 差值曲线图及标准曲线Fig.1 Difference curve and standard curve between natural logarithm and OD of GSDMD standard substance concentration

图2 胆红素(A)和血红蛋白(B)干扰实验Fig.2 Bilirubin(A)and hemoglobin(B)interference ex⁃periments
2.2 PE 中GSDMD、ADA 与LDH 表达的相关性分析 本研究检测患者PE 标本中GSDMD、ADA 和LDH 水平,并对其含量进行相关性分析。包含所有患者时,3 个生物标志物差异有统计学意义。PE 中GSDMD 含量与ADA 呈正相关(r=0.389 8,P<0.001,图3)。

图3 相关性分析Fig.3 Correlation analysis
2.3 GSDMD 对不同类型PE 的鉴别诊断价值 结核组、恶性组、感染组和对照组GSDMD 浓度差异均有统计学意义(P均<0.000 1,图4)。GSDMD 在区分漏出性PE 和恶性PE(AUC=0.947)、结核性PE(AUC=0.998)及感染性PE(AUC=0.951)中具有较高诊断能力,而ADA AUC 分别为0.874、0.945 和0.826,LDH AUC为0.716、0.794和0.524。GSDMD鉴别漏出性PE 和结核性PE 的AUC 水平最高,cut-off值为16.007 ng/ml,灵敏度为100.0%,特异度为96.7%。与ADA 和LDH 相比,GSDMD 在鉴别渗出性PE 与恶性PE、结核性PE 和感染性PE 的诊断灵敏度最高。在鉴别结核性PE 与恶性PE 时,相比于GSDMD(AUC=0.835),ADA的诊断性能略高(AUC=0.845)。在恶性组与感染组、结核组与感染组及结核组与恶性组中的鉴别诊断性能,ADA 和LDH 优于GSDMD(表3)。
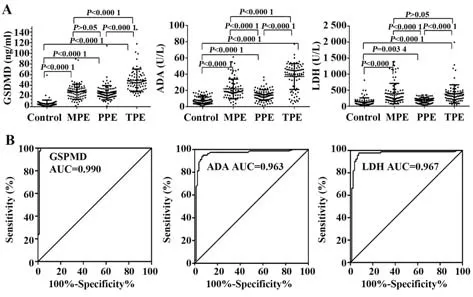
图4 各组GSDMD、ADA和LDH表达及诊断效能Fig.4 GSDMD,ADA and LDH expressions and diagnosis in each group
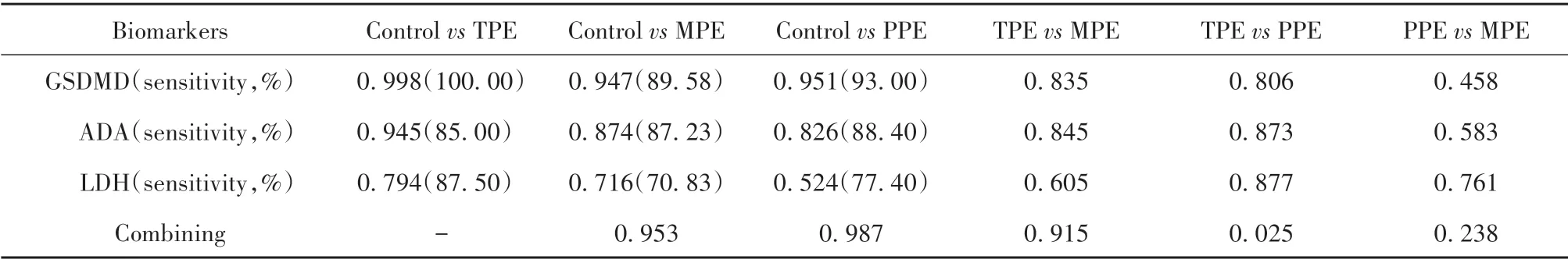
表3 生物标志物鉴别PE的AUC值Tab.3 Value of AUC of biomarkers for PE antidiastole
2.4 GSDMD、ADA 和LDH 联合检测对PE 鉴别诊断的价值 GSDMD、ADA 和LDH 联合检测结果显示,其在对照组与恶性组(AUC=0.953)、对照组与感染组(AUC=0.987)、结核组与恶性组(AUC=0.915)具有更高鉴别诊断能力(表4)。3种指标联用时诊断特异性和敏感度均高于单一生物标志物。

表4 GSDMD、ADA、LDH联合鉴别诊断PE的效能Tab.4 Diagnostic value of combined detection of GSD⁃MD,ADA and LDH for PE antidiastole
3 讨论
焦亡是一种病理原因导致的依赖于caspase 的细胞死亡类型,以磷脂酰丝氨酸接触、孔形成、细胞膜破裂、胞质内容物分泌(包括IL-1β、LDH和IL-18)为特点[7]。近年多项研究表明,不同病理刺激,如感染性疾病(包括普通细菌及Mtb、神经系统疾病、癌症等)均可引起焦亡[9-16]。焦亡主要发生于单核细胞和巨噬细胞,诱导溶解性细胞死亡[17]。近期研究显示,一种钙依赖的膜修复机制——ESCRTⅢ可拮抗焦亡[8]。作为进化上保守的触发细胞膜修复的机制,钙通量通过溶酶体等囊泡胞吐、膜附件蛋白动员及ESCRT 机制修复细胞膜损伤[18]。基于这一膜修复机制,无细胞培养上清中将检测到GSDMD[6]。此外,焦亡是一种细胞溶解性死亡方式,细胞膜破裂后,GSDMD 可能大量释放。以上研究为PE 可检出GSDMD提供了理论依据。
GSDMD-N结构域导致的孔隙会引起细胞焦亡,但也会产生超活性细胞,其GSDMD 孔隙数少于焦亡细胞[19]。焦亡过程中,细胞膜破裂、胞质蛋白释放、超活性细胞亦会释放胞质蛋白。已有研究证实,孔隙形成蛋白GSDMD 可调节过度活跃的巨噬细胞释放IL-1,提示GSDMD可能成为比其他炎症性生物标志物敏感度更高的指标[20-24]。近年越来越多的生物标志物被用于PE 鉴别诊断,如IL-27 用于结核性PE 诊断的灵敏度为96.1%,CXCL9 为97.7%,CXCL11 为95.4%,以及新型生物标志物CD44等[22-24]。而GSDMD 用于诊断结核性PE 的灵敏度高达100%,在PE早期诊断中起不可或缺的作用。
本研究观察到GSDMD 在不同病理条件下伴有不同程度升高,GSDMD 鉴别漏出性PE 和其他病理性PE 的AUC 值均>0.94。GSDMD AUC 平均值为0.965,而ADA为0.882,LDH为0.678。可见GSDMD在鉴别漏出性PE和其他病理性PE方面的诊断效能高于ADA 和LDH。GSDMD 区分漏出性PE 和结核性PE 的敏感度和特异性分别为100.0%和96.7%(AUC=0.990),cut-off 值为16.007 ng/ml。GSDMD不仅在结核性PE鉴别诊断方面表现出明显优势,且在结核性PE 和恶性PE 鉴别(AUC=0.835)、结核性PE 和感染性PE 鉴别(AUC=0.806)中也表现良好。本研究也依据最高的诊断准确率计算了GSDMD 的cut-off 值。虽然GSDMD 在PE 鉴别诊断中还存在一些不足,如恶性PE 与感染性PE 鉴别、结核性PE 与感染性PE鉴别,但GSDMD仍具有良好的诊断性能,且GSDMD、ADA 和LDH 3 种指标联用进一步提高了诊断能力。
本研究建立的GSDMD ELISA 法最低检出限可达到31.5 pg/ml,抗血红蛋白(4.8 g/L)和胆红素(280µmol/L)干扰性较好。低浓度范围的标准曲线相关性不理想(R2=0.954 1),批间变异系数较大(15.1%),可能是ELISA 检测易受干扰所致,需更多研究探索更好的检测条件或其他更稳定灵敏的检测方法。总之,采用间接双抗夹心ELISA 法检测PE GSDMD,简单易行,灵敏度高,线性范围广,可在一般医院开展。
本研究仍有一些局限性。首先,纳入人群有限,可能导致结果偏倚。此外,很难排除PE 的误分类,尤其是漏出性PE 和感染性PE。同时PE 采集仍是一种有创检测,血清正常GSDMD 水平有待进一步明确。
综上,本研究建立了ELISA定量检测PE GSDMD的方法,并探讨了GSDMD 在不同类型PE(包括漏出性、结核性、恶性和感染性PE)鉴别诊断中的临床价值。GSDMD 浓度不仅可作为一种新的PE鉴别诊断生物标志物,具有较高诊断敏感度,且可与ADA 和LDH结合进一步提高诊断能力。