PTPMeg2的PTP结构域对磷酸化STAT3入核的抑制作用
苏富琴 王玉春 齐占朋 孙 超 李淑艳
(齐齐哈尔医学院生物化学教研室,黑龙江 齐齐哈尔 161006)
PTPMeg2的PTP结构域对磷酸化STAT3入核的抑制作用
苏富琴1王玉春2齐占朋2孙 超2李淑艳
(齐齐哈尔医学院生物化学教研室,黑龙江 齐齐哈尔 161006)
目的 探讨PTPMeg2结构域对磷酸化STAT3核转位的影响。方法 采用免疫共沉淀技术研究PTPMeg2与STAT3不同结构域的相互作用,采用GST pull down实验研究STAT3与PTPMeg2不同结构域的相互作用,用激光共聚焦显微镜直接观察PTPMeg2对磷酸化STAT3细胞定位的影响。结果 STAT3与PTPMeg2的所有结构域均有相互作用,PTPMeg2的PTP结构域和△SEC结构域(PTP结构域+LK结构域)可以抑制磷酸化STAT3入核。结论 PTPMeg2的PTP结构域对磷酸化STAT3的入核具有抑制作用。
PTPMeg2;磷酸化STAT3;核转位
STAT为一类存在于细胞质中的信号转导和转录激活因子。STAT3信号通路能被多种因子所激活,如白细胞介素(IL)-6家族因子、表皮生长因子(EGF)、血小板源样生长因子(PDGF)、胰岛素样生长因子(IGF)等生长因子〔1〕,以及 v-Src、v-Sis、v-Fps、v-Ros、IGF-IR、c-Eyk/v-Eyk 等原癌蛋白〔2〕。在许多肿瘤中都检测到了持续激活或者高水平磷酸化的STAT3〔3〕。PTPMeg2是存在于细胞质中的蛋白酶,已经证实STAT3是PTPMeg2的直接底物,PTPMeg2对磷酸化的STAT3具有直接去磷酸化作用〔4〕,Yuan等〔5〕发现 PTPMeg2 还可以通过抑制磷酸化EGF受体(EGFR)水平和磷酸化ErBb2水平间接降低磷酸化STAT3水平。目前,磷酸化STAT3负调控的研究热点集中在几个层面:激酶水平的负调控,磷酸化STAT3核转位的负调控,STAT3结合DNA的负调控,STAT3的蛋白降解。本研究通过乳腺癌MCF7细胞转染外源性基因后,通过激光共聚焦显微镜直接观察PTPMeg2的不同结构域对IL-6激活的磷酸化STAT3核转位的影响。
1 材料与方法
1.1 质粒和抗体 PTPMeg2 WT由美国Oklahoma健康科学中心赵志壮教授惠赠。Myc-PTPMeg2 SEC、Myc-PTPMeg2△SEC、Myc-PTPMeg2 PTP、Myc-PTPMeg2 △PTP、Myc-PTPMeg2 LK 由清华大学医学院常智杰教授惠赠。pXJ40/Flag-STAT3、pXJ40/Flag-STAT3-NTO、pXJ40/Flag-STAT3-M1、 pXJ40/Flag-STAT3-SH2+CT以及pXJ40/GST、pXJ40/GST-STAT3由新加坡国立大学曹新民博士惠赠。转染试剂vigofect购自威格拉斯试剂公司。抗鼠 Myc、抗兔-FITC、抗鼠-TRITC、抗兔-HRP、抗鼠-HRP均为Santa Cruz公司产品。
1.2 细胞培养及细胞转染 HEK293T细胞及乳腺癌细胞MCF7于含5%CO2的37℃培养箱中培养,培养基为含10%胎牛血清及 100 U/ml青霉素、100 mg/L链霉素的DMEM培养基。所用细胞均为对数增长期细胞。取对数生长期细胞,更换新鲜完全培养基2.5 h后进行转染。按照vigofect转染说明书,在一个转染管中将100 μl 0.9%NaCl与需要转入的质粒DNA混和,在另一转染管中将0.9%NaCl与的vigofect等体积混和,室温放置5 min。然后将含有vigofect的混合液滴加到质粒DNA的混合液中,混匀,在室温放置15 min后滴入细胞培养基中。转染后3 h更换新鲜的完全培养基。
1.3 GST pull down实验 用表达GST或者GST-STAT3的真核表达质粒和pcDNA3.1/PTPMeg2、Myc-PTPMeg2 SEC、Myc-PTPMeg2△SEC、共转染HEK-293T细胞后,培养48 h,收获细胞并用细胞裂解液〔80 mmol/L KCl,10 mmol/L Na2HPO4,1 mmol/L EDTA(pH8.0),0.5%NP-40,10%Glycerol,1 mmol/L DTT,1 mmol/L PMSF,1 μg/ml Aprotinin,1 μg/ml Leupeptin,1 μg/ml Pepstatin,0.1 mmol/L Na3VO4〕裂解细胞;在细胞裂解液中加入30 μl处理好的GST Sepharose-4B beads悬旋液,在4℃旋转过夜;1 500 r/min,4℃离心后弃上清,用细胞裂解缓冲液漂洗,离心,在沉淀中加入30 μl 2×十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)上样液,SDS-PAGE分离蛋白复合物;Western杂交检测相应的结合蛋白。
1.4 免疫共沉淀试验(Co-IP)及Western印迹 HEK293T细胞单独转染 pcDNA3/Myc-PTPMeg2,共同转染 pcDNA3/Myc-PTPMeg2 及 pXJ40/Flag-STAT3、 pXJ40/Flag-STAT3-NTO、pXJ40/Flag-STAT3-M1、pXJ40/Flag-STAT3-SH2+CT。收获转染24 h的细胞,用细胞裂解液冰上裂解细胞30 min,4℃高速离心15 min。取细胞裂解上清加等容的2×SDS-PAGE上样液变性10 min,-20℃保存备用。其余的细胞裂解物,加入2 μg Flag抗体,4℃混合4 h。然后在上述混合物中加入30 μl G蛋白耦联的葡聚糖颗粒悬浮液,4℃旋转混合过夜。洗涤葡聚糖颗粒4次,在沉淀中加入 30 μl 2×SDS-PAGE 上样液煮 10 min。Western印迹杂交分析蛋白表达。使用10%的SDS-PAGE电泳,转膜后用Western印迹检测相应的结合蛋白。
1.5 细胞免疫荧光染色 将对数生长期的乳腺癌MCF7细胞种植于铺有载玻片的6孔板中,待细胞贴壁后进行转染。转染24 h用IL-6刺激细胞30 min,洗涤后用4%多聚甲醛/磷酸盐缓冲液(PBS)固定,PBS洗涤,加入穿透液(0.3%Triton-X 100/PBS),洗涤,封闭液室温封闭1 h。加一抗(抗兔Flag抗体1∶100稀释;抗小鼠myc抗体1∶100稀释)4℃过夜。相应的二抗1∶200稀释液避光孵育,37℃ 1 h,PBST浸泡洗涤,除盐后用防荧光淬灭的封片剂(甘油)封片。激光共聚焦显微镜观察并拍照。
2 结果
2.1 PTPMeg2与STAT3的所有结构域均存在相互作用 为了确定PTPMeg2与STAT3结合结构域,将STAT3的六个功能结构域(N-端功能域、螺旋结构域、DNA结合结构域、连接结构域,SH2结构域以及转录激活结构域)分成了3个部分,即Flag-NTO结构域、Flag-M1结构域、Flag-SH2+CT结构域。PTPMeg2全长和STAT3的功能结构域分别进行共同表达,通过免疫共沉淀的方法分析PTPMeg2与STAT3相互作用结构域,结果PTPMeg2与STAT3所有结构域均有相互作用。见图1,图2。
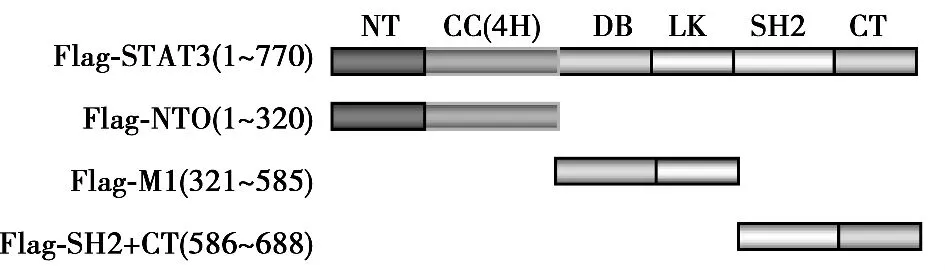
图1 STAT3结构域示意图
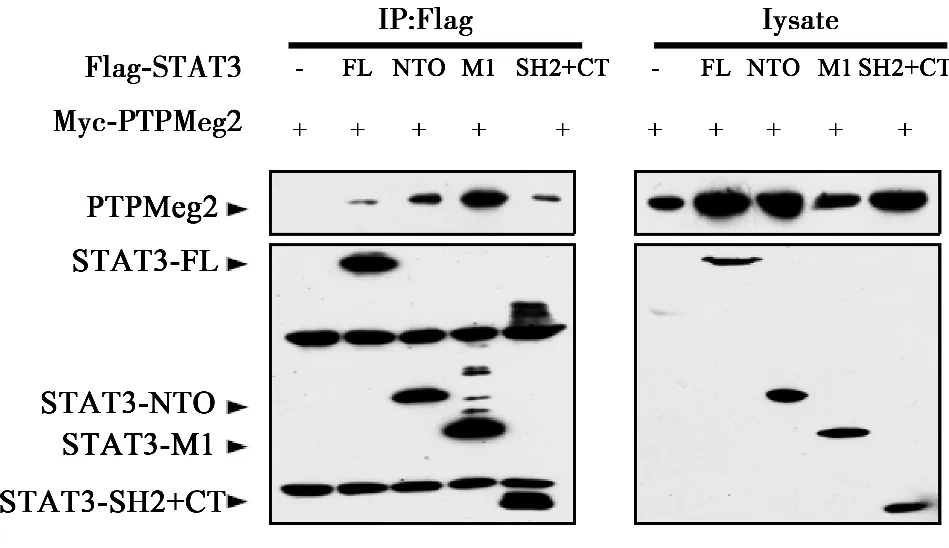
图2 STAT3不同结构域与PTPMeg2全长的相互作用
2.2 STAT3与PTPMeg2的所有结构域均存在相互作用 采用真核细胞GST pull down实验,在HEK293T细胞中同时共转染了GST-STAT3和PTPMeg2各个结构域的质粒,用GST beads进行pull down实验。Western印迹检测结果表明,PTPMeg2全长和其所有的结构域与STAT3通过pull down沉淀得到的复合物中检测到了明显的PTPMeg2相应的特异性条带。而对照组用GST所作的pull down沉淀中没有检测到相互作用。见图3,图4。
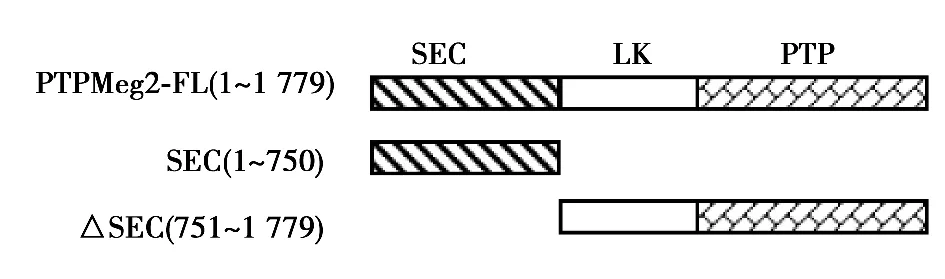
图3 PTPMeg2结构域示意图
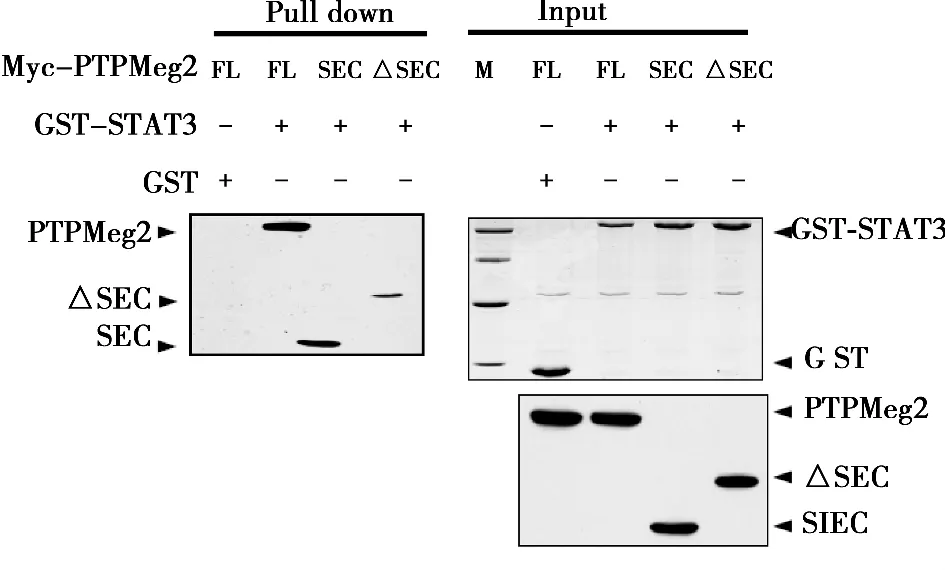
图4 PTPMeg2不同结构域与STAT3全长的相互作用
2.3 PTPMeg2的PTP结构域可抑制磷酸化STAT3入核 PTPMeg2的结构域与STAT3均有相互作用,这些结构域知否对活化的STAT3的细胞定位有影响,我们同样在乳腺癌MCF7细胞中共表达了PTPMeg2的不同结构域以及STAT3,在IL-6激活30 min后检测STAT3的细胞定位变化。结果显示,PTPMeg2的SEC结构域仍然在胞质中呈均匀分布,对STAT3的入核也没有抑制作用(见图5b1~图5b3),SEC结构域的缺失突变体则在胞质中呈点状分布,并且可以抑制活化的STAT3入核(见图5d1~图5d3)。SEC结构域的缺失突变体含有连接结构域和PTP结构域,是否是PTP结构域引起的变化,在PTP结构域的共转染细胞中,同样观察到了PTPMeg2蛋白呈明显的点状分布,并且也同样抑制活化的STAT3入核(见图5f1~图5f3)。对于PTP结构域的缺失突变体在胞浆中呈现均匀分布,与SEC结构域相同,也不能阻止活化的STAT3入核(见图5h1~图5h3)。说明PTP结构域是PTPMeg2的功能结构域。
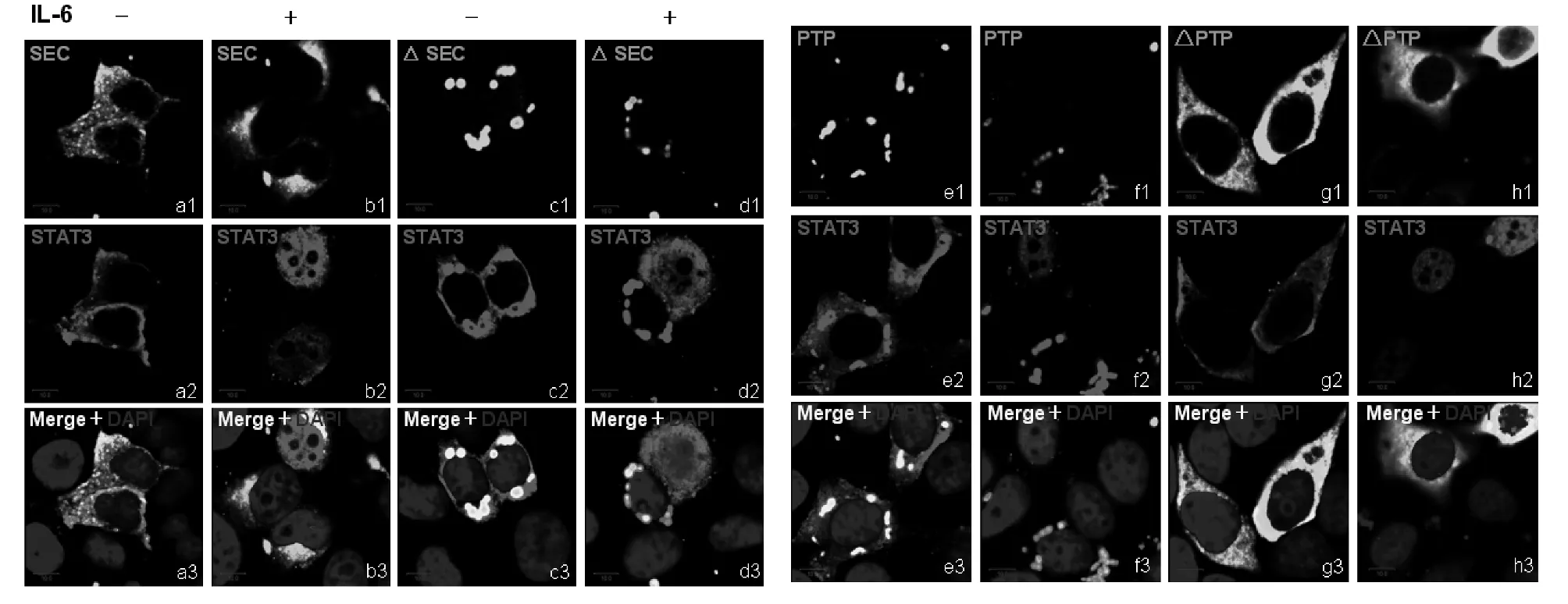
图5 PTPMeg2结构域对STAT3的细胞定位变化
3 讨论
STAT3在细胞生长、分化、存活甚至凋亡等都起到重要作用的蛋白,是 STAT信号通路中的一个重要的结点蛋白〔6〕。STAT3功能发挥的关键在于能够特异性地并且以不同的亲和力与其他各类分子(包括蛋白质)结合,甚至形成大的复杂的复合物。病理情况下,STAT3在肿瘤中呈现持续活化或者高磷酸化状态,这种持续活化的状态可能是由于激酶的持续激活或者磷酸酶的失活引起的。PTPMeg2是与STAT3存在相互作用的磷酸酶,是 STAT3 的负性调控因子〔4,5〕。
STAT3信号通路的负调控主要从以下几个层次得到了研究:(1)激酶水平上的负调控。有研究〔7〕表明,SHP2通过和gp130受体Y759位点的结合,从而起到对STAT3信号通路的抑制作用。苯氨基嘧啶类(STI751)和第一种对AG490能抑制JAK激酶,从而抑制白血病增殖而对正常造血无影响〔8〕。第三种吡哆(2、3 d)吡拉明酪氨酶激酶能选择性抑制C-Src激酶,对通过C-Src激酶途径的肿瘤细胞具有明显的抗增殖作用〔9〕。JAB、CIS及SOCS3蛋白通过和JAK2激酶的酪氨酸激酶功能域结合,从而阻止JAK2对STAT3的激活作用〔10〕。(2)STAT3的核转位负调控。对于STAT3的核转位的负调控包括对其入核的抑制和对其出核的协助。两个不同的研究小组分别采用酵母双杂交的方法,得到与STAT3相互作用的蛋白GRIM。GRIM可以通过抑制STAT3的入核对STAT3的信号通路达到负调控的目的〔11〕。(3)STAT3结合DNA的负调控。PIAS3可以特异的和磷酸化的STAT3进行结合,从而影响STAT3结合DNA的能力〔12〕。(4)STAT3 的蛋白降解。2000 年,Daino等〔13〕发现,STAT3可以通过泛素化方式降解,从而抑制HL60等白血病细胞的增殖。Tanaka等〔14〕发现PDZ-LIM 结构蛋白PDLIM2可以作为E3酶介导STAT3的蛋白酶体降解,从而抑制TH17细胞的形成,阻断其在肉芽肿中发挥的病理作用。(5)STAT3的小分子抑制剂。小分子物质直接抑制STAT3与DNA结合。LLL12和FLLL32作为小分子抑制剂,直接靶向STAT3,抑制其与DNA的结合,从而引起肿瘤的增殖抑制作用〔15~17〕。另外直接靶向STAT3的microRNA let-7也可以直接抑制STAT3发挥作用〔18〕。
PTP结构域是磷酸酶去磷酸化作用的功能结构域〔6〕。本实验结果可见STAT3与PTPMeg两种蛋白的所有结构域之间都有相互作用,具体机制不是特别清楚。内源性的蛋白之间相互作用仍然是蛋白的全长在起作用,PTPMeg2的全长蛋白就对磷酸化的STAT3起到直接和间接的去磷酸化作用,而PTPMeg2的PTP结构域也是其发挥去磷酸化作用的功能结构域〔4〕。本研究发现含有PTP结构域的片段都可以对磷酸化STAT3起到抑制作用,这种抑制是否是与亲核蛋白形成的大的复核体而阻止其入核,还是封闭了STAT3的核定位信号蛋白的功能,还需要进一步深入研究。
1 Ruff-Jamison S,Chen K,Cohen S.Induction by EGF and interferon-gamma of tyrosine phosphorylated DNA binding proteins in mouse liver nuclei〔J〕.Science,1993;261(5129):1733-6.
2 Besser D,Bromberg JF,Darnell JE,et al.A single amino acid substitution in the v-Eyk intracellular domain results in activation of Stat3 and enhances cellular transformation〔J〕.Mol Cell Biol,1999;19(2):1401-9.
3 Groner B,Lucks P,Borghouts C.The function of Stat3 in tumor cells and their microenvironmen〔tJ〕.Semin Cell Dev Biol,2008;19(4):341-50.
4 Su F,Ren F,Rong Y,et al.Protein tyrosine phosphatase Meg2 dephosphorylates signal transducer and activator of transcription 3 and suppresses tumor growth in breast cancer〔J〕.Breast Cancer Res,2012;14(2):2-13.
5 Yuan T,Wang Y,Zhao ZJ,et al.Protein-tyrosine phosphatase PTPN9 negatively regulates ErbB2 and epidermal growth factor receptor signaling in breast cancer cells〔J〕.J Biol Chem,2010;285(20):14861-70.
6 Resemann HK,Watson CJ,Lloyd-Lewis B.The Stat3 paradox:a killer and an oncogene〔J〕.Mol Cell Endocrinol,2013;382(1):603-11.
7 Ohtani T,Ishihara K,Atsumi T,et al.Dissection of signaling cascades through gp130 in vivo:reciprocal roles for STAT3-and SHP2-mediated signals in immune responses〔J〕.Immunity,2000;12(1):95-105.
8 Caceres-Cortes JR.A potent anti-carcinoma and anti-acute myeloblastic leukemia agent,AG490〔J〕.Anticancer Agents Med Chem,2008;8(7):717-22.
9 Nagaraj NS,Smith JJ,Revetta F,et al.Targeted inhibition of SRC kinase signaling attenuates pancreatic tumorigenesis〔J〕.Mol Cancer Ther,2010;9(8):2322-32.
10 Zhang L,Badgwell DB,Bevers JJ,et al.IL-6 signaling via the STAT3/SOCS3 pathway:functional analysis of the conserved STAT3 N-domain〔J〕.Mol Cell Biochem,2006;288(1-2):179-89.
11 Lufei C,Ma J,Huang G,et al.GRIM-19,a death-regulatory gene product,suppresses Stat3 activity via functional interaction〔J〕.Embo J,2003;22(6):1325-35.
12 Chung CD,Liao J,Liu B,et al.Specific inhibition of Stat3 signal transduction by PIAS3〔J〕.Science,1997;278(5344):1803-5.
13 Daino H,Matsumura I,Takada K,et al.Induction of apoptosis by extracellular ubiquitin in human hematopoietic cells:possible involvement of STAT3 degradation by proteasome pathway in interleukin 6-dependent hematopoietic cells〔J〕.Blood,2000;95(8):2577-85.
14 Tanaka T,Yamamoto Y,Muromoto R,et al.PDLIM2 inhibits T helper 17 cell development and granulomatous inflammation through degradation of STAT3〔J〕.Sci Signal,2011;4(202):85.
15 Fossey SL,Bear MD,Lin J,et al.The novel curcumin analog FLLL32 decreases STAT3 DNA binding activity and expression,and induces apoptosis in osteosarcoma cell lines〔J〕.BMC Cancer,2011;11(2):112.
16 Onimoe GI,Liu A,Lin L,et al.Small molecules,LLL12 and FLLL32,inhibit STAT3 and exhibit potent growth suppressive activity in osteosarcoma cells and tumor growth in mice〔J〕.Invest New Drugs,2012;30(3):916-26.
17 Couto JI,Bear MD,Lin J,et al.Biologic activity of the novel small molecule STAT3 inhibitor LLL12 against canine osteosarcoma cell lines〔J〕.BMC Vet Res,2012;8(5):244.
18 Patel K,Kollory A,Takashima A,et al.MicroRNA let-7 downregulates STAT3 phosphorylation in pancreatic cancer cells by increasing SOCS3 expression〔J〕.Cancer Lett,2014;347(1):54-64.
R-33
A
1005-9202(2015)09-2355-04;
10.3969/j.issn.1005-9202.2015.09.020
黑龙江省自然科学基金(No.D201084)
1 清华大学医学院 2 齐齐哈尔医学院药理教研室
李淑艳(1968-),女,教授,博士,主要从事肿瘤生物治疗研究。
苏富琴(1971-),女,副教授,博士,主要从事蛋白修饰与肿瘤发生发展关系及抗肿瘤药物研究。
〔2014-03-11修回〕
(编辑 袁左鸣/滕欣航)

