miR-935在Notch1介导的儿童T-ALL中的作用机制研究①
谢淑佩 叶 瑶 陈庆法 李 红 林媛媛 (江西省儿童医院,南昌 330006)
T 淋巴细胞白血病(T-acute lymphoblastic leuke‐mia,T-ALL)是一种血液肿瘤,由T 细胞系中未成熟的淋巴细胞发展而来,T-ALL患者会出现严重感染、全身部位出血、呼吸系统衰竭等多种并发症,严重时甚至会导致死亡,是一类危害巨大的恶性疾病[1]。T-ALL 患者以低龄儿童居多,传统医疗手段对于患儿的毒副作用较大,容易造成其他方面的危险情况[2],因此开发一种高效、少副作用的治疗T-ALL 手段,具有重大科学意义。最新研究发现,Notch1 的表达紊乱与T-ALL 的产生扩散具有重要联系,靶向Notch1 可作为治疗T-ALL 的重点研究方向[3],但就目前的报道结果来看,直接通过调控Notch1 治疗T-ALL 仍缺乏高特异性的方法,同时存在较大的副作用,临床治疗仅停留在理论水平,相关研究依旧处于探索阶段。miR-935 是近年来新发现的一种高度保守的miRNA,可参与多种恶性肿瘤的发生发展,已有学者在食管鳞癌、肝癌、脑胶质瘤等肿瘤中进行了miR-935 相关的实验[4]。研究证实,miR-935与Notch1 存在结合位点,二者具有靶向关系[5]。但关于miR-935 在T-ALL 中的研究还鲜见报道,其具体作用机制和功效尚不十分明确。通过前期小样本实验发现,T-ALL 患儿血清miR-935 呈低表达,且miR-935 与Notch1 可能存在结合位点,二者具有靶向关系。基于上述研究结果,本实验拟将进行体外细胞实验,验证miR-935 在Notch1 所介导T-ALL 中的作用和机制,以期为儿童T-ALL 的临床防治提供有效的科学依据。
1 材料与方法
1.1 材料
1.1.1 实验细胞 实验所用T-ALL 细胞株为MOLT-4,购自派通生物技术有限公司。
1.1.2 试剂与仪器 RPMI1640 培养基购自重庆普立科生物技术有限公司;双荧光素酶检测试剂盒购自泽叶课件有限公司;MTT 试剂盒购自陕西玉泽实验器材有限公司;细胞凋亡检测试剂盒购自武汉富鑫远科技有限公司;荧光PCR 试剂盒南通艾得尔实验器材有限公司;Notch1 及β-actin 抗体购自艾博抗贸易有限公司;GloMax 生物发光检测仪购自江苏美正有限公司;DR-200BS型酶标仪购自郑州南北仪器有限公司;Apogee 流式细胞仪购自伯齐科技有限公司;E-Blotter 湿转仪购自美国Wealtec 公司;ABI6000 型荧光定量PCR 仪购自美国Thermo 公司;MJX-50B 型恒温培养箱购自绍兴万力仪器有限公司。
1.2 方法
1.2.1 荧光素酶报告基因实验 使用miRWalk 预测miR-935 的靶基因,然后结合基因功能挑选靶基因Notch1并进行验证。构建野生型(WT-3'-UTR)和突变型(MUT-3'-UTR)PTEN 3'-UTR-荧光素酶表达载体,并将其和miR-935 inhibitor 转入T-ALL 细胞中培养48 h。加入100µl的PLB 裂解细胞。移取裂解液于发光板中,再加入100µl LARⅡ工作液混匀,读取1 次测量荧光值。随后,每样品再加入100 µl Stop&Glo®Reagent,淬灭之前的反应,再读取第2 次数值,以Renilla为内参计算结果。
1.2.2 细胞培养、转染及分组 将T-ALL细胞常规培养于含10%FBS、1%双抗的RPMI1640 培养基中,培养条件为37 ℃、5%CO2,隔天换液。收集对数期细胞进行转染并分组,其中对照组给予等量PBS;miR-935 过表达组:转染miR-935 模拟物;miR-935沉默组:转染miR-935 抑制体;Notch1 过表达组:转染Notch1 重组质粒;Notch1 沉默组:转染Notch1 siRNA。转染方法:将400µl 去核酸酶水加入管中,振荡10 s 加速溶解,脂质体体积∶DNA 质量(1∶2)混合比例转染细胞。在转染管中无血清培养基,加入MyoD 的DNA,振荡后再加入转染试剂,再次振荡。常温放置15 min,吸取培养液后用PBS清洗,加入混合液,将细胞置于培养箱孵育1 h 移去混合液,继续培养48 h。免疫荧光确定转染情况。
1.2.3 MTT 法检测细胞活力 取各组细胞,接种至孔板,调整密度为2×104个/ml,每孔100 µl,每组设5个复孔,置于温箱培养,以培养基为校正孔。之后加入20 µl 的MTT 溶液孵育4 h,再加入DMSO 150µl,检测490 nm处的吸光度,计算细胞活力(%)=(A实验−A校正)/(A对照−A校正)×100%。
1.2.4 流式细胞仪检测细胞凋亡及周期 收集各组细胞以0.25%胰酶消化,1 500 r/min 离心10 min,去上清,PBS 洗2 次,吸尽上清液,再加70%预冷乙醇并振荡,4 ℃固定过夜。用PBS 清洗1 次,室温条件下每管加30µl碘化丙啶染色20 min,仪器检测细胞周期情况。细胞凋亡实验操作前期步骤同上,取细胞离心并固定,调整每孔细胞个数,按说明书加入染色剂10 ml,置于4 ℃冰箱中孵育30 min,仪器测定结果并分析。
1.2.5 RT-PCR 法检测miR-935 表达 用Trizol 法裂解细胞并提取总RNA,使用逆转录试剂盒将mRNA反转录成cDNA。冰上准备50µl扩增反应体系:2×SYBR 25µl,正、反向引物各1µl,cDNA 2µl,双蒸水20.7 µl,TaqDNAPolymerase 0.3 µl。在RTPCR 仪上反应,实验条件为:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火30 s,45 个循环,95 ℃进行10 s,65 ℃进行60 s,97 ℃进行1 s。记录各孔Ct 值,以U6 为内参,采用2−ΔΔCt法计算,其中ΔΔCt=ΔCt实验−ΔCt对照,ΔCt=Ct目的−Ct内参。引物序列及产物大小见表1。

表1 引物序列Tab.1 Primer sequence
1.2.6 Western blot 检测蛋白表达 取各组T-ALL细胞加入细胞液裂解反应15 min,用BCA 试剂盒测定蛋白浓度。沸水加热样品使蛋白变性,拿出样品冷却至室温,移取30µg进行电泳,湿转至PVDF膜。常温下以5%脱脂牛奶封闭2 h,用TBST 清洗3 次,加入Notch1 和β-actin 一抗(1∶1 000)4 ℃孵育过夜,洗膜,加二抗(1∶2 000)常温下孵育1 h,洗膜3次后,用化学发光法进行显影处理,拍照,Image J(v1.7.0)软件分析,以β-actin 作为内参蛋白,相对表达量=目标蛋白灰度值/参照蛋白灰度值。
1.3 统计学方法 数据分析使用SPSS21.0 软件,结果以±s表示,多组间比较用单因素方差分析,两两比较用LSD-t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 miR-935 靶向调控Notch1 及各组Notch1 蛋白水平比较 miRWalk 靶基因预测数据库预测miR-935 的靶基因为Notch1;双荧光素酶实验结果显示,miR-935 inhibitor 显著降低了WT-Notch1 的相对荧光活性,但对MUT-Notch1无显著影响,同时对照组、miR-935 过表达组、miR-935 沉默组、Notch1 过表达组、Notch1 沉默组的Notch1 蛋白表达量分别为0.63±0.06、0.24±0.04、0.87±0.11、0.90±0.08、0.21±0.02。与对照组相比,miR-935 沉默组和Notch1 过表达组Notch1 表达显著增加,miR-935 过表达组和Notch1 沉默组Notch1 表达显著下降(P<0.05)。miR-935过表达可降低Notch1水平,而miR-935沉默Notch1表达增加,可推测Notch1是miR-935的直接靶基因,见图1、2。

图1 荧光素酶报告结果Fig.1 Luciferase report results
2.2 各组miR-935 水平比较 对照组、miR-935 过表达组、miR-935 沉默组、Notch1 过表达组、Notch1沉默组的miR-935 相对表达量分别为1.00、1.78±0.35、0.41±0.07、0.94±0.12、0.97±0.08。与对照组相比,miR-935 过表达组miR-935 水平显著上升,miR-935 沉默组水平显著下降(P<0.05);Notch1 过表达组和沉默组miR-935 相对表达量无明显变化(P>0.05)。见图3。
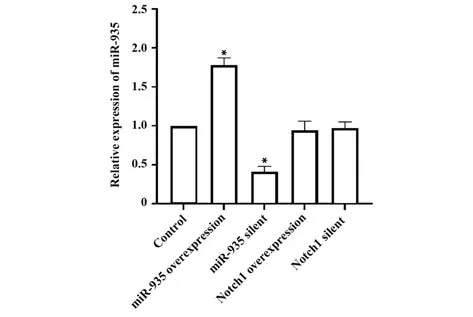
图3 各组miR-935相对表达量比较Fig.3 Comparison of relative expression levels of miR-935 in each group
2.3 miR-935、Notch1 对T-ALL 细胞活性的影响对照组、miR-935 过表达组、miR-935 沉默组、Notch1过表达组、Notch1 沉默组的细胞抑制率分别为100.00%、(45.92±5.13)%、(104.03±2.11)%、(105.29±1.53)%、(44.63±3.27)%、;miR-935过表达和Notch1表达沉默可显著降低T-ALL 细胞活力,而miR-935沉默和Notch1 过表达则会促进细胞增殖(均P<0.05),见图4。

图2 各组Notch1蛋白相对表达量比较Fig.2 Comparison of relative expression of Notch1 protein in each group

图4 各组细胞活力比较(n=5)Fig.4 Comparison of cell viability in each group(n=5)
2.5 miR-935、Notch1 影响T-ALL 细胞周期 流式细胞法显示:与对照组相比,miR-935 过表达组和Notch1 过沉默组细胞处在G0/G1期的细胞占比显著上升,处于S 期的细胞数目减少,提示T-ALL 细胞被阻滞在了G0/G1期,增殖受抑制;而miR-935 沉默组和Notch1 过表达组细胞的周期情况与上述相反,见图5。

图5 各组细胞周期分布比较Fig.5 Comparison of cell cycle distribution in each group
2.6 miR-935、Notch1 影响T-ALL 细胞凋亡 对照组、miR-935 过表达组、miR-935 沉默组、Notch1 过表达组、Notch1 沉默组的细胞抑制率分别为(8.12±1.43)%、(35.13±5.67)%、(4.08±1.25)%、(3.77±0.98)%、(36.08±6.32)%。与对照组相比,miR-935过表达组和Notch1 沉默组凋亡率显著提高,而miR-935 沉默组和Notch1 过表达组凋亡率显著降低(P<0.05)。见图6。

图6 各组细胞凋亡结果比较Fig.6 Comparison of apoptosis results in each group
3 讨论
儿童T-ALL扩散较快,患者预后不良率高,同时会引发其他的并发症,如中枢系统白血病等,严重危害了患儿的健康[6]。虽然移植手术配合化疗对于T-ALL 具有较好的疗效,但药物耐药性及副作用仍是待解决的问题,同时严重不良预后的问题也依旧无法忽视[7]。药物靶向调控是开发治疗患儿T-ALL手段的关键,而深入探究T-ALL 的发病机制及治疗靶点有助提升与患儿T-ALL临床诊疗水平。在众多的细胞因子中,Notch1 被认为是治疗T-ALL 的重要靶点,Notch1 功能较多,一方面可作为膜蛋白受体接受外源信号,另一方面Notch1 也作为转录因子,表现出对下游基因表达的调控作用,在造血前体细胞向T 细胞系分化起到重要作用[8-9]。相关研究报道,超过半数的T-ALL 患者存在Notch1 基因的突变,从而表现出与健康个体不符的表达紊乱,使得体内信号因子出现异常,诱导了疾病的发生[10]。实验发现,对大鼠的造血干细胞进行转染,将突变型Notch1 基因导入细胞中并植入大鼠,所有的实验体在移植后都出现了T-ALL 症状,提示Notch1 是T-ALL的发生的重要原因,同时也说明针对Notch1的靶向治疗具有较好的科学性[11-12]。相关研究表明Notch1 信号在T-ALL 中至少存在4 条调控途径,分别为:①Notch1/HES1 途径可以上调PI3K 水平进而启动活化PI3K-AKT-mTOR 通路并介导多种细胞活动,如由细胞生长因子接触介导的细胞发育与增殖,与抑癌基因PTEN 的作用互为拮抗,可以使T-ALL 细胞增殖不受抑制[13];②Notch1/cMYC 途径与合成代谢有关,通路活化后会促进下游基因的表达,使细胞分裂和代谢加快,并产生协同作用,诱导更多生长基因的表达,是T-ALL 密切相关的中心通路[14];③通过促进CCND3 和CDK6 等蛋白的表达,诱导T前体细胞G1/S的分化;另外Notch1对SKP2的表达有促进作用,与CDKN1B 和CDKN1A 降解共同促使造血细胞周期提前进入S 期[15];④激活NF-κB通路,通过IL-7R 的α 链调控p53的表达和活化,p53具有较好的抑癌功效,在T-ALL 内高表达可以诱导凋亡,同时p53 还具有基因缺陷的修复功能,Notch1抑制p53 从而促使T-ALL 的发生[16]。汤煜媛等[17]也通过分析总结Notch1 通路在T-ALL 治疗中的应用提出,靶向Notch1 可以治疗T-ALL 具有巨大的潜力。
miRNA 是一类长度为19~23 nt 的内源性单链非编码微小RNAs 分子,miRNA 的二级结构为A 型双螺旋,可通过与下游靶基因的3'-UTR 相结合,实现对细胞基因转录后水平的调控,进而参与细胞活动及信号转导等过程[18]。每个miRNA 可以有多个靶基因,而几个miRNAs 也可以调节同一个基因。这种复杂的调节网络既可以通过1 个miRNA 调控多个基因的表达,也可以通过几个miRNAs 的组合精细调控某个基因的表达[19]。虽然对miRNA 的研究还处于探索阶段,但miRNA 表达或功能异常可介导T-ALL 发生发展的观点已得到普遍认同[20-21]。miR-935 是近年来新发现的一种高度保守的mi-RNA[22-23]。YAN 等[24]通过双荧光实验证实,Notch1是miR-935 的靶基因;而何彩等[23]通过体外细胞实验也发现,miR-935 通过Notch1 可以调控胃癌细胞的生命活动。因此通过miR-935 靶向治疗T-ALL 具有一定的理论基础。
由本次实验结果可知,Notch1 为miR-935 的靶基因,miR-935 可靶向调控Notch1 表达,与上述学者的研究结果一致。本次研究显示,miR-935 高表达可以抑制T-ALL 细胞的增殖;观察细胞周期结果可知,miR-935高表达会使肿瘤细胞阻滞在G0/G1,令细胞分裂受阻;后续的凋亡实验发现,miR-935 过表达组的细胞凋亡率显著高于对照组,提示miR-935 高表达可以促进T-ALL细胞的凋亡。由上述结果分析新发现,过表达miR-935 是通过阻滞细胞周期来完成,这可能是miR-935过表达抑制了Notch1的表达,相邻细胞可以通过Notch 受体与配体的结合传递信号,并最终实现了促凋亡效果。由RT-PCR和Western blot 实验可知,和对照组相比,miR-935 过表达组表达量显著增加,miR-935 沉默组表达量显著下降,Notch1 过表达组和沉默组miR-935 相对表达量无显著性差异,而miR-935 过表达组Notch1 蛋白表达量明显提升,沉默组Notch1 蛋白表达量明显下降,进一步证明了miR-935对Notch1的调控作用。
综上所述,miR-935 通过调控靶基因Notch1 介导儿童T-ALL 细胞的生命活动,miR-935 过表达可以促进Notch1 的表达,从而使激活相关的信号同时,抑制细胞增殖,阻滞细胞分裂并诱导细胞凋亡,具有较好的抗肿瘤作用,miR-935 可作为治疗儿童T-ALL 新的靶点。本次实验仅对miR-935 与Notch1关系通过细胞实验进行了研究,而后续作用的相关信号通路及作用未进行进一步的探讨,很多机制尚不明确,将在之后的实验中进一步研究阐述。