PCL2促进胶质瘤血管生成的机制研究①
常 越 田金成 赵 茜 周亚南 英叶霞 吕 叶 曹相玫
(宁夏医科大学基础医学院病理学系,银川 750004)
聚梳组蛋白(polycomb group,PcG)是重要的表观遗传转录阻遏物,既往研究表明,PcG 蛋白组装成2 个抑制性蛋白复合物,即多疏阻遏复合物1(PRC1)和多疏阻遏复合物2(PRC2),两者协同调控组蛋白修饰及染色质状态沉默基因表达[1]。多梳样蛋白2(polycomb-like protein 2,PCL2)是构成PRC2复合物的重要辅助因子,能够调节PRC2 酶活性及PRC2基因合成等,影响多能基因表达程序稳定性,在细胞命运控制中起重要作用[2-3]。近年研究报道,过表达PCL2 能够增加白血病细胞的化疗敏感性,有效降低异种移植小鼠模型急性髓细胞样白血病(acute myeloid leukemia,AML)复发率[4]。课题组前期研究发现PCL2 表达增加与胶质瘤增殖关系密切[5]。因此,本研究将继续研究PCL2 与胶质瘤血管形成的关系,旨在明确其对胶质瘤血管异常增生的影响及可能机制。
1 材料与方法
1.1 材料 人恶性胶质母细胞瘤来源细胞系U87-MG由本实验室保存;PCL2、核因子E2 相关因子2(nu‐clear factor erythroid 2-related factor 2,Nrf2)、血红素氧合酶1(heme oxygenase-1,HO-1)购自英国Abcam公司;zeste基因增强子同源物2(enhancer ofzesteho‐molog 2,EZH2)、β-actin、GAPDH、山羊抗兔IgG、山羊抗小鼠IgG 购自美国Cell Signaling Technology 公司;EDTA 抗原修复液、山羊血清、DAB 试剂、苏木素购自北京中杉金桥生物技术有限公司;DMEM 高糖培养基购自美国Hyclone 公司;胎牛血清、胰蛋白酶、0.25%EDTA、牛血清白蛋白、BSA 购自美国Invitrogen 公司;0.45µm PVDF 膜、ECL 发光液购自美国Millipore公司。
1.2 方法
1.2.1 TCGA 数据库分析 本研究中所有肿瘤PCL2 表达数据源自在线分析软件GEPIA2(http://gepia2.cancer-pku.cn/#index)。GEPIA(基因表达谱交互式分析)是基于TCGA 和GTEx 数据库肿瘤和正常样本进行基因表达分析的资源,采用生物信息学工具CIBERSORT、EPIC 和quantTIseq 对TCGA/GTEx数据库中各样本进行分析,由北京大学的TANG等[6]共同开发。
1.2.2 免疫组织化学染色 胶质瘤石蜡组织标本源自2013 年至2015 年宁夏医科大学总医院病理科手术切除的胶质瘤患者,共73例,男38例,女35例,所有标本均经过病理证实,病例资料完整。由两位资深病理医师复验后确诊,WHOⅠ级3 例,Ⅱ级25 例,Ⅱ~Ⅲ级1 例,Ⅲ级18 例,Ⅲ~Ⅳ级24 例,Ⅳ级2例。将肿瘤与正常脑组织标本经10%中性甲醛固定,石蜡包埋,连续切片3张(4µm),进行抗原修复,65 ℃烘片,3%H2O2阻断8 min,柠檬酸高压抗原修复10 min,10%山羊血清封闭20 min,添加一抗工作液(PCL2 1∶100 稀释)37 ℃孵育1 h,添加二抗工作液(山羊抗小鼠IgG)37 ℃孵育60 min,显微镜观察DAB 染色时间,苏木素复染1 min 使核着色,清水洗掉多余染色剂,乙醇脱水,中性树脂封片,Image-Pro Plus 6.0 软件分析数据。染色结果由染色强度百分比(棕黄色颗粒表示阳性结果)和染色细胞百分比(细胞质或细胞核中棕黄色颗粒表示阳性结果)确定。
1.2.3 U87 细胞处理 将U87 细胞接种于含10%FBS 的DMEM 培养液,2×105个/100 cm2培养,5%CO2、37 ℃孵育8 h,贴壁后进行慢病毒感染,感染滴度设置为MOI=20∶1、50∶1、100∶1,无血清MEM 培养基培养细胞72 h,荧光显微镜观察细胞感染效率。
1.2.4 Western blot 收集1.2.3 中各组细胞并提取全蛋白,BCA 蛋白含量检测试剂盒定量,加入上样缓冲液(40 µg/孔)95 ℃热变性5 min,10%SDSPAGE 电泳,转膜,10%脱脂奶粉封闭1 h,加入3%BSA 稀释的一抗(PCL2 1∶200、Nrf2 1∶500、HO-1 1∶500、EZH2 1∶1 000、β-actin 1∶1 000)4 ℃孵育过夜,加入HRP 标记的山羊抗兔IgG(1∶2 000)、HRP标记的山羊抗鼠IgG(1∶2 000)室温孵育60 min,以β-actin 为内参。ECL 化学发光试剂(A∶B=1∶1)显色1 min,曝光,Image J软件分析条带灰度值,目标蛋白表达=目标蛋白灰度值/β-actin条带灰度值。
1.3 统计学分析 采用SPSS21.0软件进行数据分析,计量资料以±s表示,多样本比较采用单因素方差分析,P<0.05 为差异有统计学意义,各实验独立重复3次。
2 结果
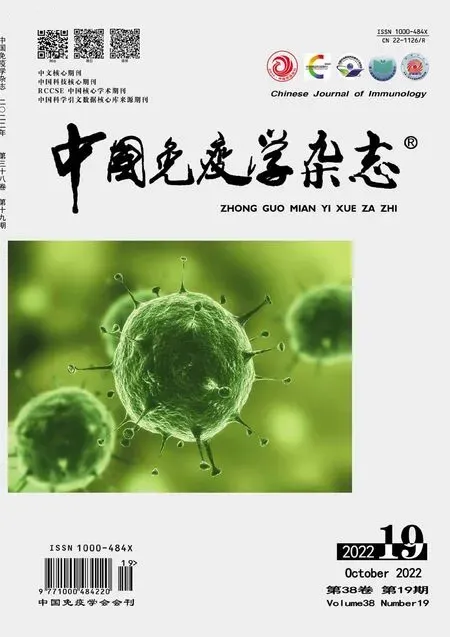
2.1 PCL2 在多种肿瘤组织中呈异常表达 TCGA数据库分析肿瘤中PCL2基因表达,PCL2在AML、卵巢浆液性囊腺癌(ovarian serous cystadenocarcinoma,OV)、肾上腺皮质癌(adrenocortical carcinoma,ACC)、肾嫌色细胞癌(kidney chromophobe,KICH)等肿瘤组织中表达低于正常组织。相反,PCL2在低级别胶质瘤(low-grade glioma,LGG)、胶质母细胞瘤(glio‐blastoma,GBM)、弥漫性大B 细胞淋巴瘤(lymphoid neoplasm diffuse large B-cell lymphoma,DLBC)、食道癌(esophageal carcinoma,ESCA)等肿瘤组织中表达高于癌旁组织(图1)。
图1 PCL2在多种肿瘤中的表达Fig.1 Expression of PCL2 in many kinds of tumors
2.2 PCL2 在胶质瘤组织中呈高表达,与肿瘤厚壁血管形成相关 免疫组化观察73 例胶质瘤组织中PCL2 表达和分布情况,PCL2 蛋白表达阳性信号呈棕黄色,主要位于肿瘤细胞核内,部分样本中PCL2也在细胞质中表达(图2)。PCL2 蛋白在有厚壁血管增生的胶质瘤组织中表达较高,提示PCL2 表达增加与胶质瘤形成肾小球样厚壁血管相关(χ2=13.909,P<0.01,表1)。

图2 胶质瘤细胞中PCL2 表达及表达部位(根据WHO 2016分级标准)Fig.2 Expression of PCL2 in glioma cells and its expres⁃sion sites(according to WHO 2016 grading stan⁃dard)
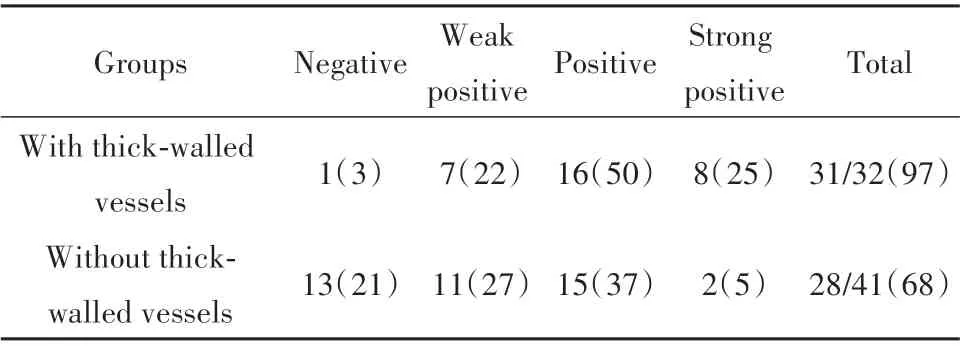
表1 PCL2表达与厚壁血管形成相关[例(%)]Tab.1 PCL2 expression is associated with thick-walled vessel formation[n(%)]
2.3 过表达PCL2 蛋白水平测定 Western blot 检测hPCL2蛋白表达,腺病毒载体梯度MOI=20∶1、50∶1、100∶1 时感染U87-MG 细胞,结果显示,空白对照组PCL2 蛋白表达较低,hPCL2 组蛋白表达明显升高,hPCL2与空白对照组间及hPCL2组内差异均有统计学意义(图3)。
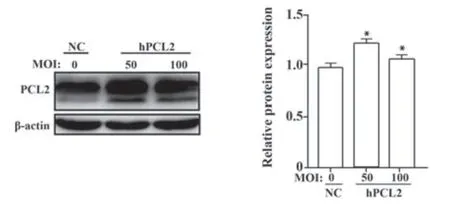
图3 重组腺病毒内PCL2表达测定Fig.3 Determination of PCL2 protein level in recombi⁃nant adenovirus
2.4 hPCL2 上调EZH2 表达,并促进促血管生成因子合成 检测血管形成的正调控基因Nrf2 和HO-1蛋白含量(PCL2 MOI=20∶1、50∶1、100∶1),hPCL2 组Nrf2 和HO-1 明显高于对照组及空载体组,且在MOI=50 时表达最为显著(图4)。提示高表达PCL2可增加HO-1 和Nrf2 表达,同时促进EZH2 表达(PRC2复合物核心组分)。
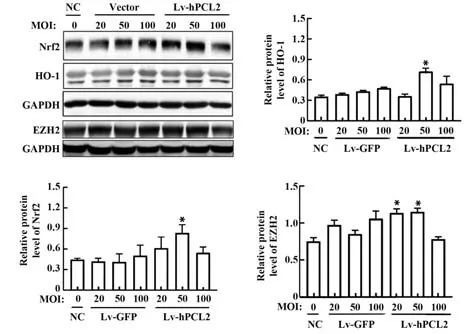
图4 过表达PCL2促进血管生成因子合成Fig.4 Overexpression of PCL2 promotes angiogenic factor synthesis
3 讨论
胶质瘤占成人原发性脑肿瘤的70%,具有浸润性、易复发等特点,且预后不良[7]。在新生微血管延伸的引导下,胶质瘤细胞迁移至大脑不同区域,并进一步发展。新血管形成一般包括血管发生和血管生成两个过程[8]。血管发生指来自中胚层的纤维母细胞分化为内皮细胞,并在无血管组织中增生形成原始血管网[9]。血管生成包括血管内皮细胞活化、增生与迁移、细胞外基质和基底膜降解、管腔样结构形成与融合及细胞外基质重建等多个步骤[10]。
病理状态下产生的大量调控因子能够激发异常血管生成,这些调控因子包括血管生成因子、细胞因子、蛋白酶、粘连分子、血管生成相关基因、DNA 和组蛋白修饰及ncRNA 表达等[11]。病理性血管生成主要原因为促血管生成因子(如血管内皮生长因子、转化生长因子β 等)和抑血管生成因子(如血管抑素、内皮抑素)相互调节,当其平衡被破坏,即生成病理性血管,相应因子合成增加并与靶细胞(血管内皮细胞)相应受体结合,经过多个步骤,最终在肿瘤内形成新生血管[12]。表观遗传学参与血管形成基因表达调控和生长因子介导的血管生成过程[13]。
Nrf2 是碱性亮氨酸拉链转录因子家族成员,通过诱导抗氧化防御的多种基因表达在维持氧化还原稳态中发挥关键作用[14-15]。病理性血管形成与Nrf2 活化有关。KIM 等[16]研究发现,敲低Nrf2 可阻断结肠癌中氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)依赖性血管内皮生长因子(vascular endothelial growth factor,VEGF)表达并抑制肿瘤生长,同时能减少小鼠异种移植模型中依赖VEGF 血管生成。膀胱癌患者清中Nrf2、HO-1 含量较高者VEGF 也呈高表达[17]。表明高表达的Nrf2 使VEGF表达升高,并最终促进肿瘤血管生成。
HO 是血红素分解过程中的起始酶和限速酶,HO-1被认为是Nrf2依赖性细胞应答的主要效应物,其代谢产物具有促进血管生长因子合成、内皮细胞增殖及迁移、减少血管抑制因子合成和抑制内皮细胞凋亡的作用[18-20]。CO 是HO-1 的代谢产物,通过刺激血管形成并诱导血管生成相关因子VEGF 与基质细胞衍生因子1(stromal derived factor-1,SDF-1)表达促进血管生成[21]。
表观遗传的各种机制共同参与胶质瘤发生发展,且与胶质瘤增殖、转移、侵袭等过程密切相关[22]。表观遗传学机制包括DNA 甲基化异常、组蛋白修饰(乙酰化、甲基化、磷酸化、泛素化等翻译后修饰)、非编码RNA、染色质修饰等均与肿瘤发生有关[23]。PCLs 是重要的表观遗传因子,过表达PCL2能够促进肿瘤细胞增殖并延缓细胞衰老[24]。
EZH2 是PRC2 的催化亚基,是一种特异性组蛋白甲基转移酶,通过三甲基化修饰靶基因,抑制或沉默靶基因[25]。而EZH2 参与肿瘤血管形成,主要通过VEGF-E2、F-EZH2-VASH1 和FGF-2-NDY1/EZH2-miR-101 EZH2发挥作用[26-27]。HIF-1α与EZH2表达呈正相关,这两种蛋白借助miRNA 在肿瘤发生发展中取得联系[28]。肿瘤内部的缺氧微环境使其HIF 表达异常增加,并最终导致EZH2 高表达,增强肿瘤血管形成能力。研究表明,EZH2 是卵巢癌和其他癌症中肿瘤血管生成的关键调节因子,VEGF通过上调EZH2表达抑制血管抑制蛋白1(vasohibin 1,VASH1)表达,从而促进人脐静脉内皮细胞增殖及血管生成[29]。
课题组前期研究发现,过表达的PCL2 能够上调EZH2表达,同时促进H3K27三甲基化及H3K4二甲基化,下调H3K9 二甲基化促进胶质瘤细胞增殖。本研究通过TCGA 数据库分析显示,PCL2 在多种肿瘤中呈异常表达,包括DLBC、ESCA、HNSC、胶质瘤和LGG 等肿瘤组织;免疫组化分析显示,PCL2 在胶质瘤组织中呈较高表达,且在有厚壁血管形成的胶质瘤中表达较高。
多项研究表明,在多种恶性肿瘤中,VEGF 和HIF-1α 可促进EZH2 表达。本研究表明,过表达PCL2基因能够促进EZH2 表达,使Nrf2 和HO-1 表达升高,推断其可能通过上调促血管生成因子(VEGF、HIF-1α 等)间接或直接进行血管形成正向调控。由此认为PCL2 在胶质瘤血管形成过程中发挥重要作用。