补中益气汤对TGF-β1诱导的肺腺癌荷瘤裸鼠移植瘤PI3K/AKT信号通路的影响①
王 莹 张 颖 高 原 王 淳 刘春英 (辽宁中医药大学中西医结合学院,沈阳 110847)
近年研究发现,脂酰肌醇3 激酶(phosphati‐dylinositol 3 kinase,PI3K)与其下游分子蛋白激酶B(protein kinase B,PKB/AKT)组成的信号通路与多种肿瘤的发生密切相关[1-2]。PI3K/AKT 信号转导通路是细胞生存和增殖的主要通路,活化的PI3K/AKT信号通路通过激发下游多种蛋白磷酸化而促进肿瘤进展,贯穿肿瘤发展过程的始终[3]。目前以PI3K/AKT 信号通路为靶点的肿瘤治疗得到了密切关注,并在深入挖掘中。
有报道称,PI3K/AKT信号通路过度活化或激活可导致肿瘤细胞耐药;PI3K/AKT通路具有调节肿瘤细胞上皮-间充质转化(epithelial-mesenchymal tran‐sition,EMT)进程的作用,其活性增强可促进肿瘤增殖和转移[4]。由此可推测PI3K/AKT 信号通路可能是肿瘤细胞EMT与耐药的共同信号通路。
前期实验已经证实,A549/DDP 细胞荷瘤裸鼠EMT 与耐药存在明显相关性,补中益气汤具有干预肺腺癌荷瘤裸鼠EMT,改善顺铂耐药作用。本实验采用TGF-β1 过表达的A549/DDP 细胞制备荷瘤裸鼠,补中益气汤联合PI3K 通路抑制剂(LY294002)共同干预后,检测PI3K、AKT 和EMT 分子标志物E-钙黏蛋白(E-cadherin,E-cad)、N-钙黏蛋白(N-cad‐herin,N-cad)在蛋白和基因水平上的表达,探求补中益气汤干预EMT 改善肺腺癌顺铂耐药是否与PI3K/AKT 信号通路有关,为补中益气汤临床治疗肺腺癌提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物与细胞株 SPF 级雄性BALB/c 裸鼠36 只,6 周龄,体质量(20±2)g,由北京华阜康生物科技有限公司提供,合格证号:SCXK(京)2014-0004,饲养于辽宁中医药大学实验动物中心,动物许可证号:SYXK(辽)2013-0009。肺腺癌耐顺铂细胞株A549/DDP购于江苏齐氏生物科技有限公司。
1.1.2 药物 补中益气汤由黄芪18 g、白术9 g、人参6 g、升麻6 g、橘皮6 g、柴胡6 g、当归3 g、甘草9 g组成,以上饮片均购于辽宁中医药大学附属医院。依据“人和动物间按体表面积折算的等效剂量比值表”计算裸鼠等效剂量,按前期实验筛选的最佳用药剂量,即成人日推荐量的2 倍剂量(5.84 g/kg 生药)[5],常规煎煮,水浴蒸发至1 g/ml 生药,4 ℃保存,备用。顺铂购自美国Sigma公司。
1.1.3 主要试剂 LY294002购于阿拉丁公司;Anti-E-cad、Anti-N-cad 购于美国Santa 公司;Anti-p-PI3K、Anti-p-AKT(Ser473)购于北京博奥森生物技术有限公司;Anti-PI3K、Anti-AKT 购于武汉三鹰技术有限公司;生物素标记的山羊抗兔IgG、生物素标记的山羊抗小鼠IgG、辣根酶标记的链霉亲和素购于上海碧云天生物技术有限公司;DAB 显色试剂盒购于北京索莱宝科技有限公司;全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、SDS-PAGE 凝胶快速制备试剂盒、SDS-PAGE 蛋白上样缓冲液、ECL 检测试剂盒、HRP标记的山羊抗兔IgG(H+L)、内参抗体β-actin购于沈阳万类生物科技有限公司;PVDF 膜购于美国Millipore 公司;TRIpure、Super M-MLV 反转录酶、RNase inhibitor、2×Power Taq PCR MasterMix 购于北京百泰克生物技术有限公司;引物由生工生物工程(上海)有限公司合成。
1.2 方法
1.2.1 移植瘤模型的制备、分组及给药 36 只BALB/c 裸鼠适应性喂养1 周,按随机数字表法分为空载组(NG 组)、模型组(MG 组)、顺铂组(DDP 组)、补中益气汤+顺铂组(BCD 组)、顺铂+阻滞剂LY294002 组(DLY 组)、补中益气汤+顺铂+阻滞剂LY294002 组(BCDLY 组),共计6 组。TGF-β1 空载A549/DDP细胞、TGF-β1过表达A549/DDP细胞分别制备细胞悬液,各取100µl(约含1×107个细胞)分别接种于裸鼠左侧腋窝皮下。NG组接种TGF-β1空载A549/DDP 细胞,其余组接种TGF-β1 过表达A549/DDP 细胞。自接种当日起每天观察裸鼠状态及肿瘤生长情况。6 组裸鼠一般状况良好,均在接种后8 d 观察到注射部位皮下有直径2~3 mm 的肿瘤结节,说明接种成功,各组致瘤率均达100%。细胞接种8 d 后开始给药。NG 组和MG 组腹腔注射生理盐水0.003 5 g/kg,2次/周,灌胃生理盐水,1 ml/次,2次/d;DDP 组腹腔注射顺铂0.003 5 g/kg,2 次/周,灌胃生理盐水,1 ml/次,2 次/d;BCD 组腹腔注射顺铂0.003 5 g/kg,2次/周,灌胃补中益气汤,1 ml/次,2次/d;DLY 组腹腔注射顺铂0.003 5 g/kg,2 次/周,腹腔注射LY294002 0.025 g/kg,2 次/周,灌胃生理盐水,1 ml/次,2次/d;BCDLY组腹腔注射顺铂0.003 5 g/kg,2 次/周,腹腔注射LY294002 0.025 g/kg,2 次/周,灌胃补中益气汤,1 ml/次,2 次/d。细胞接种32 d 后处死裸鼠,取肿瘤组织固定、冻存。
1.2.2 免疫组化法检测移植瘤E-cad、N-cad、PI3K、AKT、p-PI3K、p-AKT 表达 切片脱蜡至水,微波加热修复抗原。滴加3%H2O2室温孵育15 min。滴加山羊血清室温孵育15 min。4 ℃孵育一抗工作液(E-cad、N-cad 1∶50;PI3K、AKT 1∶100;p-PI3K、p-AKT 1∶400)过夜。37 ℃孵育二抗工作液30 min(1∶200)。滴加HRP 标记的亲和素(1∶200),37 ℃孵育30 min。滴加100µl显色试剂,待颜色刚刚变深,迅速置于水中终止反应。苏木素复染,脱水、透明、封片。PI3K蛋白主要定位于细胞质,少数位于细胞膜,以细胞质和细胞膜出现深染的棕黄色颗粒为阳性结果;AKT 蛋白主要定位于细胞核和细胞质,以细胞核和细胞质上出现深染的棕黄色颗粒为阳性结果;E-cad蛋白主要定位于细胞膜和细胞质,以细胞膜和细胞质出现深染的棕黄色颗粒为阳性结果;N-cad 蛋白主要定位于细胞质,少数位于细胞膜,以细胞质和细胞膜上出现深染的棕黄色颗粒为阳性结果。
1.2.3 Western blot检测移植瘤PI3K、p-PI3K、AKT、p-AKT 蛋白表达 将肿瘤组织捣碎,使用RIPA∶PMSF(100∶1)裂解液裂解,离心提取总蛋白。采用BSA 蛋白定量试剂盒测定总蛋白浓度。上样,SDSPAGE 电泳,转膜、封闭。4 ℃过夜孵育一抗(AKT 1∶500;PI3K、p-PI3K、p-AKT 1∶1 000)。37 ℃孵育二抗(1∶5 000),45 min 后发光、拍照,Quantity One 凝胶图像分析。
1.2.4 RT-qPCR 检测移植瘤E-cad、N-cad、PI3K、AKT mRNA 表达 采用TRIpure 裂解液提取细胞总RNA,检验样本RNA 纯度,计算RNA 浓度(g/L)。RNA 浓度=A260×40×稀释倍数/1 000。按逆转录试剂盒说明逆转录合成cDNA。分析方法采用2−ΔΔCt法。RT-qPCR引物序列及扩增产物长度见表1。
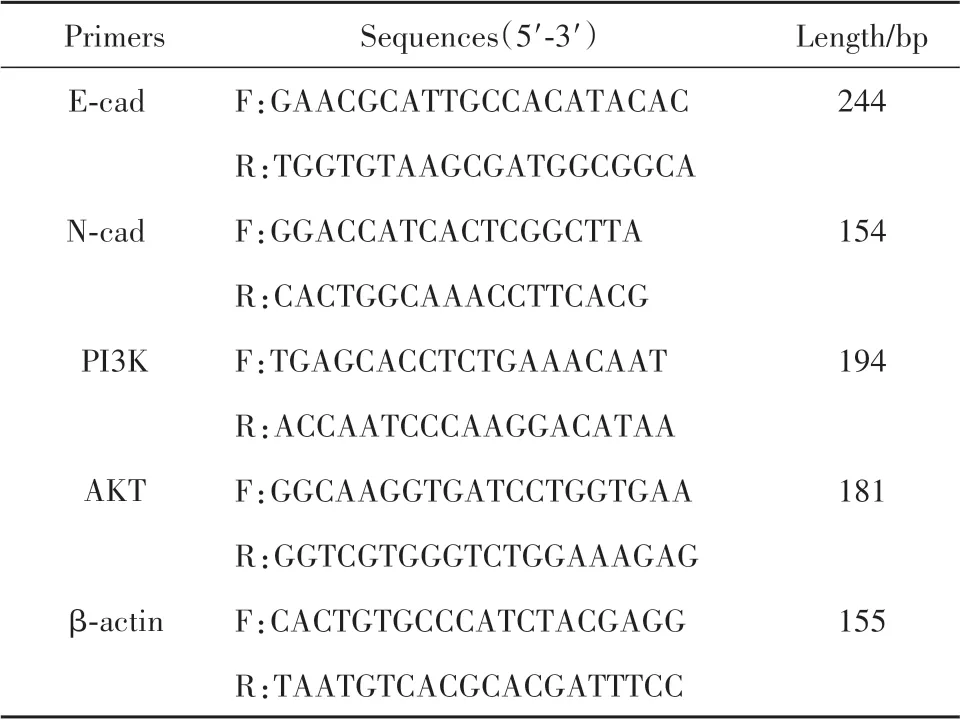
表1 PCR引物序列及扩增产物Tab.1 PCR primer sequences and amplification products
1.3 统计学处理 实验数据采用SPSS17.0统计软件进行处理,计量资料用±s表示,组间比较采用单因素方差分析(One-Way ANOVA),两两比较用LSD法,P<0.05为差异具有统计学意义。
2 结果
2.1 各组移植瘤p-PI3K、PI3K、p-AKT、AKT 蛋白的表达 各组间PI3K、AKT蛋白表达差异较小。p-PI3K、p-AKT蛋白表达组间差异性较大,与NG组相比,MG组p-PI3K、p-AKT 蛋白阳性表达明显增多;与MG、DDP组相比,BCD、DLY、BCDLY 组p-PI3K、p-AKT蛋白阳性表达逐渐减少,BCDLY 组p-PI3K、p-AKT 蛋白阳性减少最为显著。免疫组化结果见图1。
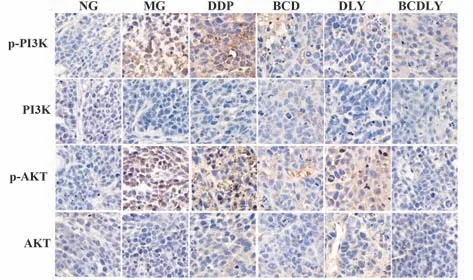
图1 各组移植瘤p-PI3K、PI3K、p-AKT、AKT 蛋白表达(IHC,×400)Fig.1 Expressions of xenograft p-PI3K,PI3K,p-AKT and AKT protein in each group(IHC,×400)
各组PI3K、AKT 蛋白表达略有差异,但均无统计学意义(P>0.05)。p-PI3K、p-AKT 蛋白表达组间差异较大,与NG 组相比,MG 组p-PI3K、p-AKT 蛋白表达明显增多(P<0.05);与MG、DDP 组相比,BCD、DLY、BCDLY 组p-PI3K、p-AKT 蛋白表达减少,差异有统计学意义(P<0.05);与DLY 组相比,BCDLY 组p-PI3K、p-AKT 蛋白表达减少,差异有统计学意义(P<0.05)。Western blot条带及统计结果见图2。
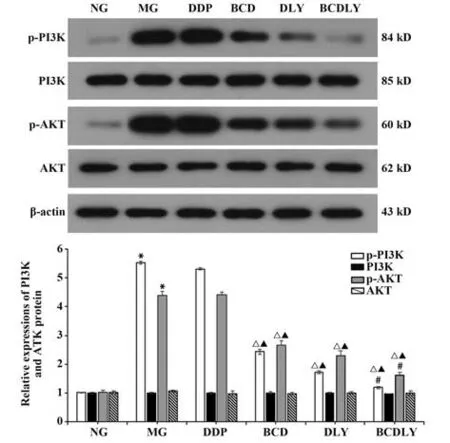
图2 各组移植瘤p-PI3K、PI3K、p-AKT、AKT 蛋白表达(±s,n=6)Fig.2 Expressions of xenograft p-PI3K,PI3K,p-AKT and AKT protein in each group(±s,n=6)
2.2 各组移植瘤PI3K、AKT mRNA 表达 与NG 组相比,MG 组PI3K mRNA 表达显著上调(P<0.05);与MG、DDP 组相比,BCD、DLY、BCDLY 组PI3K mRNA 表达均有不同程度的下调(P<0.05);与DLY组相比,BCDLY 组PI3K mRNA 表达下调(P<0.05)。各组间AKT mRNA 表达差异无统计学意义(P>0.05)。见图3。
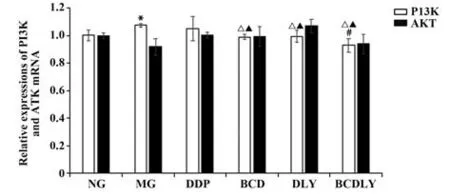
图3 各组移植瘤PI3K、AKT mRNA表达(±s,n=6)Fig.3 mRNA expressions of xenograft PI3K and AKT in each group(±s,n=6)
2.3 各组移植瘤E-cad、N-cad 蛋白表达 E-cad、N-cad 蛋白的阳性着色各组均有表达。与NG 组相比,MG 组上皮分子E-cad 蛋白表达明显减少,间质蛋白N-cad 蛋白表达明显增多;与MG、DDP 组相比,BCD、DLY、BCDLY 组上皮分子E-cad 蛋白表达逐渐增多,间质蛋白N-cad蛋白表达逐渐减少;与DLY 组相比,BCDLY 组上皮分子E-cad蛋白表达增多,间质蛋白N-cad蛋白表达减少。见图4。

图4 各组移植瘤E-cad、N-cad蛋白表达(IHC,×400)Fig.4 Expressions of xenograft E-cad and N-cad protein in each group(IHC,×400)
2.4 各组移植瘤E-cad、N-cad mRNA 表达 与NG组相比,MG 组上皮分子E-cad mRNA 表达显著下调,N-cad mRNA 表达显著上调(P<0.05);与MG、DDP 组相比,BCD、DLY、BCDLY 组上皮分子E-cad mRNA 表达均有不同程度的上调,N-cad mRNA 表达均有不同程度下调(P<0.05);与DLY组相比,BCDLY组上皮分子E-cad mRNA 表达增多,间质蛋白N-cad mRNA表达减少。见图5。
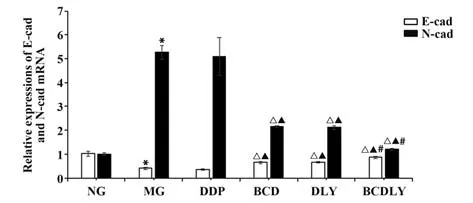
图5 各组移植瘤E-cad、N-cad mRNA表达(±s,n=6)Fig.5 Expressions of xenograft E-cad and N-cad mRNA in each group(±s,n=6)
3 讨论
PI3K/AKT是肿瘤中最重要的信号通路,直接关系到细胞的活化、增殖、癌变、凋亡等过程[6]。在已知的多种癌症中,过度活化的PI3K/AKT 通路因减少了细胞程序性死亡而促进细胞增殖。有研究发现,PI3K/AKT 信号通路与肿瘤细胞EMT 呈正相关,PI3K/AKT 信号通路的状态改变,肿瘤细胞的EMT会随之发生相应变化,其主要机制与PI3K/AKT 信号通路活化引起细胞间黏附能力下降有关[7]。
PI3K 可分为Ⅰ、Ⅱ、Ⅲ类,目前的研究热点主要是Ⅰ类,由调节亚基p85 和催化亚基p110 构成,与v-Sre、v-Ras 等癌基因的产物相关[8]。P13K 既有苏氨酸(Thr)/丝氨酸(Ser)激酶活性,也有磷脂酰肌醇激酶活性。PI3K激活后,其p110亚基催化在质膜上激活第二信使PIP3,触发PIP3 与信号蛋白AKT、PDK1 结合,引起AKT 蛋白磷酸化。AKT 是PI3K 最重要的下游效应蛋白,活化的AKT 通过介导下游多个靶蛋白的磷酸化调控细胞的生长、增殖,发挥抗凋亡作用[9]。AKT 活化涉及两个残基的磷酸化:激活回路上的苏氨酸308(Thr308)和C 端疏水基序中的丝氨酸473(Ser473)。在肿瘤细胞系中,使用PI3K 特异性抑制剂LY294002 可抑制AKT 功能,以p-AKT(Ser473)表达含量降低为主要指标[10]。隋华等[11]证实阻断PI3K/AKT 信号通路可改善人结肠癌耐奥沙利铂细胞株HCT-116/L-OHP 的药敏性,逆转P-gp介导的肠癌多药耐药。
本课题组前期研究证实,补中益气汤有调节PI3K/AKT 信号通路表达,改善肿瘤顺铂耐药的作用[12]。同时还发现,补中益气汤含药血清可通过干预A549/DDP 细胞EMT 改善其顺铂耐药[13]。鉴于PI3K/AKT 信号通路与肿瘤细胞生长、凋亡、耐药等过程密切相关,本研究以通路阻滞剂LY294002 为对照,通过分子生物学手段验证补中益气汤对肺腺癌荷瘤裸鼠PI3K/AKT 信号通路及EMT 分子标志物E-cad、N-cad表达的影响,以明确补中益气汤对该信号转导通路的作用。
免疫组化、Western blot 同时检测PI3K、AKT 蛋白和p-PI3K、p-AKT蛋白表达。结果显示,与空载组相比,模型组p-PI3K 和p-AKT 蛋白表达水平均升高;与模型组相比,补中益气汤组、顺铂+阻滞剂LY294002 组、补中益气汤+顺铂+阻滞剂LY294002组p-PI3K、p-AKT蛋白水平均有不同程度的降低,证实补中益气汤可通过下调PI3K 磷酸化水平抑制AKT 活化。补中益气汤+顺铂+阻滞剂LY294002 组效果最佳,与顺铂+阻滞剂LY294002 组比较差异有统计学意义,提示补中益气汤与LY294002 有协同效果,可共同作用于PI3K/AKT 通路,抑制其表达。各组PI3K、AKT 总蛋白表达几乎无变化,而p-PI3K、p-AKT 有变化,再次证实补中益气汤影响PI3K/AKT通路的活化过程。RT-qPCR 检测PI3K、AKT mRNA表达,结果显示,与空载组相比,模型组PI3K mRNA表达水平升高;与模型组相比,各治疗组PI3K mRNA 水平均有不同程度的降低,顺铂+阻滞剂LY294002 组、补中益气汤+顺铂+阻滞剂LY294002组差异有统计学意义。LY294002 竞争性地抑制ATP 与PI3K 激酶催化亚单位p110 的结合,是在蛋白水平上对PI3K磷酸化的抑制。由此推测,补中益气汤的作用靶点可能是在PI3K 基因水平上的某一位点,是通过减少PI3K mRNA 表达抑制PI3K 蛋白质的合成。各组间AKT mRNA 变化不显著,组间差异无统计学意义。推测补中益气汤和LY294002 只能抑制AKT 蛋白磷酸化,但并不影响其基因表达。这一结论与既往研究一致[14]。
EMT 是指上皮细胞在特定的生理、病理情况下向间充质细胞转化的现象[15]。研究表明,肿瘤细胞EMT 与肿瘤耐药密切相关,肿瘤细胞在发生EMT 的过程中,细胞极性丧失,可获得更高的转移与侵袭能力[16]。E-cad 和N-cad 是EMT 的主要分子标志物[17]。TGF-β 是一种多肽性细胞生长负调控因子,为肿瘤细胞EMT 的主要诱导因子,与多种上皮性肿瘤的生长、转移有关,其中以TGF-β1 最常见,活性也最强[18-19]。
TGF-β1 诱导EMT 的过程与多条信号转导通路相关,如:Notch、Hippo、Smad、PI3K/AKT 等[20-23]。其中,PI3K/AKT 被认为是肿瘤细胞EMT 最重要的信号通路之一[24-25]。PI3K/AKT 通路的激活与TGF-β1诱导的肿瘤细胞EMT 呈正相关[26-27]。研究表明,PI3K/AKT 信号通路被TGF-β1 激活后,促使TGF-β1诱导的肺癌细胞发生EMT,使用PI3K/AKT 信号通路抑制剂阻止其激活,肺癌细胞发生EMT 的过程随之显著降低[28-29]。李优等[30]研究发现,姜黄素能通过抑制PI3K/AKT/mTOR 通路激活进而抑制TGF-β1诱导的肺癌细胞EMT。
本研究发现,与TGF-β1空载组相比,TGF-β1过表达的肺腺癌荷瘤裸鼠移植瘤模型组PI3K、AKT 总蛋白表达变化较小,而活化的p-PI3K、p-AKT蛋白表达明显增多,提示PI3K/AKT 通路被TGF-β1 激活。进一步研究发现,与模型组相比,应用补中益气汤的药物组PI3K、AKT总蛋白表达变化较小,而p-PI3K、p-AKT蛋白表达明显减少,与PI3K/AKT通路的抑制剂LY294002 的作用相似,提示补中益气汤可抑制TGF-β1 对PI3K/AKT 通路的激活。上述研究中,各组EMT 分子标志物E-cad 和N-cad 蛋白及mRNA 表达与PI3K/AKT 信号通路激活变化呈正相关,进一步表明补中益气汤可通过抑制TGF-β1 激活PI3K/AKT 通路,进而抑制肺癌细胞发生EMT。综上所述,补中益气汤改善肺腺癌顺铂耐药的机制可能与其抑制TGF-β1对肺腺癌细胞PI3K/AKT信号通路的激活,进而抑制EMT有关。
肺癌术后及放化疗患者具有“正虚邪衰”的特点,重在提高机体免疫力。随着现代治疗技术的不断发展和创新,免疫治疗逐渐成为肿瘤治疗新焦点[31]。抗肿瘤免疫治疗与中医“扶正培本”抗癌理念相契合,补中益气汤恰是“扶正培本”的代表方剂,具有扶助正气,促进气血生化,兼以祛邪的作用。现代医学研究证实,补中益气汤中的有效化学成分包括多糖、生物碱、皂苷、挥发油等,无论复方还是方中的单味药提取物均可表现出多个药理作用靶点,调节免疫功能可能是其中之一。临床应用补中益气汤可提高机体免疫功能,减轻化疗的消化道反应,促进术后机体恢复,改善营养状况等[32-33]。肺癌在发生发展过程中与机体的免疫功能有十分密切的相互作用。当外周血中的免疫细胞处于平衡状态时,肺癌患者的预后最佳[34]。陈记财等[35]研究发现,应用补中益气汤可改善非小细胞肺癌患者外周血CD3+、CD4+、CD4+/CD8+、NK 细胞水平,降低白细胞减少的发生率。课题组前期研究发现,补中益气汤可下调A549 荷瘤裸鼠脾脏中Fas 蛋白表达,促进机体免疫系统对肺癌细胞的杀伤[36]。补中益气汤是否能进一步调节肺腺癌A549/DDP 荷瘤裸鼠的免疫功能或改善其肿瘤微环境,其具体作用机制如何,值得进一步探讨,以期为补中益气汤临床抗肿瘤应用提供确切的理论依据。