利用DNA免疫技术制备人CLDN18.2单克隆抗体
戎卓娜 赵传科 孟 麟 王 冰 钟堂武 王立新 寿成超 (北京大学肿瘤医院暨北京市肿瘤防治研究所,生物化学与分子生物学研究室,恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
CLDNs(claudins)蛋白家族在哺乳动物细胞中由27 个成员组成,这些成员均为四次跨膜蛋白,具有两个胞外区,其N 端和C端均位于细胞内,分子量为20~34 kD[1]。CLDNs蛋白是维持上皮细胞紧密连接的重要成分,相同或不同家族成员间的相互作用可赋予细胞不同功能,在多种生理和病理状态中发挥重要作用[2]。
CLDN18 基因位于染色体3q22.3,具有两种不同的剪切形式,分别编码CLDN18.1 和CLDN18.2蛋白[3]。CLDN18.1 和CLDN18.2 的表达谱存在显著差异,CLDN18.1 可广泛表达于肺泡上皮组织,而CLDN18.2 除在分化良好的胃黏膜上皮有一过性表达外,其主要表达于多种肿瘤组织,如胃癌、胰腺癌、肺癌、卵巢癌等,在胃肠腺癌中其表达可达80%,在胰腺癌中表达可达60%。因此,CLDN18.2成为近年来肿瘤治疗的重要研究靶点,多个CLDN18.2抗体药物已进入临床试验[4-5]。
CLDN18 蛋白的N 端和C 端均位于胞内,经4 次跨膜后形成两个胞外区。第一胞外区约由50 个氨基酸组成,人CLDN18.1 和CLDN18.2 之间仅有8 个氨基酸的差异;第二胞外区约由22 个氨基酸组成,CLDN18.1和CLDN18.2间完全同源。因此,针对第一胞外区是获得CLDN18.2特异抗体的关键。由于第一胞外区在CLDN18.1 和CLDN18.2 间高度同源,同时在人鼠间完全同源[6],这对常规采用蛋白或多肽经小鼠免疫后,通过细胞融合获得CLDN18.2特异性单克隆抗体的策略构成巨大的挑战和障碍。本文在构建CLDN18.2 真核表达质粒的基础上,尝试采用in vivo-jet PEI-Gal 转染试剂通过小鼠尾静脉注射进行质粒DNA 免疫,发现在经2 次免疫后,小鼠体内即可检测到高滴度抗体,随后课题组经细胞融合和筛选,获得了多株CLDN18.2高特异性、高亲和力的抗体,为后续的CLDN18.2 抗体药物研发奠定了重要基础。
1 材料与方法
1.1 材料 pcDNA3.1(+)-CLDN18.2 质粒由上海生工生物技术有限公司全基因合成;293T、293TCLDN18.1 和293T-CLDN18.2 细胞均购自康源博创生物技术有限公司,细胞培养条件为DMEM+10%FBS,37 ℃5%CO2;小鼠SP2/0 骨髓瘤细胞系由我室保存,培养条件为1640+15%FBS;6~8周龄雌性BALB/c 小鼠购自北京华阜康生物技术有限公司;in vivo-jetPEI-Gal(Cat#.202-10G)购自Polyplus;CLDN18抗体(Cat#.700178)购自Thermo 公司;次黄嘌呤、氨基蝶呤、胸苷(hypoxathine,aminopterin,thymidine,HAT)购自Sigma公司;FITC-羊抗小鼠购自北京中杉金桥生物技术有限公司;EndoFree Plasmid Maxi Kit购自Qiagen公司。
1.2 方法
1.2.1 质粒的提取及鉴定 37 ℃过夜培养pc-DNA3.1(+)-CLDN18.2质粒菌液200 ml。离心收取菌液后,采用EndoFree Plasmid Maxi Kit 提取质粒DNA。经HindⅢ和NotⅠ双酶切后,采用1%琼脂糖凝胶电泳鉴定。载体大小5.4 kb,目的片段约800 bp。
1.2.2 小鼠DNA 免疫 选取6~8周龄雌性BALB/c小鼠进行免疫。将40 µg pcDNA3.1(+)-CLDN18.2质粒与6.4µlin vivo-jetPEI-Gal按说明书混匀,静置15 min 后,尾静脉注射至小鼠体内。21 d 后使用相同方案再次免疫小鼠。第2次免疫7 d后取尾血,分别采用293T、293T-CLDN18.1、293T-CLDN18.2 细胞进行ELISA 检测尾血效价。于融合前3 d 选择抗体滴度最高的1只小鼠加强免疫后进行细胞融合。
1.2.3 细胞融合与筛选 取免疫后小鼠脾脏,采用传统的杂交瘤技术与骨髓瘤SP2/0 细胞融合,以HAT 选择性培养基培养。在融合后第8 天左右,吸取克隆孔培养上清同时采用293T、293T-CLDN18.1及293T-CLDN18.2 三种细胞进行常规细胞ELISA检测,筛选只与293T-CLDN18.2 细胞反应、与293T及293T-CLDN18.1 均不反应的克隆孔,通过有限稀释法进行亚克隆及筛选,直至获得能稳定分泌抗CLDN18.2的杂交瘤单克隆细胞株。
1.2.4 单克隆抗体的制备与纯化 BALB/c 小鼠腹腔注射0.5 ml 弗氏不完全佐剂,次日腹腔注射杂交瘤细胞(2×106个/只)。待约7 d 后小鼠腹部显著膨隆时收取腹水,2 000 r/min 离心20 min,取上清。经平衡缓冲液等体积稀释后,0.45 µm 滤器过滤。将过滤后的腹水以1 ml/min 流速通过Purify 蛋白纯化仪,平衡缓冲液洗去杂蛋白,洗脱液(100 mmol/L 甘氨酸-盐酸,pH=2.8)洗脱抗体,收取OD280>0.5的抗体洗脱液,经PBS 4 ℃透析后进行SDS-PAGE电泳鉴定。
1.2.5 细胞ELISA 293T、293T-CLDN18.1和293TCLDN18.2 细胞以2×104个/孔铺96 孔板,18 h 后直接加入0.25%的戊二醛,100 µl/孔,室温固定细胞20 min,PBST 清洗5 遍;然后采用5%的脱脂奶粉室温封闭2 h,PBST 清洗5 遍;将稀释的小鼠血清或单抗以100 µl/孔加入各孔,室温反应2 h,PBST 清洗5 遍;加入HRP 标记的羊抗小鼠二抗,100 µl/孔,室温反应1 h,PBST 清洗5 遍;加入底物显色液OPD(100 µl/孔),室温避光显色15 min;加入12.5%H2SO4终止(50 µl/孔)。酶标仪检测OD490读数。采用Graphpad prism 软件,以抗体浓度为横坐标,OD490读数为纵坐标做散点图并模拟结合曲线,计算EC50值作为抗体的亲和力。
1.2.6 免疫沉淀 采用RIPA 裂解液裂解细胞收取蛋白。各取1 µg CLDN18.2 单抗与20 µl Protein G琼脂糖凝胶珠加入1 ml PBST中,同时以1µg小鼠IgG 作为阴性对照,室温摇床孵育1 h,PBST 洗珠3 次,然后分别加入100 µl 细胞裂解液和900 µl PBST 4 ℃摇床过夜。次日PBST洗珠3次,加入与柱等体积的2×SDS裂解液,煮沸7 min,常规电泳、转膜后,采用商业化CLDN18 抗体进行Western blot检测。
1.2.7 流式细胞检测 常规消化细胞并以预冷的PBS 清洗2 遍后,PBS 重悬至2×106个/ml,取100 µl细胞液,用2 µg/ml 的CLDN18.2 单抗室温染色45 min,PBS清洗3遍,采用Alexa Fluor 488标记的羊抗小鼠二抗室温染色30 min,PBS 清洗3 遍,300 µl PBS重悬细胞上机检测(BD FACS Aria)。
1.2.8 免疫荧光实验 细胞爬片以100µg/ml的多聚赖氨酸37 ℃包被2 h,采用高压ddH2O 清洗3 遍,晾干备用。293T-CLDN18.2、293T-CLDN18.1 和293T 细胞消化重悬,以相同细胞数铺在放置了经上述预处理的载玻片的24孔板中。细胞贴壁24 h后,采用预冷的PBS 清洗2 遍,以2 µg/ml 的CLDN18.2单抗和Hochest 33258(1∶100)37 ℃染色45 min,PBS清洗3遍,以Alexa Fluor 488标记的羊抗小鼠二抗室温染色30 min,PBS清洗3遍,90%甘油封片后,采用Leica SP2共聚焦显微镜进行观察。
2 结果
2.1 质粒构建与鉴定 pcDNA3.1(+)-CLDN18.2构建质粒图谱见图1A。质粒转化DH5α 感受态,次日稀释至200 ml LB 培养基中扩增培养过夜。离心收取细菌沉淀,使用EndoFree Plasmid Maxi Kit 进行大提;提取的质粒经电泳鉴定,其纯度在98%以上,且主要为超螺旋结构,适用于后续试验(图1B)。使用HindⅢ和NotⅠ对大提质粒进行双酶切鉴定,其释放的目的片段约800 bp,符合预期(图1C)。质粒测序结果表明序列正确(图略)。
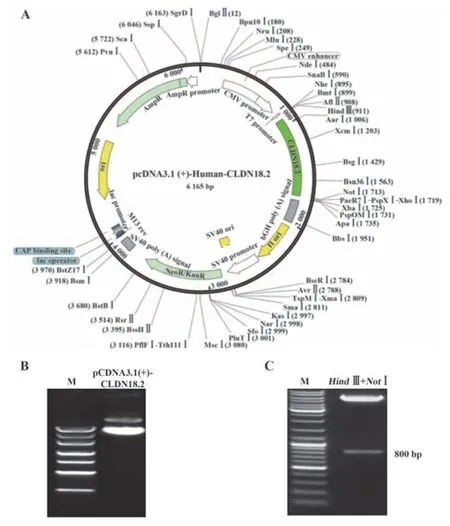
图1 pcDNA3.1(+)-CLDN18.2质粒图谱及酶切鉴定Fig.1 Identification and construction of pcDNA3.1(+)-CLDN18.2
2.2 小鼠抗血清效价检测 用上述质粒进行第2次免疫后第7 天取小鼠尾血进行梯度稀释,然后采用293T-CLDN18.2、293T-CLDN18.1 和293T 细胞铺96 孔板进行效价检测。结果可见,受测小鼠的抗血清与293T-CLDN18.2 细胞有较强反应,而与293TCLDN18.1 和293T 细胞的反应较弱(图2A),即使在1∶2 000 稀释时,其OD490读数仍>0.5,与293TCLDN18.1 和293T 细胞相比差异明显(图2B)。以上结果表明,质粒DNA 免疫可有效诱导小鼠产生抗人CLDN18.2的特异性抗体。
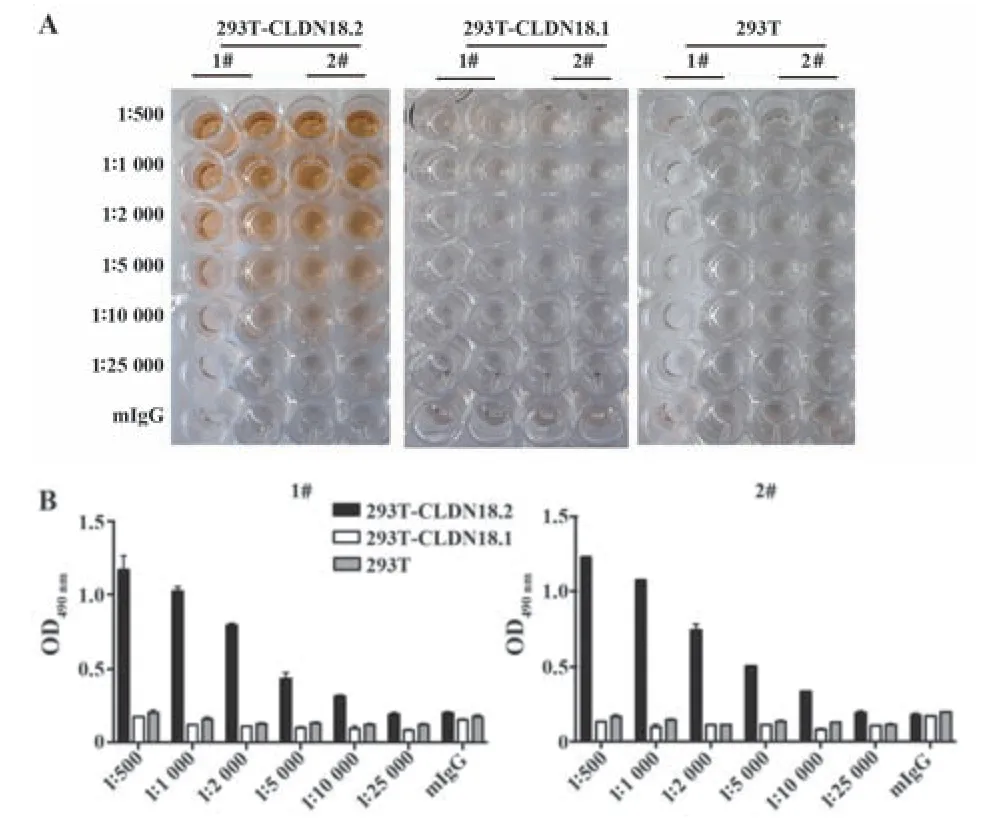
图2 质粒免疫小鼠血清效价检测Fig.2 Quantitation of serum antibody titers after immuni⁃zation in mice
2.3 细胞融合筛选与抗体的制备纯化 对上述pcDNA3.1-CLDN18.2质粒免疫小鼠进行常规融合、293T-CLDN18.2、293T-CLDN18.1 及293T 细胞差异筛选及多轮亚克隆,最终获得15 株抗人CLDN18.2的杂交瘤细胞株,并通过小鼠腹水制备和抗体纯化获得不同量的纯化抗体。抗体经电泳鉴定未见明显杂带(图3),纯度良好符合后续实验要求。
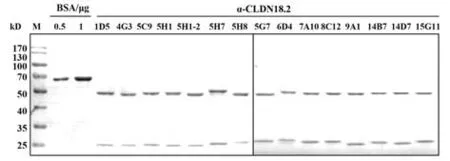
图3 CLDN18.2单克隆抗体的纯化Fig.3 Purification of CLDN18.2 monoclonal antibodies
2.4 细胞ELISA 检测CLDN18.2 单克隆抗体特异性 293T、293T-CLDN18.1 和293T-CLDN18.2 细胞分别铺96 孔板,用上述纯化的CLDN18.2 抗体通过ELISA(2µg/ml)进行特异性检测,结果如图4 所示,制备获得的15 株小鼠杂交瘤单克隆抗体,除4G3、5H8 和6D4 与293T-CLDN18.1 有较弱交叉反应外,其余均表现出CLDN18.2高特异性反应。

图4 细胞ELISA检测CLDN18.2单克隆抗体的特异性Fig.4 Detection of monoclonal antibodies reacted with CLDN18.2 protein by cell ELISA
2.5 细胞ELISA 检测CLDN18.2 单克隆抗体亲和力 293T-CLDN18.2 细胞铺96 孔板,单克隆抗体以100、10、1、0.1、0.01、0.001、0.000 1和0.000 01 nmol/L浓度进行细胞ELISA,检测抗体亲和力。结果显示15 株抗体与293T-CLDN18.2 细胞结合均呈浓度依赖性,并呈现出较高的结合活性(图5)。表1是15株抗体的亲和力EC50值,除4G3和5H7两株单克隆抗体的EC50 为纳摩尔级,其他单克隆株的EC50 均为亚纳摩尔级。该结果表明本次制备的CLDN18.2小鼠单克隆抗体亲和力较高。
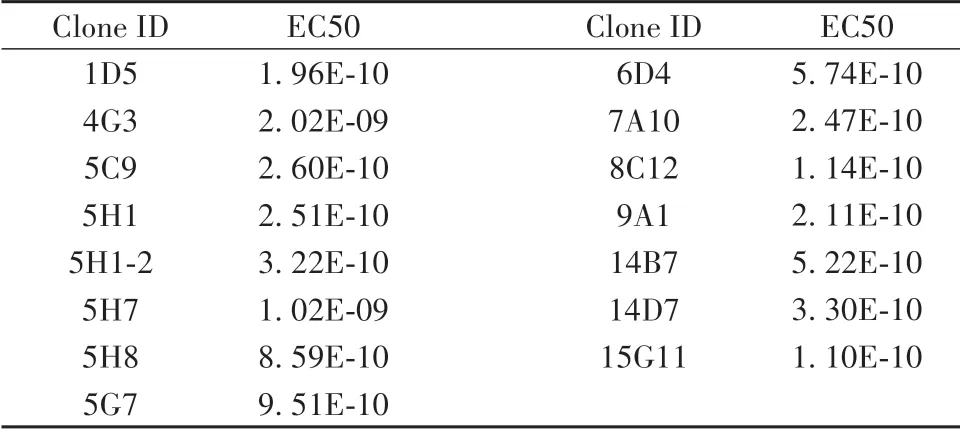
表1 CLDN18.2单克隆抗体的亲和力Tab.1 Affinity of CLDN18.2 monoclonal antibodies
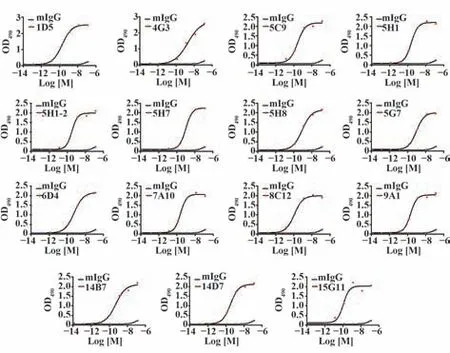
图5 细胞ELISA检测CLDN18.2单克隆抗体的亲和力Fig.5 Affinity of monoclonal antibodies reacted with CLDN18.2 protein by cell ELISA
2.6 CLDN18.2 单克隆抗体在Western blot 和免疫沉淀中的应用检测 为了解本次制备抗体是否可用于CLDN18.2 的Western blot 和免疫沉淀的检测,分别用293T-CLDN18.1 和293T-CLDN18.2 细胞总蛋白进行电泳,转膜后,用上述15株抗人CLDN18.2单克隆抗体作为一抗进行Western blot 检测,但15株抗体均未检出特异性条带,本次制备的15株抗体均不适于Western blot的应用(数据未展示)。
为进一步鉴定抗体的应用,使用制备的CLDN18.2 小鼠单抗和上述细胞的裂解蛋白进行免疫沉淀,采用商品化CLDN18 通抗进行Western blot检测。结果如图6所示,除单抗6D4与CLDN18.1有较弱的交叉反应外,其余单克隆抗体均与CLDN18.2 呈特异性反应,单抗5H1-2、5H7、7A10、8C12和9A1在免疫沉淀中表现出更强的结合活性。

图6 CLDN18.2单克隆抗体免疫沉淀应用Fig.6 Immunoprecipitation application of CLDN18.2 monoclonal antibodies
2.7 CLDN18.2单克隆抗体在流式细胞术中的应用检测 收集293T、293T-CLDN18.1和293T-CLDN18.2细胞,预冷PBS 洗2 遍,进行流式染色,检测结果见图7。除单抗4G3、5H7和6D4 对293T-CLDN18.1细胞有一定阳性染色外(分别为9.3%、24.3% 和7.6%),其他抗体均对293T-CLDN18.2 细胞呈特异性染色,染色阳性率均大于80.0%。其中,5C9 的阳性染色率高达96.2%。以上结果表明,获得的15 株CLDN18.2 单抗均可用于流式细胞染色的检测,且该结果与细胞ELISA结果基本一致。
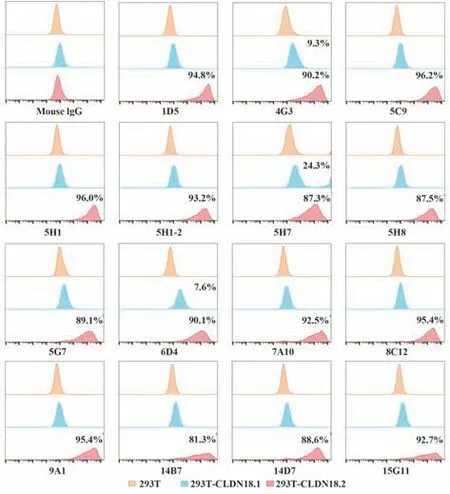
图7 CLDN18.2单克隆抗体在流式细胞术中的应用Fig.7 Flow cytometry application of CLDN18.2 monoclo⁃nal antibodies
2.8 CLDN18.2 单克隆抗体在细胞免疫荧光中的应用检测 根据ELISA 和流式染色结果,选择1D5、5C9、5H1、5H7、8C12 和15G11 6 株特异性强的单克隆抗体进行免疫荧光应用的检测。结果如图8 所示,6 株单克隆抗体与293T 和293T-CLDN18.1 细胞均不反应,与293T-CLDN18.2 特异性结合且蛋白清晰膜定位,说明上述6 株抗体均可用于CLDN18.2的特异性免疫荧光检测。
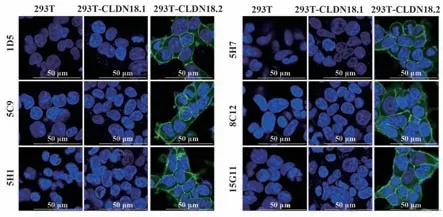
图8 CLDN18.2单克隆抗体的免疫荧光应用Fig.8 Immunofluorescence application of CLDN18.2 monoclonal antibodies
3 讨论
尽管近年来单克隆抗体制备技术获得了较快发展,兔单克隆抗体的制备、噬菌体抗体库筛选等也已成为获得单克隆抗体的重要途径,但传统的小鼠杂交瘤抗体制备技术因其技术成熟、操作相对简单及条件要求较低等优势,依然是目前获得单克隆抗体的常用方法[7-8]。特别是随着基因工程技术的快速发展,鼠源抗体的人源化改造技术也已经非常成熟,研究者通过小鼠免疫获得高特异性、高亲和力的抗体,在此基础上对其进行人源化改造,亦已成为抗体药物研发的常用策略。
欲获得特异性高、亲和力强的单克隆抗体,首先需对小鼠进行抗原免疫。蛋白、多肽及细胞是常用的抗原形式,鉴于免疫用蛋白多为原核表达产物,缺少表达后的蛋白修饰及必要的空间构象;化学合成的多肽虽然成本低廉,但因其只是蛋白质的一级肽链结构,用原核表达蛋白或人工合成多肽进行免疫获得的单克隆抗体虽然可与抗原结合,但有时难以同具有生物学活性的天然蛋白结合[6]。由于CLDN 家族蛋白间的同源性较高,特别是人CLDN18.1和CLDN18.2的两个胞外区,组成第二胞外区的约22个氨基酸是完全相同的,组成第一胞外区的50 个左右氨基酸也仅有8 个氨基酸的差异。为获得针对CLDN18.2 的特异抗体,研究者多采用第一胞外区差异多肽进行免疫。通过该方法获得的抗体虽然可同多肽反应,但多难以同CLDN18.2蛋白结合。用稳定表达CLDN18.2 的细胞进行免疫,然后分别用表达CLDN18.1 和CLDN18.2 的细胞进行差异筛选,虽然也是可以考虑的技术路线,但因细胞含有的抗原极为复杂,又因CLDN18.1 和CLDN18.2间高度同源,要获得CLDN18.2特异性单克隆抗体,除筛选工作量大外,还存在较高的不确定性[9-10]。
DNA 免疫多用于基因治疗或作为疫苗进行疾病预防,给药途径多为辅以佐剂予以肌肉注射,或采用金包颗粒通过基因枪给药[11-13]。近年来DNA免疫也开始用于抗体制备,给药途径多为肌肉注射或者静脉注射[14]。DNA 免疫多采用重组表达质粒作为免疫原,具有抗原便于制备获得、免疫周期短、通过宿主细胞表达的抗原具有蛋白的天然结构,易于诱导机体产生针对蛋白构象性表位的单克隆抗体等优势。在本研究中,采用jetPEI-Gal 作为免疫用佐剂。jetPEI 是目前常用的动物体内转染试剂,本研究所用jetPEI-Gal 是连接了半乳糖的聚乙烯亚胺衍生物,能与DNA 形成阳离子复合物。该复合物可通过与肝细胞表面的去唾液酸糖蛋白受体特异性识别而被其大量摄取和表达。本研究虽然没有检测免疫小鼠体内的抗原表达水平,但质粒免疫2 次后获得的高滴度抗体效价也可间接反映出用于免疫的DNA在小鼠体内得到了有效表达。
除DNA 需有效表达外,其表达蛋白的免疫源性与能否有效激活宿主机体的免疫反应也密切相关。人鼠间CLDN18.2 第一胞外区的约50 个氨基酸完全相同,理论上对小鼠不具有免疫原性,但由于成熟的正常小鼠不表达或低表达CLDN18.2,在质粒DNA 进入机体并获得大量表达后,小鼠有可能将其视为异源蛋白而产生强烈的体液免疫反应。本研究成功获得了15 株CLDN18.2 特异性的高亲和力抗体,表明小鼠对DNA 免疫后的蛋白表达产生了良好的免疫反应。
本研究获得的15 株单克隆抗体在细胞ELISA、免疫沉淀、流式检测和免疫荧光实验中均能特异性识别CLDN18.2,说明它们的结合部位均位于CLDN18.2的第一胞外区,故不与CLDN18.1形成交叉反应。在与CLDN18.2 第一胞外区的结合反应中,15 株单克隆抗体在与抗原的非变性实验中,如细胞ELISA、免疫沉淀、流式检测和免疫荧光实验均可特异识别CLDN18.2,但均不能用于变性抗原的Western blot 检测,表明它们识别的是CLDN18.2 第一胞外区的空间构象,而非肽链一级结构。在CLDN18.2 第一胞外区的50 余个氨基酸中含有4 个半胱氨酸(分别位于第4、25、30 和31 位),它们可以通过二硫键形成复杂的空间构象。与CLDN18.1存在差异的8 个氨基酸中(分别位于第2、10、15、18、20、29、38 和42 位),第15 位差异氨基酸在CLDN18.2 为丙氨酸,而在CLDN18.1 中为半胱氨酸,其连同第一胞外区的其他4 个半胱氨酸可能形成更为复杂的空间构象,造成CLDN18.2 与CLDN18.1 第一胞外区的较大构象差异。本研究获得的15株抗体均与非变性蛋白反应,与变性蛋白不反应,说明它们识别的抗原表位是由CLDN18.2 胞外区肽链折叠后形成的某一特定空间构象。但要明确它们是否为识别同一构象或不同构象、是由多少位氨基酸组成的空间构象等问题,还需通过抗体竞争结合抑制实验、第一胞外区氨基酸单点及多点突变等进行进一步确定。
本研究通过DNA 免疫成功获得了15 株CLDN18.2 的特异性单克隆抗体。在后续研究中,课题组将评估所获抗体对CLDN18.2高表达肿瘤的治疗作用,并进一步探索其发挥作用的分子机制。