miR-299-5p靶向KLF3对肝癌细胞增殖、迁移的影响
王艳明 罗 波 黄 磊 (武汉市武昌医院,武汉科技大学附属武昌医院感染性疾病科,武汉 430063)
肝癌是受多种因素影响的发病于肝脏的恶性肿瘤,是导致世界范围内癌症性相关疾病死亡的第二主要原因,通常分为原发性和继发性两类,其中原发性肝癌比较常见,主要有肝区疼痛、乏力、消瘦、进行性肝肿大等不良症状,发展到后期会导致肝肾衰竭、肝癌破裂出血等,对患者的生命安全造成威胁[1-2]。早期诊断方法不足、生存率较低等原因导致我国肝癌发病率较高,因此探究能够抑制肝癌细胞增殖及迁移的靶向分子对肝癌的临床治疗具有重要意义[3]。miRNA 是内源性非编码小分子RNA,在调控基因表达方面发挥重要作用,与癌症等许多疾病密切相关,并参与细胞增殖、迁移等多种生物学进程[4-5]。多项研究显示miR-299-5p 在结直肠癌、甲状腺癌等恶性肿瘤中低表达,miR-299-5p表达上调可显著抑制肿瘤细胞的增殖及迁移[6-7]。梅博升等[8]研究发现,虎眼万年青皂苷类提取物能通过上调肝癌细胞中miR-299-5p 等多种miRNAs 的表达作用于肝癌细胞的增殖分化及凋亡过程,但关于miR-299-5p 对肝癌细胞增殖及迁移作用的影响及相关机制研究较少。资料显示人类Krüppel 样因子3(human Krüppel like factor 3,KLF3)含有同源锌指结构,能与DNA 中含有GC 的区域结合,在肺癌中表达增高,KLF3 基因敲除可抑制肺癌细胞的增殖、侵袭和迁移,诱导细胞凋亡,但关于KLF3 在肝癌细胞中的作用并不明确[9]。因此,本研究通过体外细胞实验探究miR-299-5p 对肝癌细胞增殖、迁移的调控及其与KLF3 的关系,为肝癌的诊断及临床治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 细胞来源 HL-7702 人正常肝细胞株及Hep3B、HuH-7、HepG2、SMMC-7721、MHCC97-L 人肝癌细胞株购于武汉普诺赛生命科技有限公司。
1.1.2 主要试剂 LipofectamineTM2000 Reagent(货号:11668-027)购于美国Invitrogen;RIPA 裂解液、蛋白提取试剂盒、BCA 试剂盒(货号:P0013C、P0027、P0009)购于上海碧云天公司;细胞凋亡双染试剂盒(货号:BB-4101)购于贝博生物;RNA 提取试剂盒、CCK-8 试剂盒、青链霉素混合液、胎牛血清、DMEM培养液(货号:R2220、CA1210、P1400、11011-8611、31600)购于北京索莱宝科技有限公司;KLF3、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)、Bax、Bcl-2、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、MMP-9、GAPDH 抗体、羊抗兔IgG(货号:ab154531、ab13847、ab32503、ab321124、ab92536、ab76003、ab8245、ab150077)购于英国Abcam。
1.1.3 主要仪器 细胞培养箱(型号:MCO-15AC)购于日本SANYO;倒置显微镜(型号:TS100)购于日本Nikon;细胞计数器(型号:NC-100)购于丹麦Chemimetec;PCR 仪(型号:simpliamp)购于美国ABI;流式细胞仪(型号:Accuri C6)购于美国BD;酶标仪(型号:XElx800)购于美国Perkin Elmer公司。
1.2 方法
1.2.1 细胞培养 将HL-7702、Hep3B、HuH-7、HepG2、SMMC-7721、MHCC97-L 细胞株置于37 ℃水浴锅中快速融化,转移至特定离心管,悬浮接种于培养瓶,培养过程均用含1%双抗、10%胎牛血清的DMEM 培养液,于37 ℃、含5%CO2的培养箱中培养,每2 d更换1次培养液,传代培养。
1.2.2 细胞分组及pcRNA 转染 收集对数生长期的HepG2 肝癌细胞,以4×106个/ml接种于6 孔板,每孔2 ml,待细胞贴壁后分为空白对照组、阴性对照组、miR-299-5p 组、miR-299-5p+pc-KLF3 组,按照转染试剂盒说明书转染,阴性对照组转染阴性mimic,miR-299-5p 组转染miR-299-5p mimic,miR-299-5p+pc-KLF3 组共转染miR-299-5p mimic 及pc-KLF3,转染结束后于37 ℃、5%CO2条件下培养6 h,PBS 洗涤2次后加入含1%双抗、10%胎牛血清的DMEM 培养液,继续37 ℃、5%CO2培养24 h,收集各组HepG2 肝癌细胞进行后续实验。
1.2.3 qRT-PCR 检测肝癌细胞中miR-299-5p 表达 参照RNA 提取试剂盒说明书提取肝癌细胞、正常肝细胞、1.2.2中各组细胞的总RNA,根据逆转录试剂盒说明书反转录得到cDNA。miR-299-5p 正向引物:5'-ACACTCCAGCTGGGTGGTTTACCGTCCCAC-3',反向引物:5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGATGTATGT-3';内参U6 正向引物:5'-CTCGCTTCGGCAGCACA-3',反向引物:5'-AACGCTTCACGAATTTGCGT-3'。总反应体系为20 µl:2×SYBR Mix 10 µl,H2O 8 µl,正反向引物各0.5 µl,10× cDNA 模板1 µl。反应条件设定为:95 ℃预变性10 min,95 ℃变性10 s、60 ℃退火延伸50 s,共40 个循环,72 ℃延伸10 min。根据2−ΔΔCt算法分析各肝癌细胞、正常肝细胞、1.2.2 中各组细胞miR-299-5p表达量。实验重复3次。
1.2.4 荧光素酶报告试验 采用TargetScan 数据库(http://www.targetscan.org/vert_71/)分析预测miR-299-5p 与KLF3 的靶向作用位点,构建野生型(WT)和突变型(MUT)基因靶点KLF3 的3'-UTR 荧光素酶表达载体,分别转染至阴性对照组和miR-299-5p 组HepG2 肝癌细胞,转染后48 h 测定荧光素酶活性。实验重复3次。
1.2.5 CCK-8 法检测HepG2 肝癌细胞增殖情况 取各组HepG2 细胞,以5×106个/孔接种于96 孔板,分别在转染0 h、12 h、24 h、48 h 后,每孔加入CCK-8试剂10µl 和9 µl 培养基,继续培养2 h。于全自动酶标仪中检测每孔细胞的吸光度值。实验重复3次。
1.2.6 流式细胞术检测HepG2 肝癌细胞凋亡情况 参考文献[10]采用Annexin V-FITC/PI 细胞凋亡双染试剂盒测定细胞凋亡,各组HepG2细胞采用胰蛋白酶消化,消化结束后调整细胞密度为1×106个/ml,转移至无菌1.5 ml EP 管,经PBS 清洗、70%乙醇溶液4 ℃固定过夜、PBS 溶液清洗后离心并重悬细胞,依次加入2µl RNA酶、1µl Triton X-100,静置45 min后加入2 µl PI 溶液染色1 h,于流式细胞仪观察细胞凋亡情况。实验重复3次。
1.2.7 Transwell 小室实验检测HepG2 肝癌细胞侵袭能力 收集各组HepG2细胞,调整细胞浓度至2×105个/ml,取200 µl 细胞液加入预铺设好的Transwell 小室上室,以RPMI1640 培养液补至1 ml,下室加入600µl完全培养基。培养48 h后擦拭未过膜的细胞,置于4%多聚甲醛中固定20 min,室温条件下风干,采用1%结晶紫染液浸染20 min,室温条件下风干,于光学显微镜下观察小室细胞侵袭情况。随机取6 个视野,计算穿过Matrigel 基质的平均细胞数[11]。实验重复3次。
1.2.8 划痕实验检测HepG2肝癌细胞迁移能力 收集各组HepG2 细胞,将细胞置于恒温培养箱(37 ℃、5%CO2)中继续培养,待细胞铺满板内85%左右时,以200 µl 枪头垂直于6 孔板底部做直线划痕,然后将细胞继续置于恒温培养箱(37 ℃、5%CO2)中培养24 h 后,倒置光学显微镜下拍照(×100)观察,利用Image J 软件测量划痕区域宽度,并计算细胞划痕愈合率[12]。实验重复3次。
1.2.9 Western blot 检测 采用Western blot 检测1.2.2 中各组细胞KLF3、细胞凋亡相关因子相关蛋白的表达,RIPA 裂解液提取各组细胞总蛋白,BCA蛋白试剂盒测定细胞中总蛋白含量,采用SDSPAGE 分离蛋白,半干转膜法将蛋白转移至硝酸纤维膜,5% 脱脂牛奶封闭,于4 ℃下添加KLF3、Caspase-3、Bax、Bcl-2、MMP-2、MMP-9 兔抗鼠一抗与GAPDH(1∶500)孵育过夜,TBST 缓冲液洗涤后添加二抗(辣根过氧化物酶缀合的二抗,1∶5 000)常温下孵育2 h。采用蛋白成像凝胶仪对KLF3、凋亡相关蛋白(Caspase-3、Bax、Bcl-2)、迁移相关蛋白(MMP-2、MMP-9)水平进行半定量分析。实验重复3次。
1.3 统计学分析 以SPSS22.0软件对实验数据进行统计分析,计量资料以±s表示,组间比较采用单因素方差分析,进一步两组间比较行LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 人肝癌细胞株中miR-299-5p表达水平比较 与HL-7702 细胞相比,Hep3B、HuH-7、HepG2、SMMC-7721、MHCC97-L 细胞中miR-299-5p 表达水平显著降低(P<0.05),其中HepG2 细胞株中miR-299-5p 表达水平最低,选取HepG2 细胞株进行后续实验(表1)。
表1 人肝癌细胞株中miR-299-5p表达水平比较(±s,n=3)Tab.1 Comparison of miR-299-5p expression level in human hepatoma cell lines(±s,n=3)
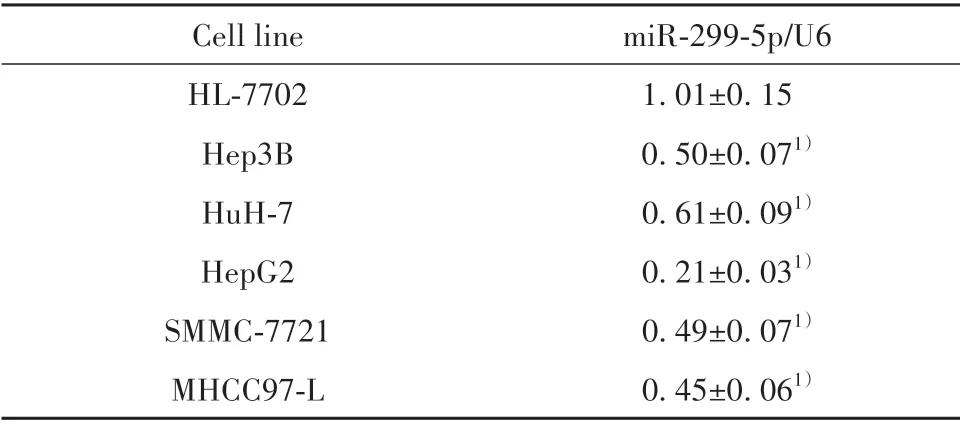
表1 人肝癌细胞株中miR-299-5p表达水平比较(±s,n=3)Tab.1 Comparison of miR-299-5p expression level in human hepatoma cell lines(±s,n=3)
Note:Compared with HL-7702 cell line,1)P<0.05.
miR-299-5p/U6 1.01±0.15 0.50±0.071)0.61±0.091)0.21±0.031)0.49±0.071)0.45±0.061)Cell line HL-7702 Hep3B HuH-7 HepG2 SMMC-7721 MHCC97-L
2.2 各组HepG2 细胞中miR-299-5p 及KLF3 蛋白表达水平比较 与空白对照组相比,miR-299-5p 组及miR-299-5p+pc-KLF3 组HepG2 细胞中miR-299-5p表达水平显著升高(P<0.05),KLF3 蛋白表达水平显著降低(P<0.05);与miR-299-5p 组相比,miR-299-5p+pc-KLF3 组HepG2 细胞中KLF3 蛋白表达水平显著升高(P<0.05)。见图1、表2。
表2 各组HepG2细胞中miR-299-5p及KLF3蛋白表达水平比较(±s,n=3)Tab.2 Comparison of miR-299-5p and KLF3 protein expression levels in HepG2 cells of each group(±s,n=3)
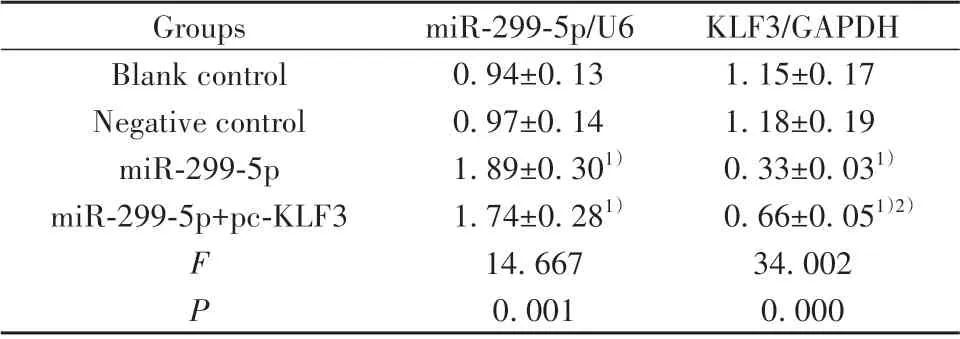
表2 各组HepG2细胞中miR-299-5p及KLF3蛋白表达水平比较(±s,n=3)Tab.2 Comparison of miR-299-5p and KLF3 protein expression levels in HepG2 cells of each group(±s,n=3)
Note:Compared with blank control group,1)P<0.05;compared with miR-299-5p group,2)P<0.05.
KLF3/GAPDH 1.15±0.17 1.18±0.19 0.33±0.031)0.66±0.051)2)34.002 0.000 Groups Blank control Negative control miR-299-5p miR-299-5p+pc-KLF3 F P miR-299-5p/U6 0.94±0.13 0.97±0.14 1.89±0.301)1.74±0.281)14.667 0.001
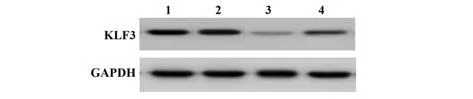
图1 各组HepG2细胞中KLF3蛋白表达情况Fig.1 Expression of KLF3 protein in HepG2 cells of each group
2.3 miR-299-5p与KLF3的靶向关系预测及验证 TargetScan 数据库预测结果显示,miR-299-5p 在KLF3 3'-UTR区有相应的结合位点(图2);荧光素酶报告实验结果显示,与KLF3 WT+阴性对照组相比,KLF3 WT+miR-299-5p 组HepG2 细胞荧光素酶活性显著降低(P<0.05),KLF3 MUT+阴性对照组与KLF3 MUT+miR-299-5p 组相比差异无统计学意义(P>0.05)。见表3。
表3 荧光素酶报告实验检测miR-299-5p 与KLF3 的靶向作用关系(±s,n=3)Tab.3 Relationship between miR-299-5p and KLF3 by luciferase reporter assay(±s,n=3)
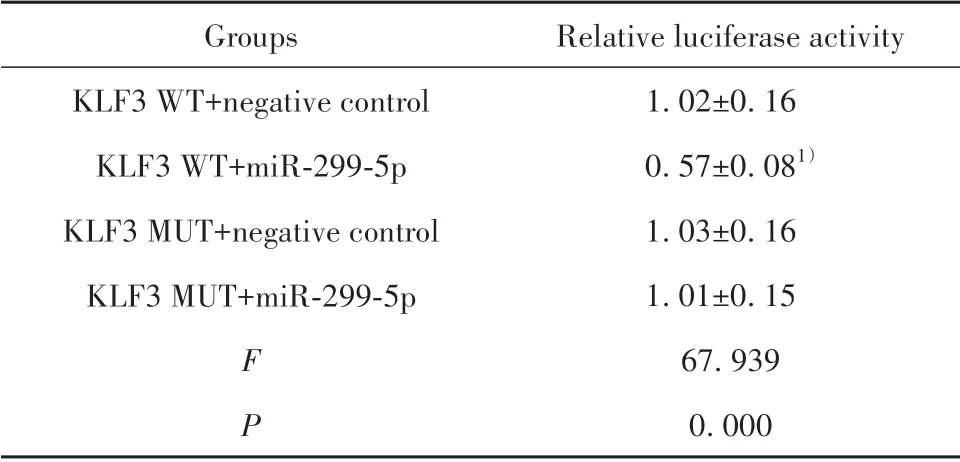
表3 荧光素酶报告实验检测miR-299-5p 与KLF3 的靶向作用关系(±s,n=3)Tab.3 Relationship between miR-299-5p and KLF3 by luciferase reporter assay(±s,n=3)
Note:Compared with KLF3 WT+negative control group,1)P<0.05.
Relative luciferase activity 1.02±0.16 0.57±0.081)1.03±0.16 1.01±0.15 67.939 0.000 Groups KLF3 WT+negative control KLF3 WT+miR-299-5p KLF3 MUT+negative control KLF3 MUT+miR-299-5p F P

图2 miR-299-5p与KLF3的3'-UTR区序列相互结合Fig.2 Interaction between miR-299-5p and 3'-UTR region of KLF3
2.4 各组HepG2 细胞增殖情况比较 与空白对照组、阴性对照组相比,miR-299-5p 组HepG2 细胞增殖能力在24 h和48 h时显著下降(P<0.05);与miR-299-5p 组相比,miR-299-5p+pc-KLF3 组HepG2 细胞增殖能力在48 h时显著提高(P<0.05)。见表4、图3。

图3 各组HepG2细胞增殖情况比较Fig.3 Comparison of proliferation of HepG2 cells in each group
表4 各组HepG2细胞增殖情况比较(±s,n=3)Tab.4 Comparison of proliferation of HepG2 cells in each group(±s,n=3)
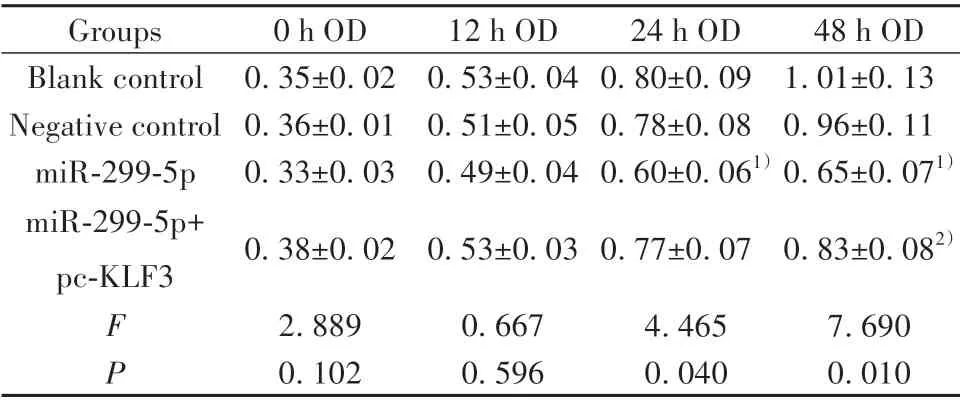
表4 各组HepG2细胞增殖情况比较(±s,n=3)Tab.4 Comparison of proliferation of HepG2 cells in each group(±s,n=3)
Note:Compared with blank control group,1)P<0.05;compared with miR-299-5p group,2)P<0.05.
48 h OD 1.01±0.13 0.96±0.11 0.65±0.071)0.83±0.082)7.690 0.010 Groups Blank control Negative control miR-299-5p miR-299-5p+pc-KLF3 F P 0 h OD 0.35±0.02 0.36±0.01 0.33±0.03 0.38±0.02 2.889 0.102 12 h OD 0.53±0.04 0.51±0.05 0.49±0.04 0.53±0.03 0.667 0.596 24 h OD 0.80±0.09 0.78±0.08 0.60±0.061)0.77±0.07 4.465 0.040
2.5 各组HepG2 细胞凋亡情况比较 与空白对照组、阴性对照组相比,miR-299-5p 组及miR-299-5p+pc-KLF3 组HepG2 细胞凋亡率、Caspase-3、Bax 蛋白表达显著升高(P<0.05),Bcl-2 蛋白表达显著降低(P<0.05);与miR-299-5p 组相比,miR-299-5p+pc-KLF3 组细胞凋亡率、Caspase-3、Bax 蛋白显著降低(P<0.05),Bcl-2 蛋白表达显著升高(P<0.05)。见图4、5、表5。
表5 各组HepG2细胞凋亡情况比较(±s,n=3)Tab.5 Comparison of apoptosis of HepG2 cells in each group(±s,n=3)
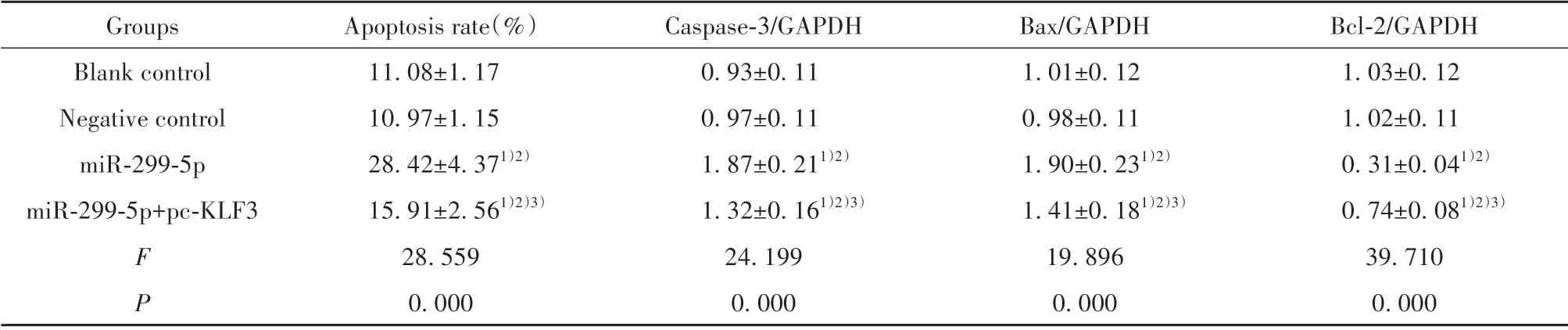
表5 各组HepG2细胞凋亡情况比较(±s,n=3)Tab.5 Comparison of apoptosis of HepG2 cells in each group(±s,n=3)
Note:Compared with blank control group,1)P<0.05;compared with negative control group,2)P<0.05;compared with miR-299-5p group,3)P<0.05.
Bcl-2/GAPDH 1.03±0.12 1.02±0.11 0.31±0.041)2)0.74±0.081)2)3)39.710 0.000 Groups Blank control Negative control miR-299-5p miR-299-5p+pc-KLF3 Apoptosis rate(%)11.08±1.17 10.97±1.15 28.42±4.371)2)15.91±2.561)2)3)28.559 0.000 Caspase-3/GAPDH 0.93±0.11 0.97±0.11 1.87±0.211)2)1.32±0.161)2)3)24.199 0.000 Bax/GAPDH 1.01±0.12 0.98±0.11 1.90±0.231)2)1.41±0.181)2)3)19.896 0.000 F P
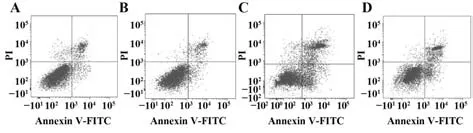
图4 各组HepG2细胞凋亡情况比较Fig.4 Comparison of apoptosis of HepG2 cells in each group
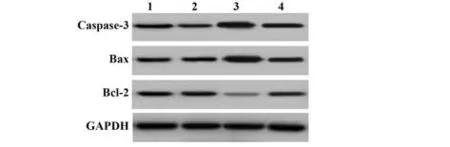
图5 各组HepG2细胞凋亡相关因子蛋白表达情况比较Fig.5 Comparison of protein expressions of apoptosis related factors in HepG2 cells of each group
2.6 各组HepG2 细胞侵袭及迁移情况比较 与空白对照组、阴性对照组相比,miR-299-5p 组及miR-299-5p+pc-KLF3 组HepG2 细胞侵袭细胞数及划痕愈合率、MMP-2、MMP-9 蛋白表达水平显著降低(P<0.05);与miR-299-5p 组相比,miR-299-5p+pc-KLF3组肝癌细胞侵袭细胞数及划痕愈合率、MMP-2、MMP-9 蛋白表达水平显著提高(P<0.05)。见表6、图6~8。
表6 各组HepG2细胞侵袭及迁移情况比较(±s,n=3)Tab.6 Comparison of invasion and migration of HepG2 cells in each group(±s,n=3)

表6 各组HepG2细胞侵袭及迁移情况比较(±s,n=3)Tab.6 Comparison of invasion and migration of HepG2 cells in each group(±s,n=3)
Note:Compared with blank control group,1)P<0.05;compared with negative control group,2)P<0.05;compared with miR-299-5p group,3)P<0.05.
MMP-9/GAPDH 0.97±0.12 1.01±0.14 0.31±0.041)2)0.72±0.081)2)3)29.569 0.000 Groups Blank control Negative control miR-299-5p miR-299-5p+pc-KLF3 Number of invasive cells(n)142.60±25.02 143.00±25.13 66.58±10.111)2)93.42±12.601)2)3)11.338 0.003 Wound healing rate(%)25.66±2.37 26.12±2.43 9.08±1.161)2)20.11±1.841)2)3)46.395 0.000 F P MMP-2/GAPDH 1.02±0.12 0.98±0.11 0.26±0.061)2)0.73±0.081)2)3)40.140 0.000
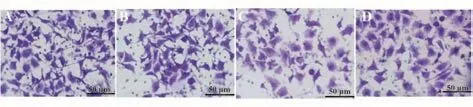
图6 各组HepG2细胞侵袭情况比较Fig.6 Comparison of invasion of HepG2 cells in each group
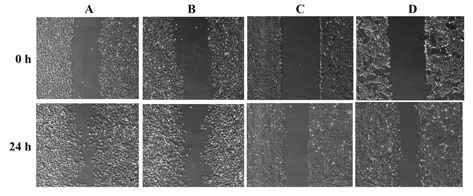
图7 各组HepG2肝癌细胞迁移情况比较Fig.7 Comparison of migration of HepG2 cells in each group
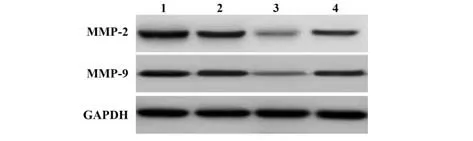
图8 各组HepG2细胞迁移相关蛋白表达Fig.8 Expressions of migration related proteins of HepG2 cells in each group
3 讨论
miRNA 是进化保守性的非编码单链RNA,广泛存在于生物体细胞及组织中,通过调控基因表达参与肝癌等多种肿瘤疾病的发生、分化及转移,肝癌发病机制复杂,研究表明miRNA 表达异常可影响肝癌细胞的增殖、凋亡、侵袭和转移等生物学过程[13]。miR-299-5p是miRNA家族成员,研究表明miR-299-5p在胃癌患者组织中低表达,可作为肿瘤标志物诊断胃癌的发生[14];miR-299-5p 在头颈部鳞状细胞癌中也呈低表达[15]。本研究结果显示,与正常肝细胞株相比,肝癌细胞中miR-299-5p 表达水平显著降低,提示miR-299-5p 可能在某种程度上参与了肝癌的发生与发展。因涉及转染实验,故选取miR-299-5p表达水平较低的HepG2肝癌细胞进行后续实验。
KLF 家族是真核生物的一类基础转录因子,目前在人类基因组中识别出18 种KLFs,分别为KLF1~18[16]。KLF 家族具有调节富含CACCC 和GC启动子基因表达作用,在细胞增殖、分化、凋亡、脂肪形成、肿瘤生成、转移等过程中发挥重要作用[17]。研究表明miR-1224 在肺癌组织中低表达,miR-1224表达上调后可通过与KLF3 的3'-UTR 区结合下调KLF3表达,进而抑制肺癌细胞的增殖和凋亡[18]。转染实验结果显示,miR-299-5p 组及miR-299-5p+pc-KLF3 组HepG2 肝癌细胞中miR-299-5p 表达水平显著高于空白对照组,KLF3蛋白表达水平显著低于空白对照组,表明miR-299-5p 具有下调KLF3 表达的作用,可能与肝癌细胞的增殖、迁移等生物学行为存在一定联系。miRNA 常结合到靶基因的3'-UTR区,从而调控靶基因功能,通过查阅TargetScan 数据库预测KLF3 是miR-299-5p 的潜在靶基因,荧光素酶报告实验结果验证miR-299-5p 过表达能显著下调野生型KLF3-3'UTR 荧光素酶活性,表明在肝癌细胞中miR-299-5p 可直接作用于KLF3 的3'-UTR区,进而调控KLF3的基因表达。
正常的细胞增殖、凋亡存在动态平衡,癌细胞的增殖、凋亡抵抗、侵袭、迁移等均是肿瘤细胞重要的恶性生物学行为,受细胞周期等多种机制调控[19]。李楠等[20]和郭令飞等[21]研究发现miR-299-5p 过表达可显著抑制胃癌细胞增殖活力,并促进胃癌细胞凋亡。本研究结果显示,过表达miR-299-5p 可显著抑制HepG2 细胞的增殖活性,诱导其凋亡,并显著降低其侵袭及迁移能力。细胞凋亡相关因子(Caspase-3、Bax、Bcl-2)在肿瘤细胞及正常细胞中表达水平不同,测定这些因子的表达水平可反映细胞凋亡情况[22]。细胞迁移相关因子(MMP-2、MMP-9)与癌细胞的浸润、转移密切相关[23]。本研究结果显示,过表达miR-299-5p可显著提高Caspase-3、Bax蛋白表达水平,降低Bcl-2、MMP-2、MMP-9 表达水平,QIAN 等[24]研究显示,miR-1204 可通过抑制DEK 表达促进肺癌细胞凋亡,并显著降低Bcl-2 表达,提高Bax 表达,PENG 等[25]研究发现miR-1301-3p 通过靶向ICT1 促进乳腺癌细胞凋亡,并下调Bcl-2 表达,上调Bax表达,与本研究结果类似,表明miR-299-5p可能通过其他信号通路调控肝癌细胞的增殖及迁移活性,因此仍需深入研究。
综上所述,过表达miR-299-5p 可降低HepG2 肝癌细胞的增殖、侵袭及迁移能力,促进HepG2 细胞凋亡,可能与miR-299-5p 作用于KLF3 有关,但肝癌细胞增殖机制复杂,仍需深入研究。